PNAS/Adv Sci 重庆医科大学孙阳课题组连续报道抗动脉粥样硬化新靶点
2025-03-24 论道心血管 论道心血管 发表于陕西省
重庆医科大学孙阳课题组发现 RBPMS 可抑制 VSMC 驱动的斑块纤维帽形成和再狭窄;还发现靶向 AIP-HM13/SPP 轴或抑制 HM13/SPP 活性可抑制动脉粥样硬化进展。
动脉粥样硬化是许多心血管疾病的共同病理基础,全球每年约有1800万人死于动脉粥样硬化引起的心脑血管相关疾病,这些疾病与动脉粥样硬化斑块破裂直接相关。目前,抗动脉粥样硬化药物主要包括调整血脂药物(如应用最为广泛的他汀类药物)、抗血小板药物和改善心脏重构/预后的药物。然而,在“后他汀时代”,任何新的药物不仅要作为单一疗法显示出抗动脉粥样硬化作用,还必须显示出增量效益,这对开发新型抗动脉粥样硬化药物提出了更高的要求,也促使研究者发现更为精准有效的抗动脉粥样硬化新靶点。
动脉粥样硬化和血管壁创伤会诱导血管平滑肌细胞(VSMC)表型转变,从而导致斑块纤维帽的生长和干预后再狭窄,进而影响经皮干预动脉粥样硬化性疾病的长期疗效。因此,揭示VSMC表型转变的调控机制,有望提高动脉粥样硬化纤维帽稳定性并降低干预后再狭窄的发生风险。
2025年3月4日,重庆医科大学孙阳课题组在PNAS上发表了题为“The RNA-binding protein RBPMS inhibits smooth muscle cell-driven vascular remodeling in atherosclerosis and vascular injury”的研究论文,该研究揭示了mRNA加工因子(RBPMS)增强动脉粥样硬化和受损血管中的Myocd_v3/Myocd_v1转录平衡,有望抑制VSMC驱动的斑块纤维帽形成和干预诱导的再狭窄。

该研究首先通过生物信息学技术分析发现RBPMS基因表达与鼠和人动脉粥样硬化动脉的收缩性VSMC分化呈正相关,并发现RBPMS基因表达在动脉粥样硬化斑块中下调,且与收缩性VSMC标记物呈正相关。
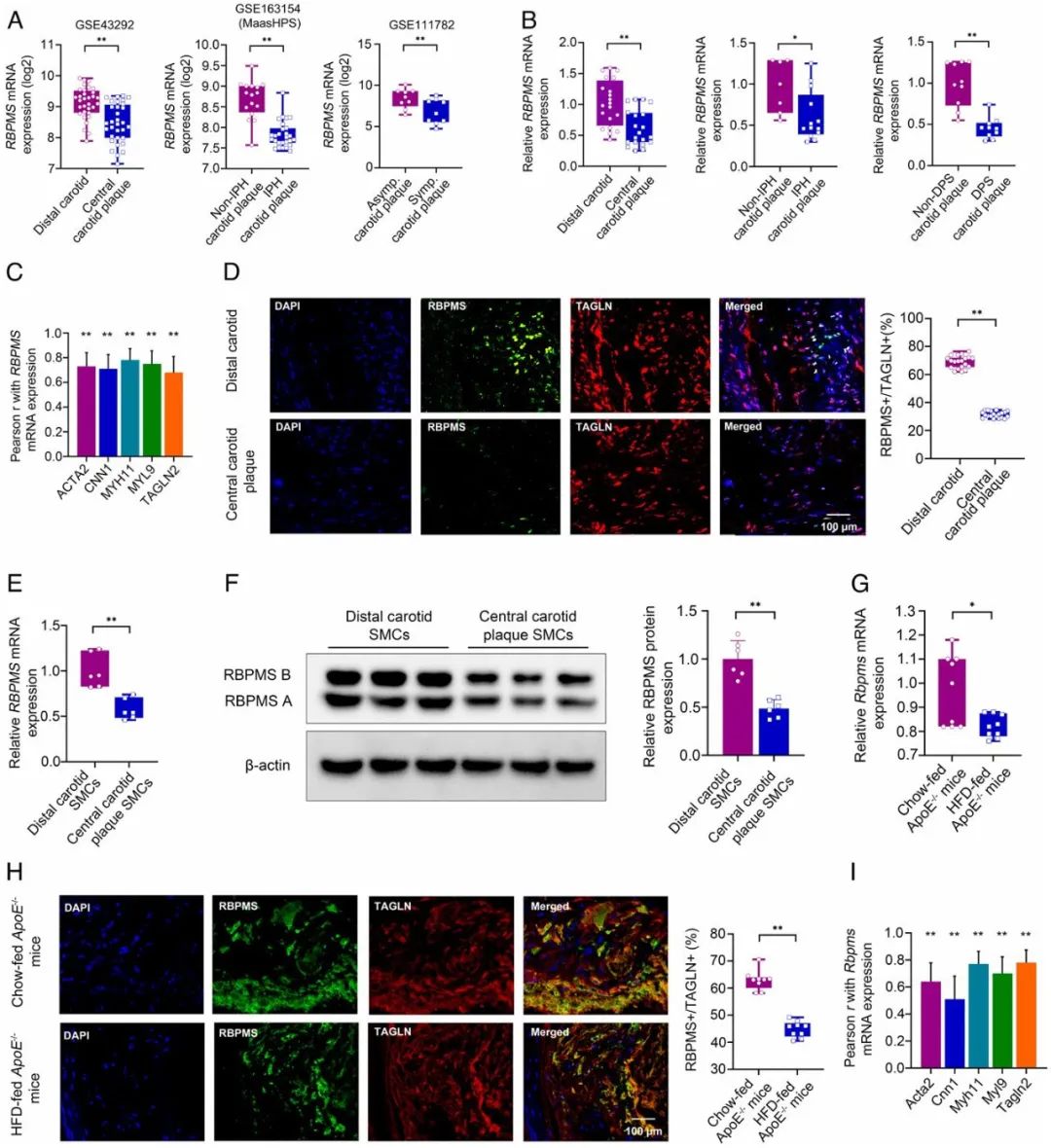
该团队进一步揭示了在VSMC中驱动RBPMS下调的生理信号,发现血小板衍生的生长因子(PDGF)-BB通过促进ELK1磷酸化来下调RBPMS基因表达,动物实验也表明RBPMS减少了动脉粥样硬化斑块纤维帽的发展和干预后动脉管腔狭窄。从机制上讲,RBPMS介导VSMC主调节器Myocd的表达和替代剪接。转录辅激活因子Myocd与位于收缩装置基因启动子和内含子区域内的调节CArG-box序列相互作用,被认为是VSMC分化的主要调节因子。具体而言,RBPMS通过结合Myocd前体mRNA的CAC1/2序列,促进外显子2a的保留,生成促进收缩表型的Myocd_v3a亚型,抑制促增殖的Myocd_v1亚型。
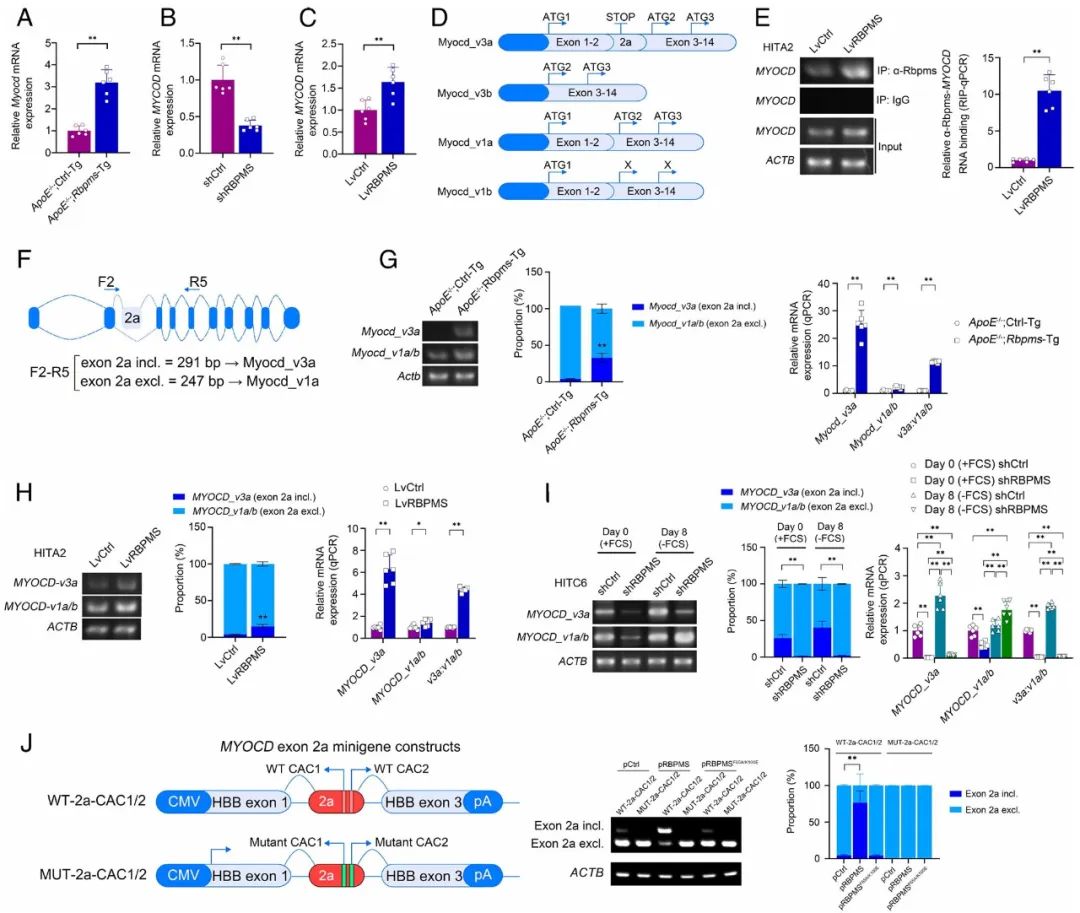
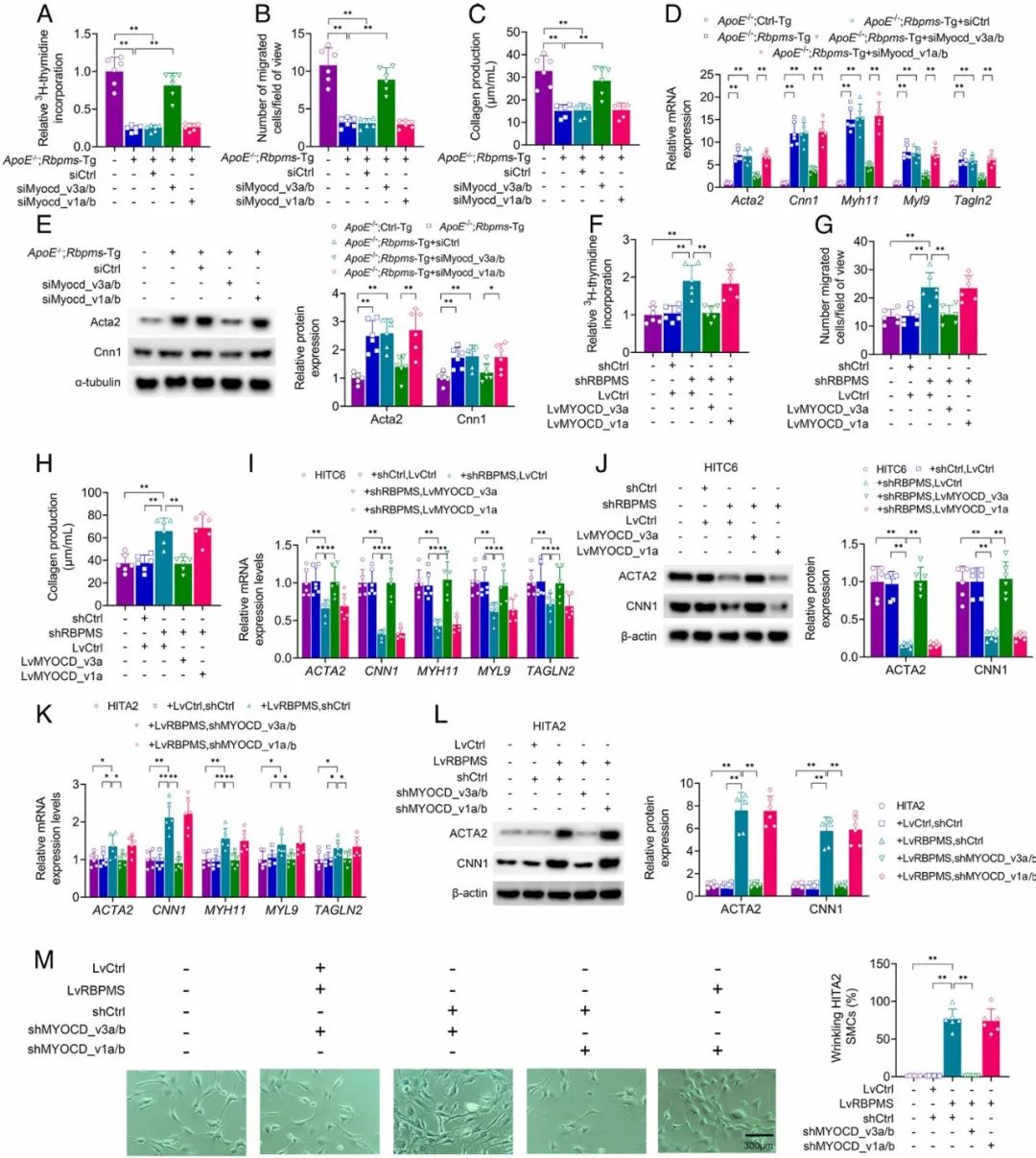
总之,RBPMS通过维持VSMC的收缩表型,抑制动脉粥样硬化斑块的纤维帽形成和血管介入后的再狭窄,可能成为新型动脉粥样硬化治疗靶点。
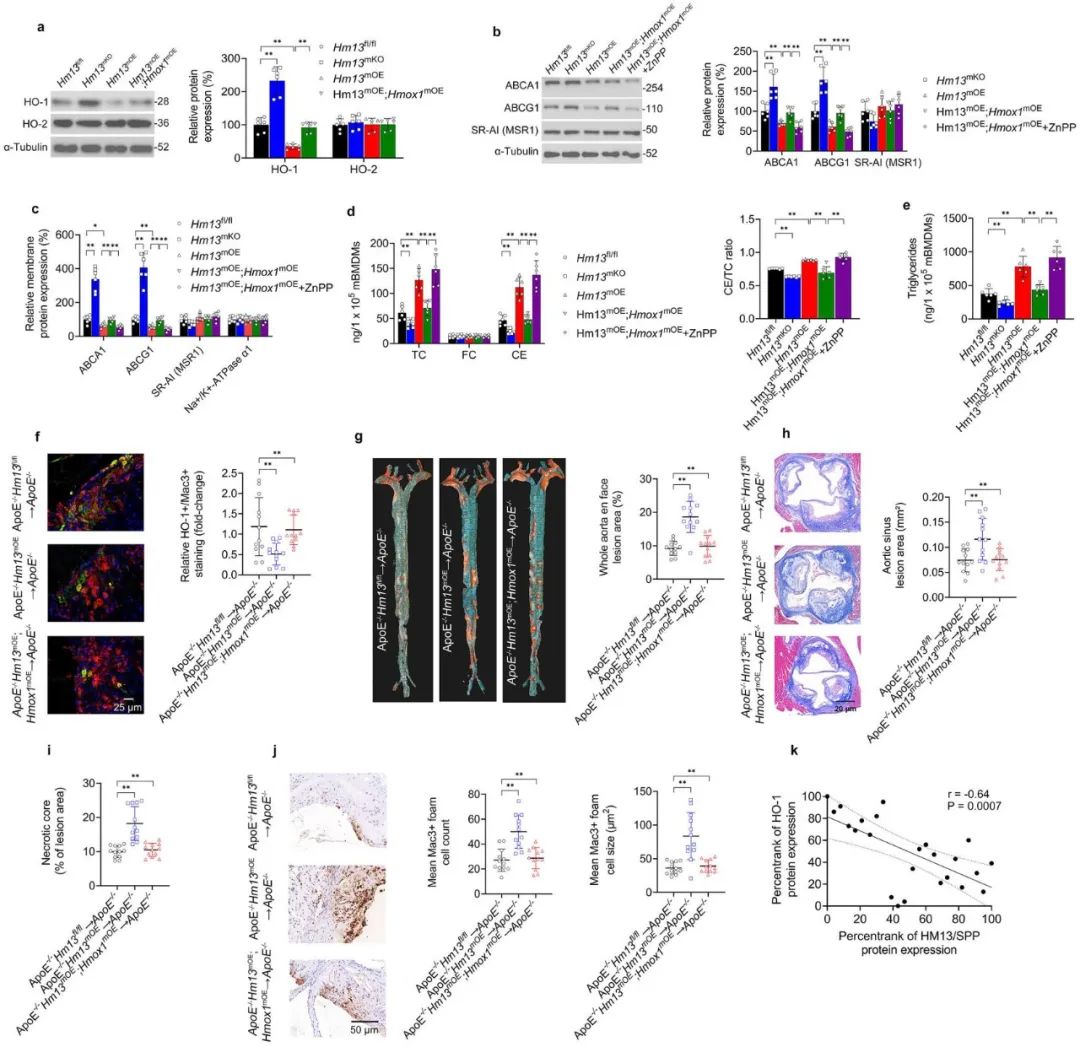
2025年3月20日,重庆医科大学孙阳课题组又在Advanced Science上发表了题为“Macrophage HM13/SPP Enhances Foamy Macrophage Formation and Atherogenesis”的研究论文,该研究报道靶向AIP-HM13/SPP轴或抑制HM13/SPP活性可能减少泡沫巨噬细胞形成,从而抑制动脉粥样硬化进展。

泡沫巨噬细胞形成是动脉粥样硬化进程中的关键因素。芳香烃受体相互作用蛋白(AIP)可减少巨噬细胞胆固醇酯的积累,并可能防止致动脉粥样硬化泡沫巨噬细胞的形成。该研究首先以加权基因共表达网络分析(WGCNA)鉴定出人动脉粥样硬化斑块中的三个AIP相关基因模块,并进一步确定模块中ERAD蛋白酶基因HM13在动脉粥样硬化斑块组中显著上调,表明HM13可能有助于动脉粥样硬化进展。在后续研究中,团队发现AIP可抑制HM13反式激活,从而抑制了巨噬细胞脂质的积累;同时,氧化低密度脂蛋白(oxLDL)下调了巨噬细胞AIP mRNA和蛋白质表达,并上调HM13/SPP mRNA和蛋白质表达。
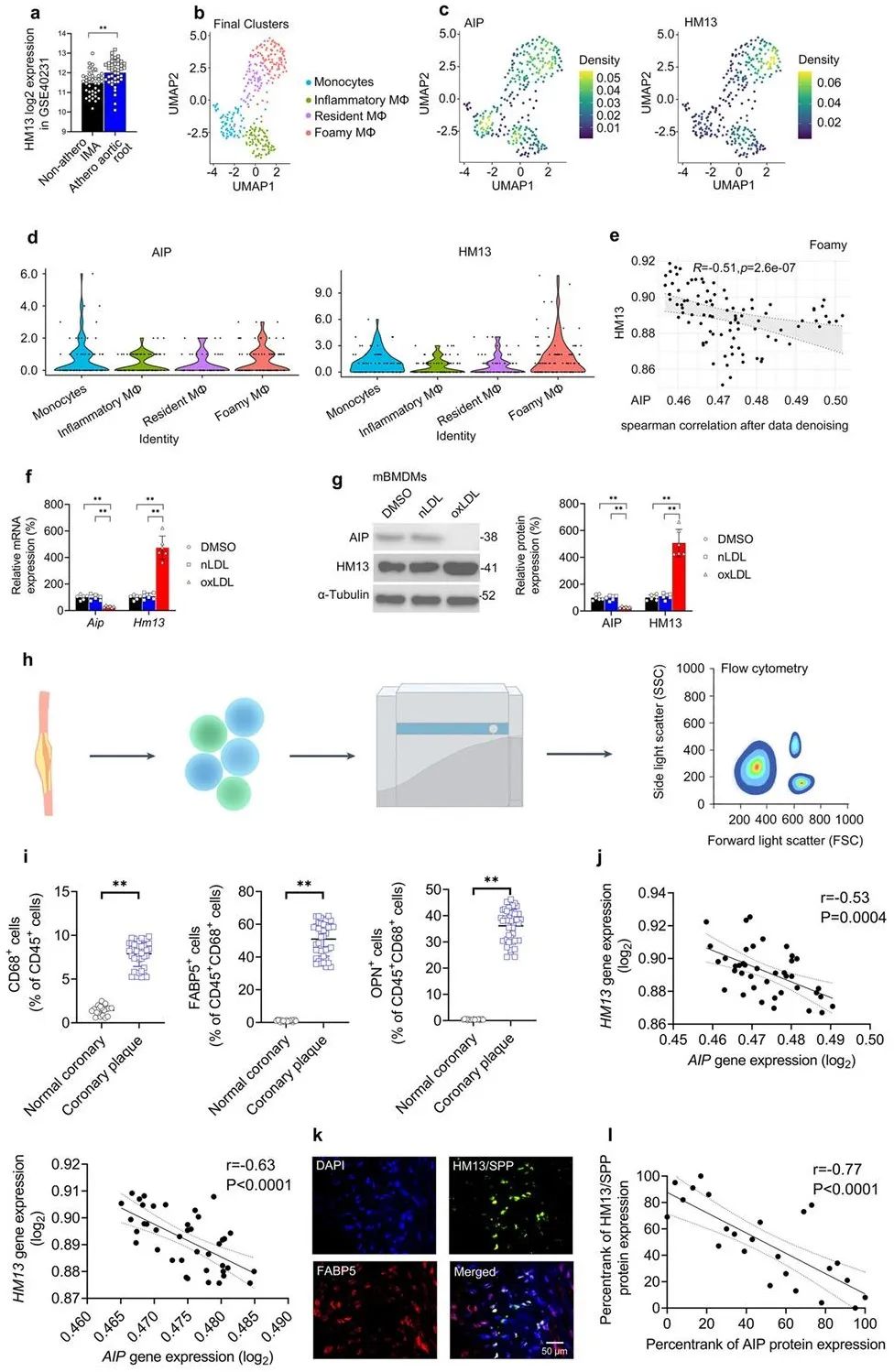
该研究随后在动物实验中证实巨噬细胞HM13/SPP增强了oxLDL诱导的泡沫巨噬细胞形成和促炎性特性,髓样HM13/SPP增加了高脂症动脉粥样硬化的两个小鼠模型中的斑块负担和泡沫巨噬细胞负荷。从机制上讲,巨噬细胞HM13/SPP裂解代谢调节剂HO-1,从而促进HO-1蛋白酶体降解,并通过HO-1降解增强泡沫巨噬细胞的形成和动脉粥样硬化。此外,巨噬细胞HM13/SPP裂解HO-1也可以导致VSMC表型转变,可能导致斑块脆弱性增加。
重庆医科大学孙阳教授为上述两篇论文的通讯作者,昆明理工大学蒋立虹教授为论文的共同通讯作者。以上工作受到国家自然科学基金(81871369、81960095、82460095)和云南省科学技术厅项目(202301AY070001-001)资助。
论文链接:
https://www.pnas.org/doi/10.1073/pnas.2415933122
https://advanced.onlinelibrary.wiley.com/doi/10.1002/advs.202412498

本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言

















#动脉粥样硬化# #RBPMS#
7