JACC-BTS 南京医科大学第一附属医院贾恩志教授团队揭示巨噬细胞PGAM5调控动脉粥样硬化的作用及机制
15小时前 论道心血管 论道心血管 发表于陕西省
该研究揭示了巨噬细胞PGAM5-ANGPTL3信号在巨噬细胞-平滑肌细胞/内皮细胞间通讯的效应,为AS治疗提供了潜在的治疗靶点。
动脉粥样硬化(atherosclerosis, AS)是以内皮下脂质沉积驱动的慢性炎症反应、纤维组织增生、粥样斑块形成和管腔狭窄为主要特征的疾病。AS相关机制涉及脂质蓄积、代谢失衡、细胞死亡、炎症、纤维化和细胞间通讯。在血管细胞中,巨噬细胞是AS病变形成的关键介质。斑块局部的巨噬细胞吞噬脂质后形成泡沫细胞,产生促炎因子和诱导局部炎症环境,介导AS病变过程。此外,巨噬细胞释放的分泌物质参与巨噬细胞与其他血管细胞(如血管平滑肌细胞和血管内皮细胞)之间的细胞通讯,从而影响斑块。研究并阐明AS的分子机制,探索潜在的治疗靶点具有重要的科学价值与临床意义。
受体相互作用蛋白激酶3 (receptor-interacting protein kinase-3,RIPK3)是一种环境应激的感受器,已知在AS中激活程序性坏死信号。磷酸甘油酸变位酶5 (phosphoglycerate mutase 5, PGAM5)作为程序性坏死蛋白复合物的组装平台,最初被鉴定为程序性坏死的关键调节因子。随后,PGAM5的功能作用被证实不仅仅是调节程序性坏死,还参与调控线粒体动力学、炎症反应、脂肪酸氧化等。然而,RIPK3和PGAM5是否参与了AS的调控和具体机制尚不清楚。
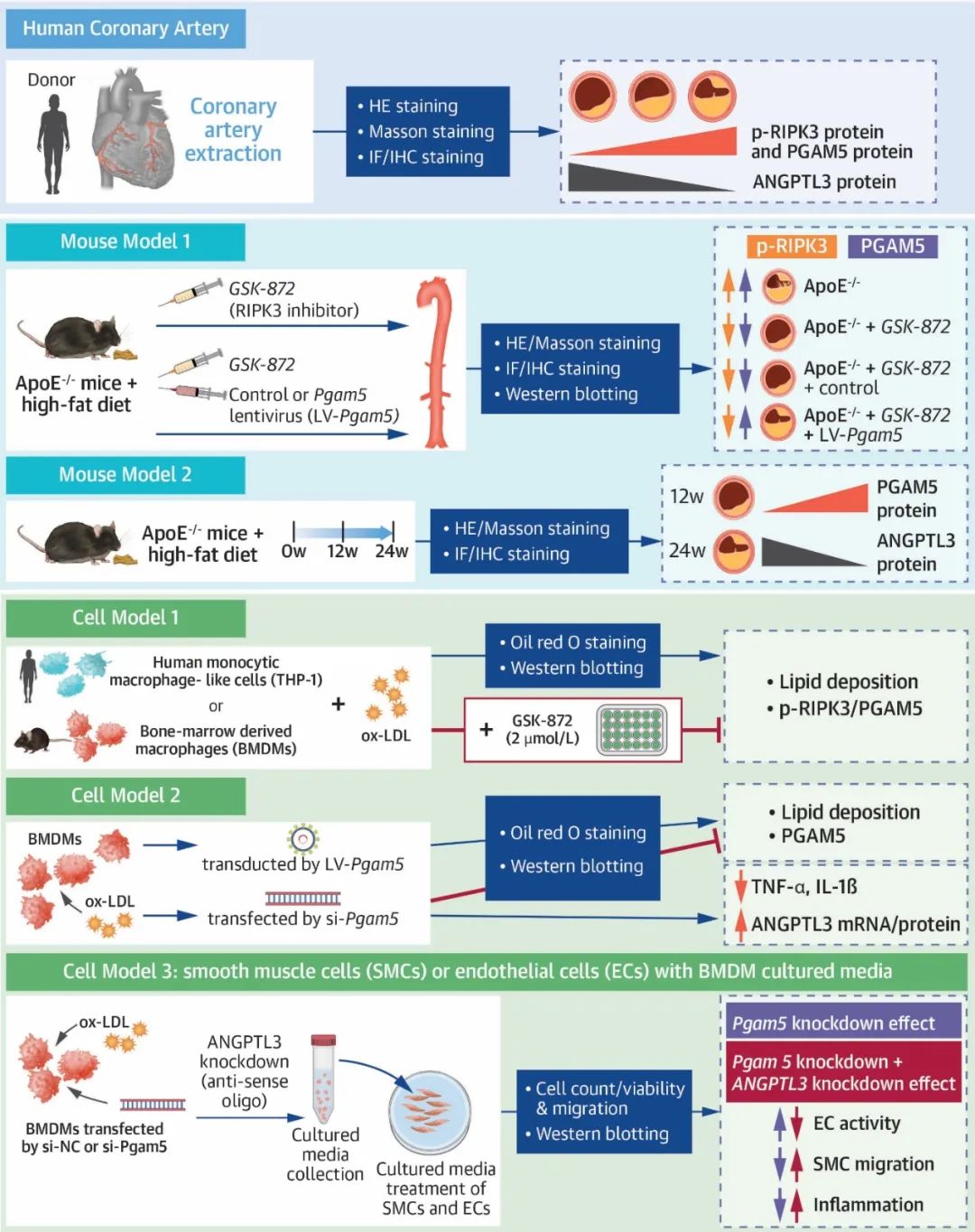
2025年3月13日,南京医科大学第一附属医院心血管内科贾恩志教授团队在JACC: Basic to Translational Science发表了题为“Phosphoglycerate mutase 5 is important mediator for instigating arterial lipid accumulation and aggravating atherosclerosis”的研究论文。研究结果发现,人类和小鼠AS病变中巨噬细胞磷酸化RIPK3和PGAM5的表达水平显著升高。在体内外模型中,巨噬细胞PGAM5过表达均加重AS病变。巨噬细胞PGAM5敲低可促进血管生成素样蛋白3 (angiopoietin-like protein 3, ANGPTL3)基因和蛋白表达,减少炎症因子释放,通过细胞通讯抑制内皮细胞和平滑肌细胞的炎症和迁移。该研究系统性地探索了巨噬细胞PGAM5以非坏死性凋亡的效应介导AS病变及调控下游ANGPTL3的功能,揭示了巨噬细胞PGAM5-ANGPTL3信号在巨噬细胞-平滑肌细胞/内皮细胞间通讯的效应,为AS治疗提供了潜在的治疗靶点。
首先,研究者在人冠状动脉AS样本中观察到p-RIPK3和PGAM5蛋白主要在巨噬细胞中表达,且其表达水平与AS病变的严重程度呈正相关性。在伴随纤维化或坏死核心增加的病变区域,PGAM5表达水平显著升高,表明其可能介导AS病变。进一步通过高脂饮食喂养雄性ApoE-/-小鼠构建AS模型和氧化型低密度脂蛋白(Oxidized low-density lipoprotein,ox-LDL)处理小鼠骨髓源巨噬细胞(Bone Marrow-Derived Macrophages, BMDMs)、人单核细胞THP-1构建AS细胞模型。在AS动物模型中,通过免疫组化和免疫荧光证实p-RIPK3和PGAM5蛋白主要在AS的巨噬细胞中表达,与人冠脉结果一致。此外,体外AS细胞模型中发现p-RIPK3和PGAM5蛋白水平升高。体内外模型均证实了AS中巨噬细胞磷酸化的RIPK3与PGAM5蛋白表达水平显著升高。通过RIPK3抑制剂GSK-872治疗小鼠和巨噬细胞,发现GSK-872降低p-RIPK3与PGAM5水平、减少脂质沉积及AS病变。这一结果表明,PGAM5作为RIPK3磷酸化后下游的信号分子,且抑制PGAM5表达可减轻AS。
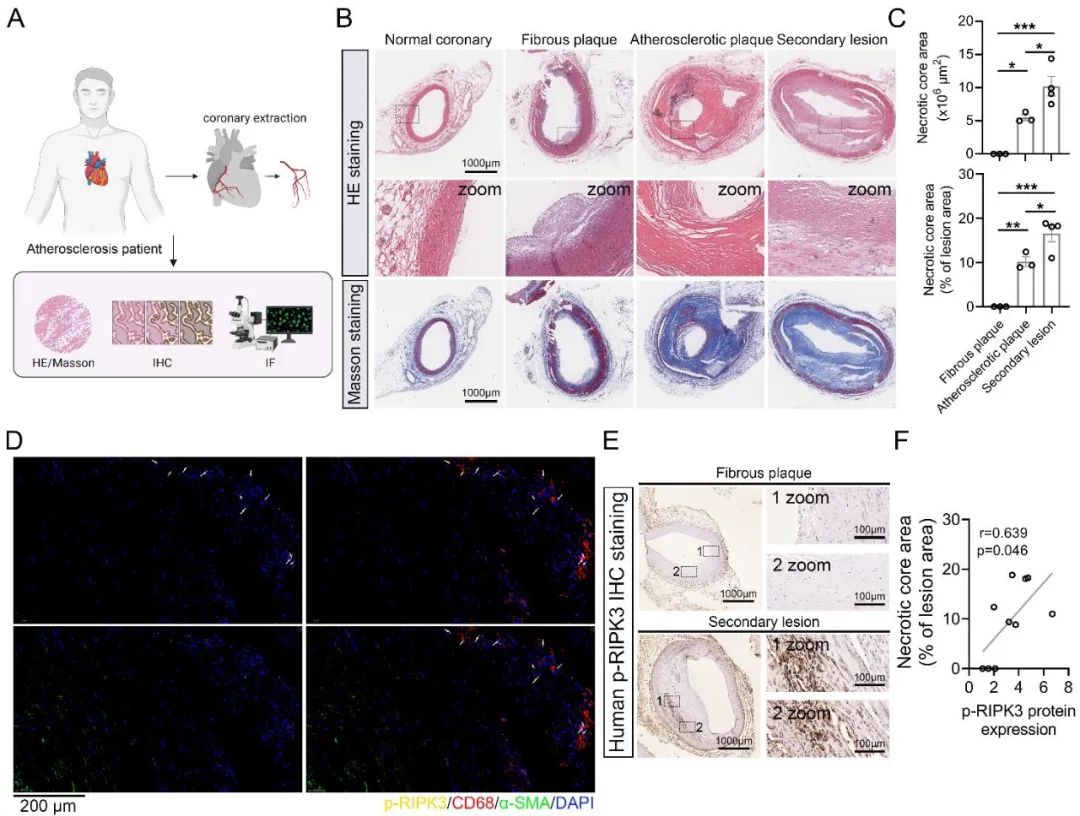
图1. 人冠状动脉标本的组织学染色和p-RIPK3蛋白表达
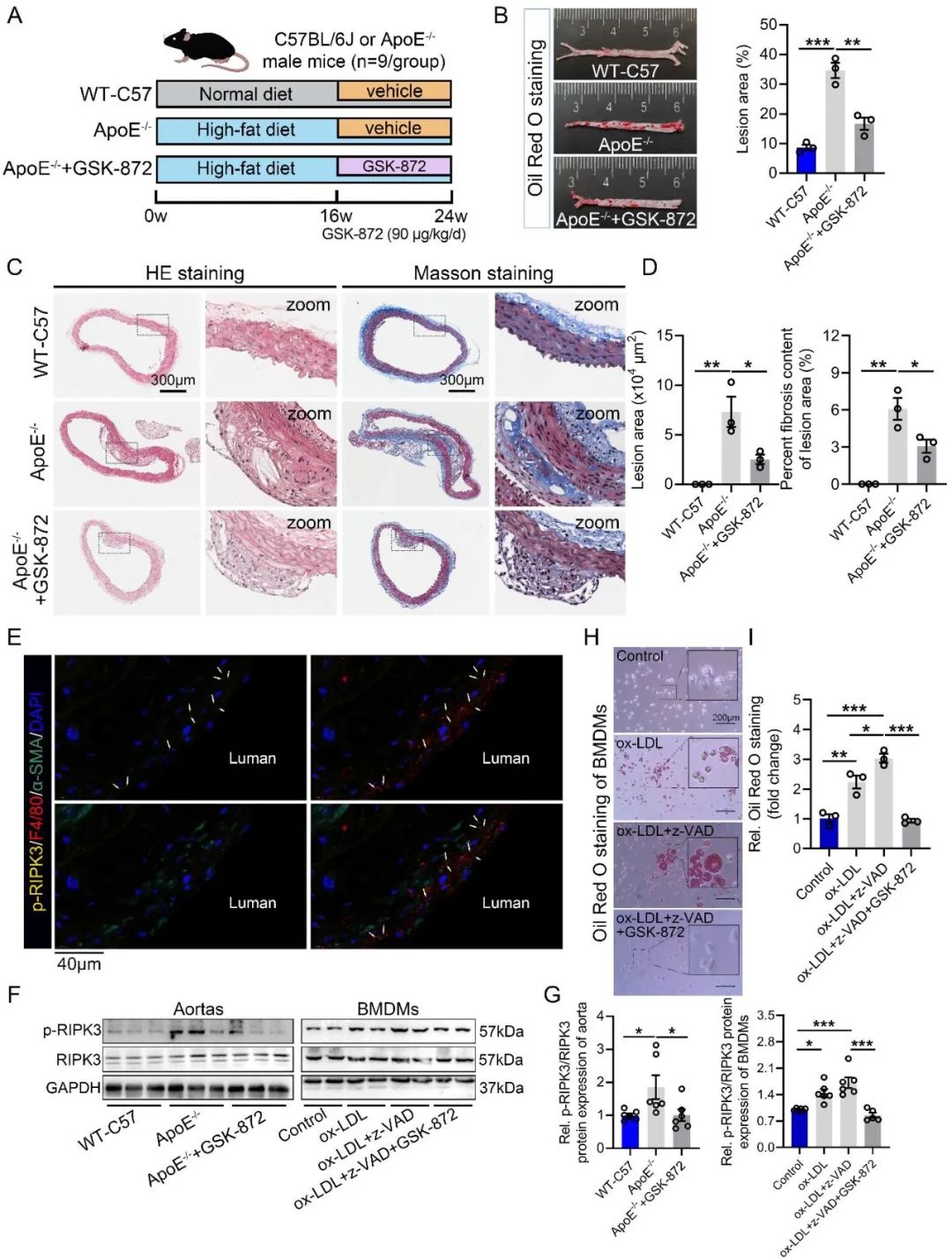
图2. 抑制RIPK3磷酸化可减轻ApoE-/-小鼠和ox-LDL暴露的巨噬细胞的AS病变
然后,研究者在GSK-872治疗ApoE-/-小鼠的基础上,通过慢病毒携带的PGAM5过表达质粒转染小鼠。发现PGAM5过表达可逆转或消除抑制p-RIPK3蛋白表达的效应,加重AS病变,包括脂质沉积增加、纤维化增强及巨噬细胞浸润加剧。在巨噬细胞PGAM5过表达的体外模型中也得到了相似的结果。而巨噬细胞PGAM5敲低可减轻细胞脂质沉积、减少炎症因子TNF-α和IL-1β释放。这些发现表明,PGAM5通过调控巨噬细胞脂质沉积和炎症因子分泌参与调控AS病变进展。

图3. PGAM5过表达加重ApoE-/-小鼠主动脉脂质蓄积和AS病变
接下来,研究者通过转录组学测序探索了PGAM5下游分子,发现PGAM5负调控巨噬细胞ANGPTL3基因与蛋白表达。随后,研究者使用ANGPTL3反义寡核苷酸ASO和单克隆抗体mAb分别抑制ANGPTL3蛋白表达和拮抗ANGPTL3蛋白功能。结果显示,ASO和mAb均不影响PGAM5蛋白表达水平,但减弱了PGAM5敲低对细胞的保护效应,这提示ANGPTL3作为PGAM5下游的重要靶点参与AS病变。另外,在人冠状动脉AS样本和小鼠AS模型中,发现ANGPTL3主要在巨噬细胞中表达,且其表达水平与AS病变程度呈负相关性。
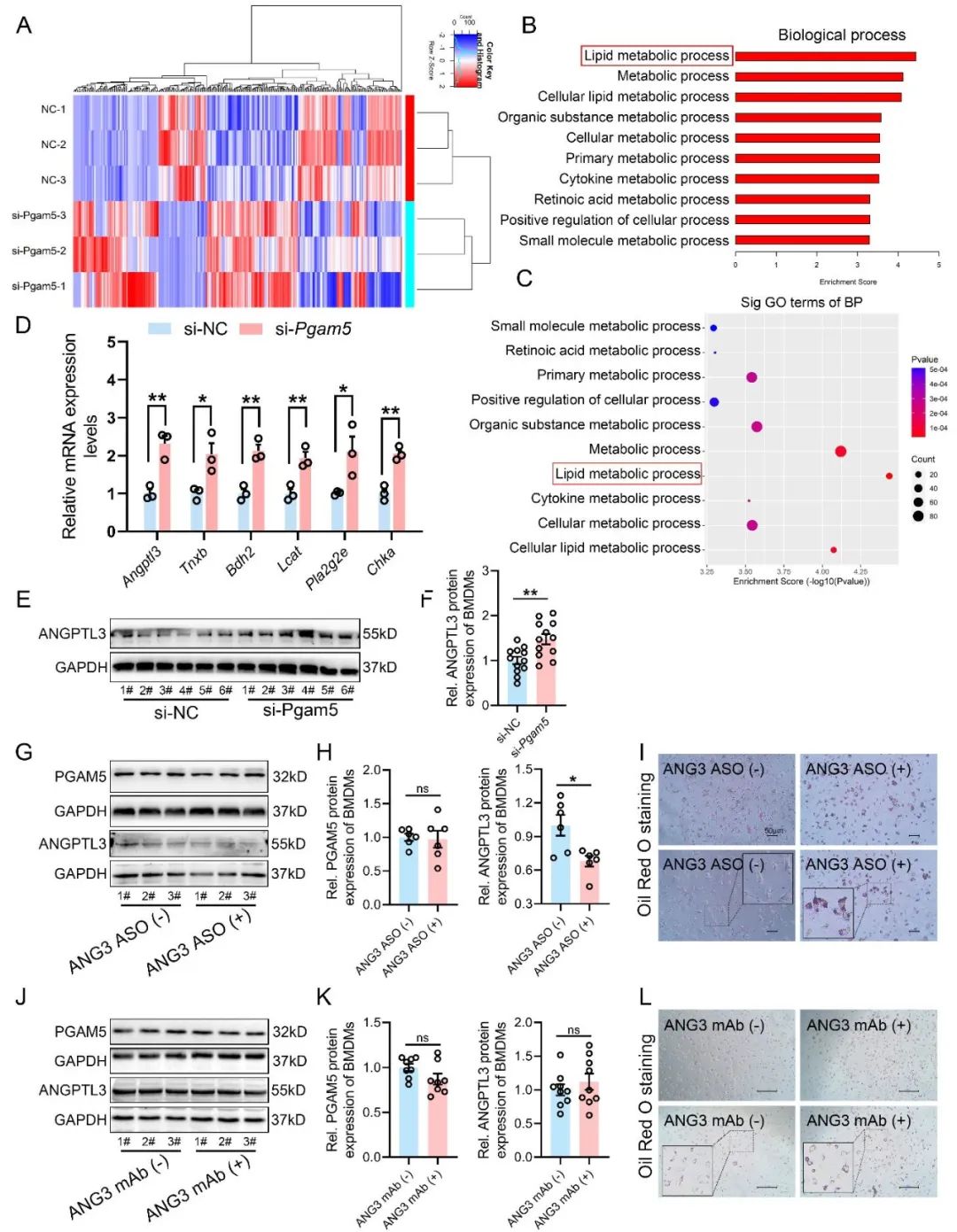
图4. PGAM5调控巨噬细胞ANGPTL3基因和蛋白的表达水平
最后,研究者通过共培养实验探索了PGAM5在介导巨噬细胞-冠脉平滑肌细胞/冠脉内皮细胞间细胞通讯的效应。结果发现,巨噬细胞PGAM5敲低可减少炎症因子(TNF-α和IL-1β)的释放,显著改善内皮细胞的活力,降低内皮细胞的炎症反应,抑制平滑肌细胞的炎症反应和迁移。通过使用ANGPTL3 ASO抑制ANGPTL3表达可促进巨噬细胞炎症因子(TNF-α和IL-1β)的分泌,破坏PGAM5敲低对细胞间通讯的保护效应。这进一步证明了ANGPTL3作为PGAM5下游分子参与调控细胞间通。相关性分析发现,在人冠脉和小鼠主动脉中,ANGPTL3表达水平与AS病变程度呈负相关,揭示了PGAM5-ANGPTL3信号在介导AS病变进展中的作用,也为理解AS细胞间通讯提供了新的视角。
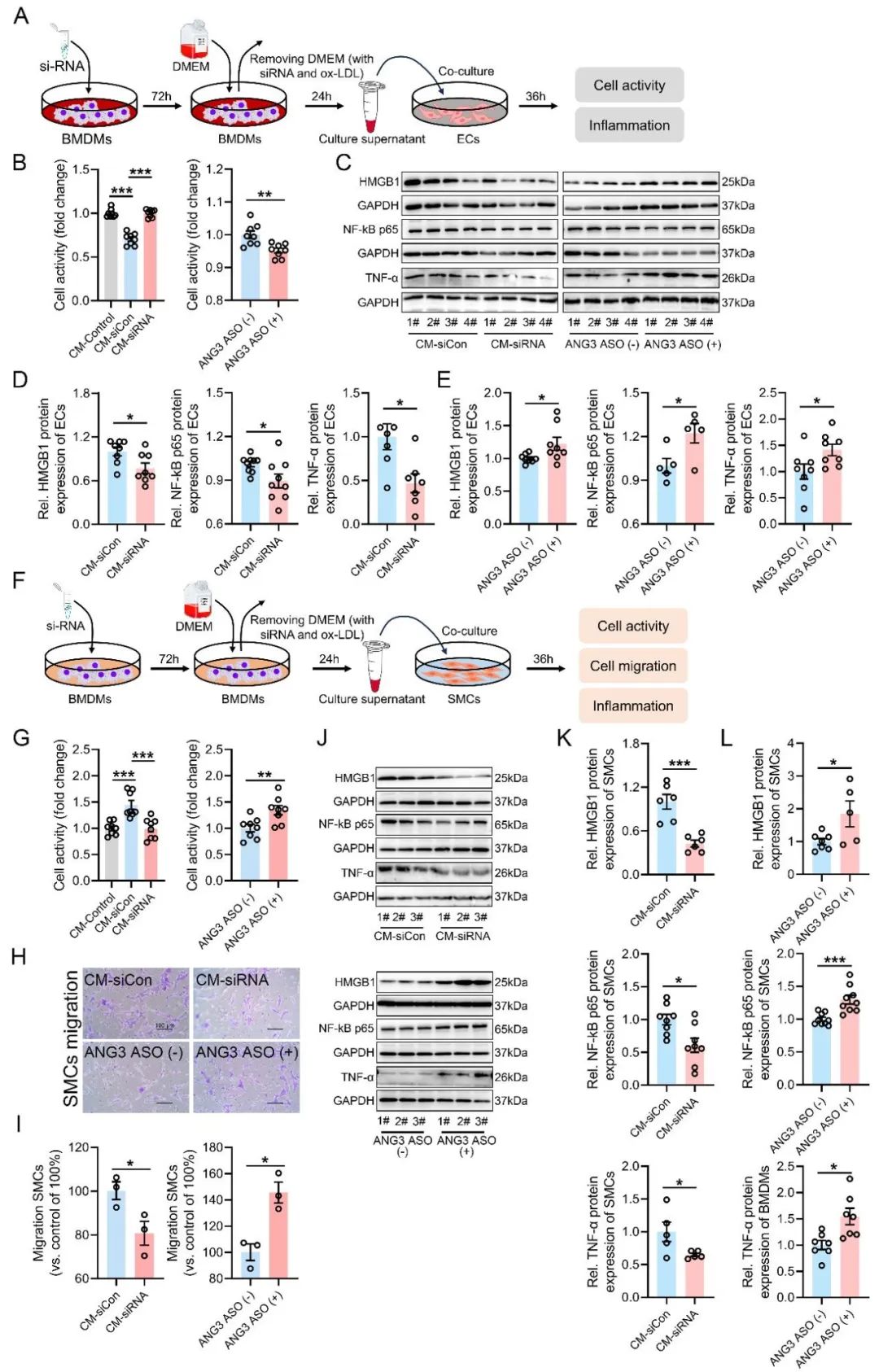
图5. PGAM5介导巨噬细胞与内皮细胞或平滑肌细胞之间的细胞通讯
综上所述,此研究揭示了PGAM5在AS病变中的重要作用,并探索了PGAM5-ANGPTL3信号通路在巨噬细胞脂质代谢、炎症反应及细胞间通讯中调控效应。研究结果表明,PGAM5的过表达加剧了AS脂质沉积、炎症反应和病变进展;而抑制PGAM5表达能显著减轻AS病变。ANGPTL3是PGAM5信号通路的关键下游分子,在介导巨噬细胞分泌功能及细胞间通讯中发挥重要作用。因此,靶向PGAM5-ANGPTL3可能成为未来治疗AS的新策略。
南京医科大学第一附属医院心血管内科博士后张倩和硕士生郑鹏(现东南大学医学院在读博士)是论文的第一作者。本研究获得了南京医科大学第一附属医院心血管内科卞智萍、陈相健、吴恒芳三位老师的支持与帮助,在此对她们表示衷心地感谢。本研究受江苏省卓越博士后计划、南京医科大学第一附属医院博士后科研启动项目(2021BSH10)和国家自然科学基金青年基金培育计划项目(PY2023048)资助。
论文链接:
https://www.jacc.org/doi/10.1016/j.jacbts.2024.12.007

本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言

















#动脉粥样硬化# #PGAM5#
7