Nat Commun 山东大学张澄/张猛教授团队揭示巨噬细胞E3泛素连接酶RNF128调控动脉粥样硬化斑块进展的作用机制
2025-03-18 论道心血管 论道心血管 发表于陕西省
该研究首次揭示了E3泛素连接酶RNF128通过调控SRB1泛素化修饰、促进泡沫细胞形成、加剧AS进展的新机制,为AS治疗提供了全新靶点。
动脉粥样硬化(Atherosclerosis, AS)是动脉血管壁慢性炎症及脂质沉积共同作用的结果,以管腔狭窄和血流障碍为主要特征。近年来,全球在动脉粥样硬化性心血管疾病(Atherosclerotic cardiovascular disease, ASCVD)的治疗和管理方面取得了很大进展,然而,ASCVD在世界范围内的疾病死亡率仍然很高。巨噬细胞来源的泡沫细胞在AS斑块初期形成和后期发展的整个过程中都发挥着重要作用。巨噬细胞清道夫受体主要包括清道夫受体A1 (Scavenger receptor A1, SRA1)、清道夫受体BI (SRB1)及CD36,负责识别、结合和摄取天然低密度脂蛋白或修饰型LDL,如氧化修饰型低密度脂蛋白(Oxidized LDL, oxLDL);三磷酸腺苷结合盒转运体A1 (ATP-binding cassette transporter A1, ABCA1)和ABCG1主要负责使胆固醇从巨噬细胞内流出。脂质的过多摄取和/或外排不足都会导致泡沫细胞的形成。
E3泛素连接酶RNF128是一种定位于内体循环系统的单次跨膜蛋白,含有发挥催化作用的RING结构域。既往研究显示,RNF128通过靶向结合多种膜蛋白以调控疾病的发展,尤其在诱导CD4+ T细胞无能、先天性抗病毒免疫及食管癌的发病中起着至关重要的作用。然而,RNF128是否参与了AS的调控和具体机制尚不清楚。
2025年3月4日,山东大学齐鲁医院张澄教授、张猛教授团队和高成江教授团队合作在Nature Communications上发表了题为“E3 ubiquitin ligase RNF128 promotes Lys63-linked polyubiquitination on SRB1 in macrophages and aggravates atherosclerosis”的研究论文,该研究首次揭示了E3泛素连接酶RNF128通过调控SRB1泛素化修饰、促进泡沫细胞形成、加剧AS进展的新机制,为AS治疗提供了全新靶点。

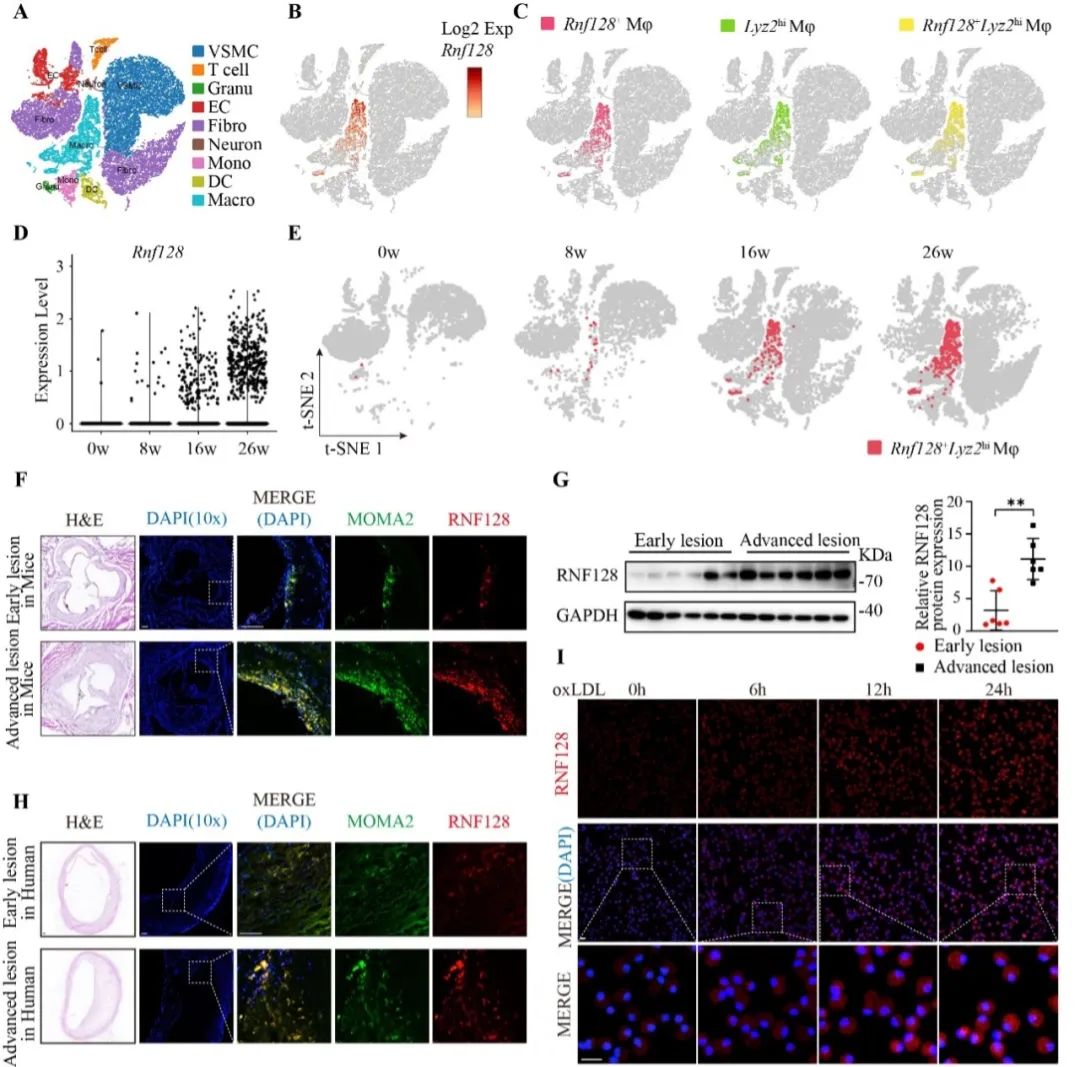
首先,该研究通过对GEO数据库AS斑块的10x Genomics scRNA-seq数据集进行分析,发现Rnf128特异性表达于巨噬细胞(Rnf128+Lyz2hi),且随着斑块的加重,Rnf128+Lyz2hi细胞的数量逐渐增加。验证发现,小鼠斑块和人类斑块进展过程中巨噬细胞RNF128表达逐渐上调。
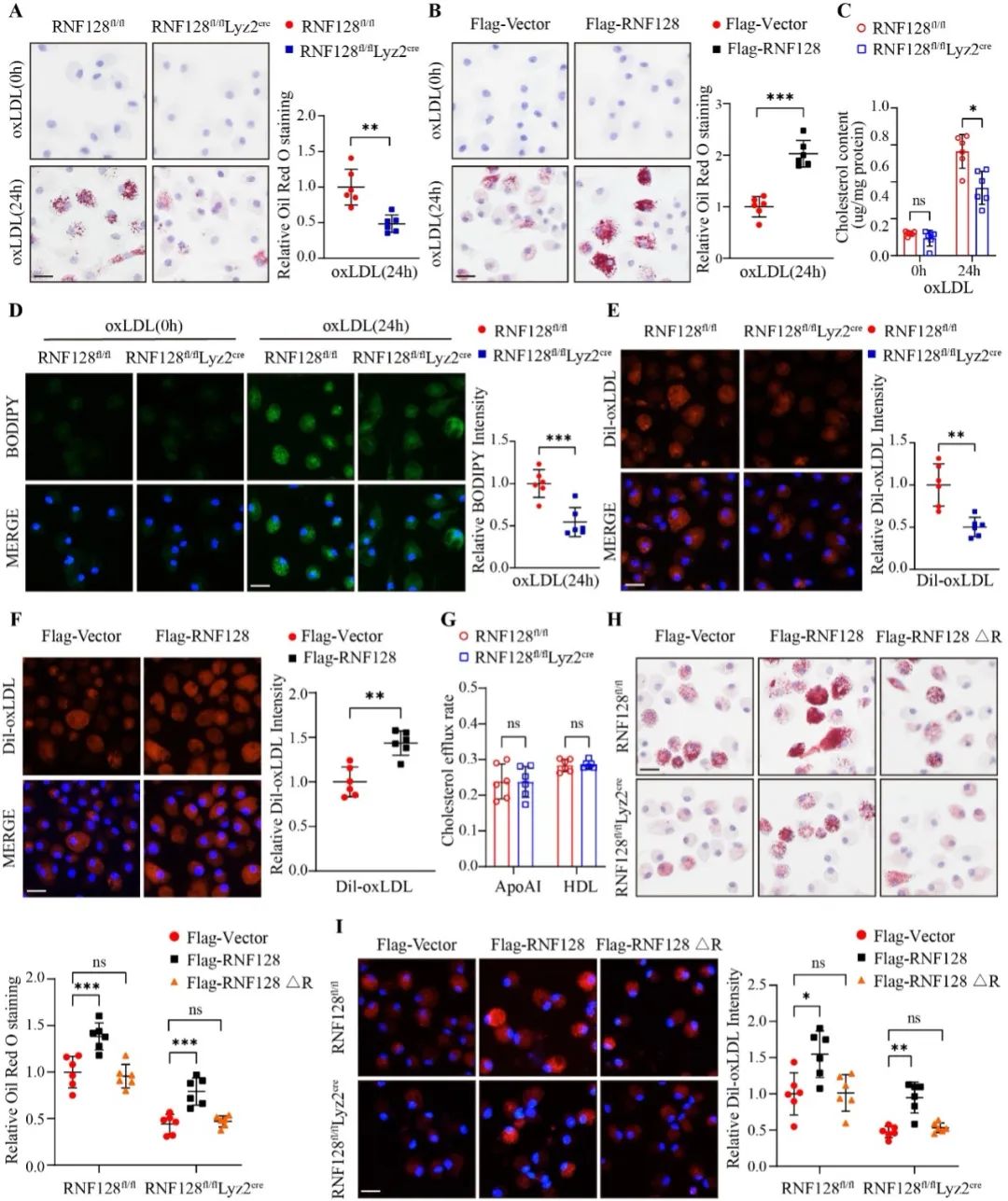
随后,研究者构建了巨噬细胞RNF128特异性敲除小鼠,分别提取其与同窝对照小鼠腹腔原代巨噬细胞,给予oxLDL刺激以诱导泡沫细胞形成,油红O及BODIPY染色均显示,RNF128敲除后巨噬细胞中脂质沉积量明显减少。脂质内吞和外排实验结果表明,RNF128敲除组的Dil-oxLDL内吞能力明显降低,而对胆固醇流出无明显影响,说明巨噬细胞RNF128的敲除通过减少oxLDL的内吞而抑制泡沫细胞的形成。此外,研究者用腺病毒包装系统构建了RNF128的过表达腺病毒,利用腺病毒将RNF128基因转入腹腔原代巨噬细胞,发现巨噬细胞中过表达RNF128促进了oxLDL的内吞,从而加重脂质沉积。进一步构建RING结构域缺失的RNF128截断体,结果显示巨噬细胞RNF128对脂质内吞的调节依赖于RING结构域的酶活性。
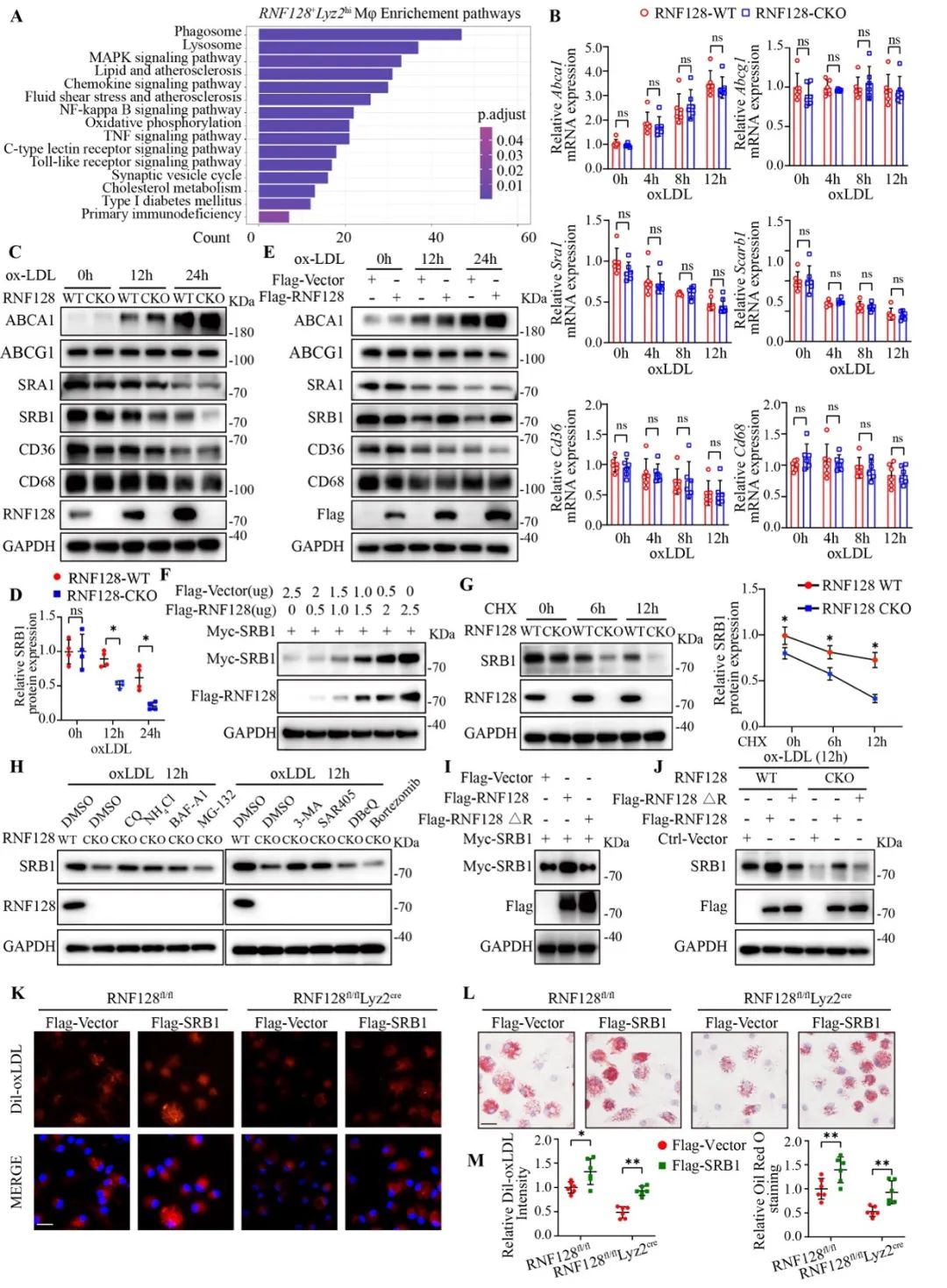
为了探究巨噬细胞RNF128调节脂质稳态的具体靶点,研究者检测了细胞中清道夫受体及外排转运蛋白的表达,发现RNF128敲除能够在蛋白水平上促进SRB1的降解,过表达RNF128则会在蛋白水平上更加稳定SRB1的表达,对其他受体则无明显影响。接下来使用放线菌酮诱导蛋白降解,以探究RNF128是否参与调节SRB1蛋白的稳定性,结果显示RNF128敲除加速了SRB1的蛋白降解。进一步使用蛋白溶酶体途径降解抑制剂和蛋白酶体途径降解抑制剂,显示RNF128的敲除促进了SRB1蛋白酶体途径的降解。
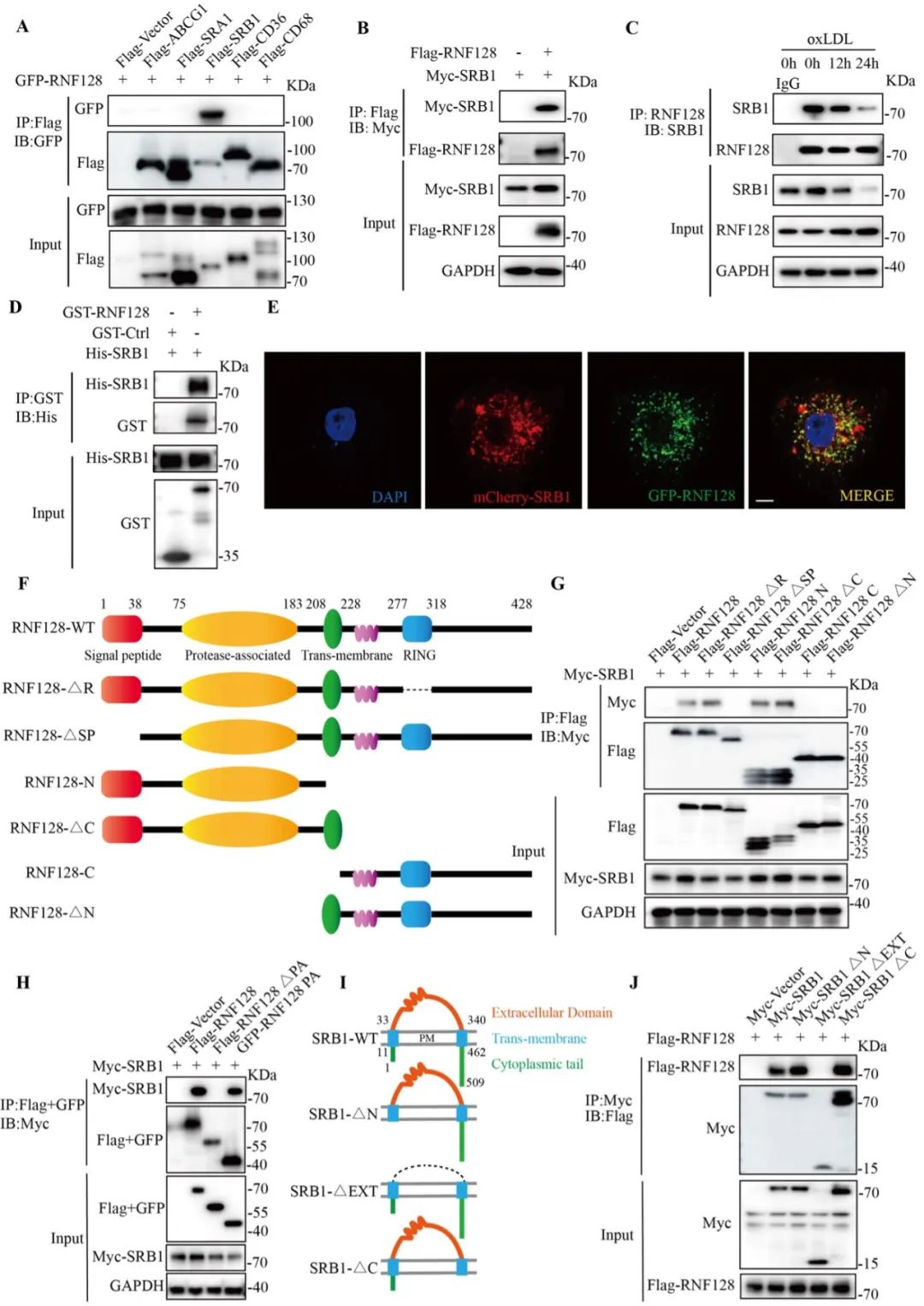
为了阐明RNF128是否直接作用于SRB1蛋白,研究者利用HEK293T和腹腔原代巨噬细胞分别进行外源性CO-IP和内源性CO-IP实验,显示RNF128与SRB1发生特异性结合。激光共聚焦显微镜拍照显示,RNF128与SRB1在细胞内存在明显的共定位。因此认为SRB1蛋白是RNF128直接作用的靶点。为了更深入探索RNF128与SRB1的结合区域,分别构建了一系列RNF128与SRB1的截断突变体,CO-IP实验显示RNF128的PA结构域靶向结合SRB1的胞外结构域。
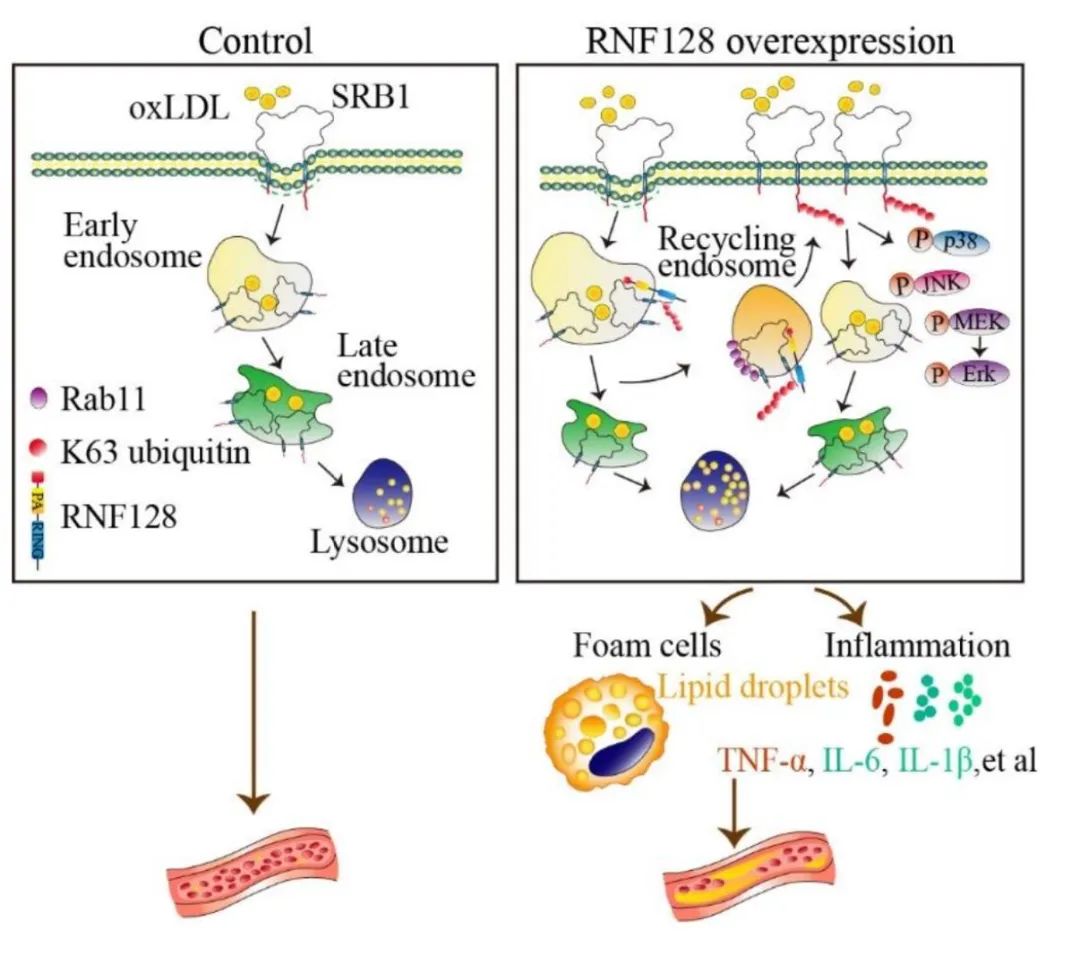
进一步探究显示,RNF128对SRB1的第478位赖氨酸发生K63位泛素化修饰,进而促进SRB1通过Rab11循环至细胞膜。
最后,研究者利用巨噬细胞RNF128特异性敲除小鼠,高脂喂养20w构建小鼠动脉粥样硬化模型,主动脉弓及分叉处原位影像、主动脉油红O染色、主动脉根部切片HE染色与油红O染色均显示巨噬细胞RNF128特异性敲除明显缓解ApoE-/-小鼠斑块的进展。而巨噬细胞SRB1过表达则会加重ApoE-/-RNF128fl/flLyz2cre小鼠斑块的进展,即SRB1参与介导了巨噬细胞RNF128对小鼠动脉粥样硬化进展的调控。
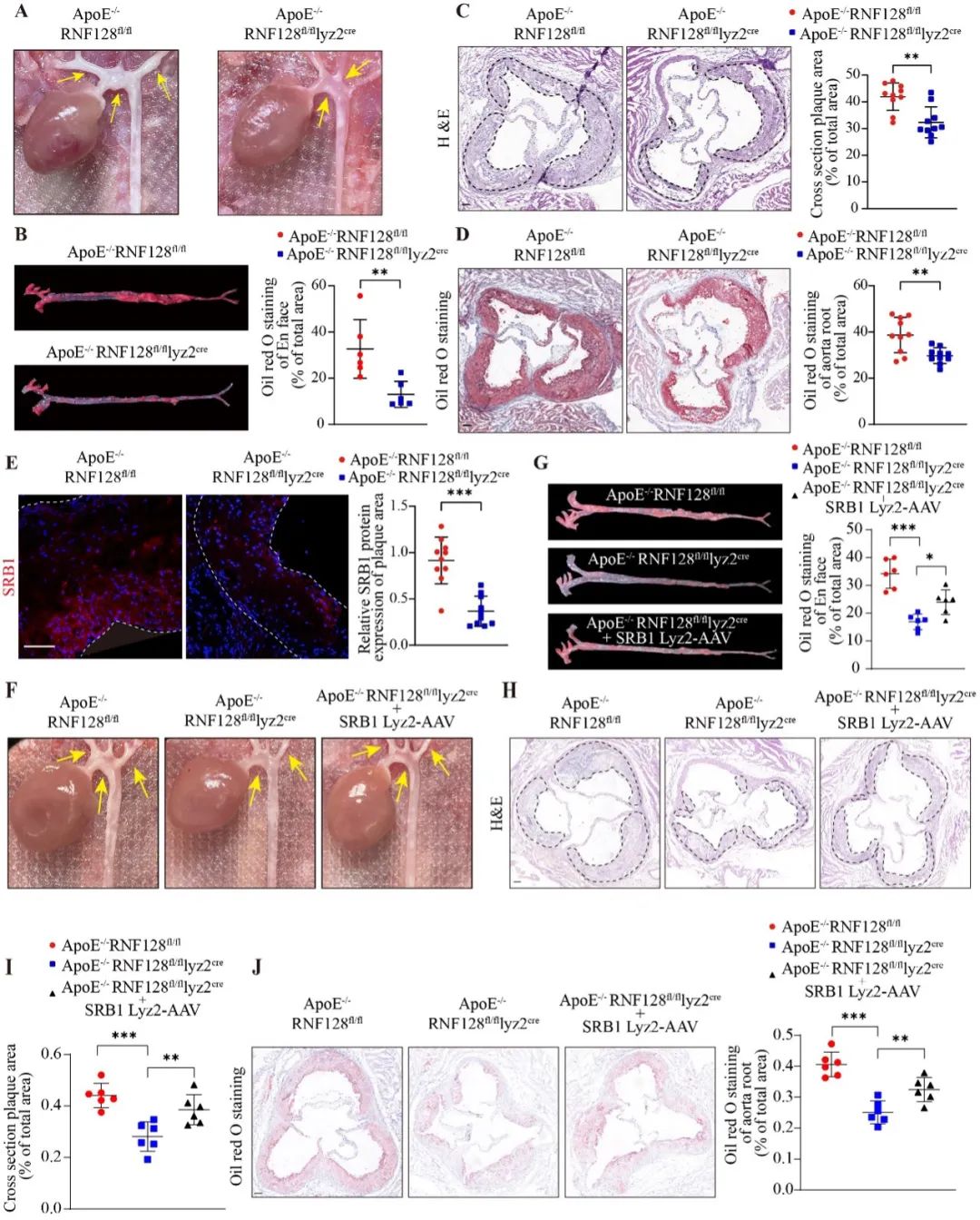
综上所述,该研究揭示了巨噬细胞E3泛素连接酶RNF128在AS进展中的重要作用。RNF128催化清道夫受体SRB1第478位赖氨酸处的K63泛素化修饰,促进SRB1在Rab11的介导下循环至细胞膜,导致SRB1对oxLDL的摄取增加,加剧了泡沫细胞的形成。因此,靶向抑制巨噬细胞RNF128对AS患者的病情控制具有潜在的临床治疗潜力。
山东大学齐鲁医院张澄教授、张猛教授和山东大学高成江教授为该论文共同通讯作者。山东大学齐鲁医院刘亚鹏博士为本文第一作者。该工作得到国家自然科学基金(No. 82270487, 82241203, 82200502)、山东省自然科学基金(ZR2023JQ030, 2021ZDSYS05, ZR2022QH089)等多项经费支持。
原文链接:
https://www.nature.com/articles/s44161-025-00622-4

本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言

















#动脉粥样硬化# #E3泛素连接酶#
8