Curr Bio:疼痛慢性化的神经调节机制
2025-03-20 MedSci原创 MedSci原创 发表于陕西省
伏隔核(NAc)是中脑边缘奖励系统的重要组成部分,其在急性痛向慢性痛转归中的具体神经机制尚不明确。该研究揭示了伏隔核微环路在急性痛向慢性痛转归中的神经机制,为慢性疼痛的预防和治疗提供了新的靶点和策略。
慢性疼痛是一种复杂的病理状态,其发生发展涉及中枢神经系统的重塑和神经元活动的异常改变。传统观念认为,慢性疼痛是急性疼痛的延续,但近年来的研究表明,急性痛向慢性痛的转归是一个动态的、渐进的过程,涉及大脑神经网络的功能重塑和神经元活动的动态变化。
伏隔核(NAc)是中脑边缘奖励系统的重要组成部分,参与调节多种生理行为,如奖励动机、进食、学习和觉醒等。近年来的研究发现,NAc在慢性疼痛的形成和发展中也起着关键作用。然而,NAc在急性痛向慢性痛转归中的具体神经机制尚不明确。
近日,国际权威期刊Current Biology上在线发表了题为“An accumbal microcircuit for the transition from acute to chronic pain”的最新研究成果。该研究通过慢性压迫性损伤(CCI)模型研究了伏隔核(NAc)在急性痛向慢性痛转归中的神经机制。研究发现,NAc壳层(NAcS)和核心(NAcC)神经元的活动在慢性神经性疼痛的不同阶段呈现动态变化:NAcS神经元在急性期活动增加,而NAcC神经元在慢性期活动增强。通过化学遗传学和光遗传学技术调控NAcS和NAcC神经元活动,发现NAcS神经元在疼痛慢性化中起关键作用,其活动在急性期的增加是慢性痛发生的必要条件。进一步研究表明,NAcS与NAcC之间存在直接的微环路,且该环路中表达多巴胺D2受体的神经元在疼痛慢性化中发挥核心作用。研究结论指出,NAcS-NAcC微环路是慢性疼痛发生的关键神经机制,为预防和治疗慢性疼痛提供了新的靶点。

研究发现,在CCI诱导的慢性神经性疼痛模型中,NAcS神经元的活动在急性期(术后1-7天)显著增加,而在慢性期(术后14-21天)恢复到基线水平。相反,NAcC神经元的活动在急性期无明显变化,但在慢性期显著增加。这种动态变化模式表明,NAcS和NAcC在慢性疼痛的不同阶段发挥着不同的作用。
通过化学遗传学抑制NAcS神经元活动,研究者发现,在CCI急性期抑制NAcS神经元可以显著逆转已建立的热痛觉过敏和机械痛觉过敏,而在慢性期则无此效果。进一步地,持续抑制NAcS神经元活动(连续7天抑制)不仅在急性期,还在慢性期显著提高了小鼠的疼痛阈值,表明NAcS神经元活动在疼痛慢性化过程中的必要性和充分性。
研究证实了NAcS和NAcC之间存在直接的神经投射,形成了一个功能性的微环路。通过化学遗传学和光遗传学调控NAcS-NAcC微环路的活动,发现其在疼痛慢性化中起着关键作用。例如,持续抑制NAcS-NAcC微环路的活动可以完全阻止慢性神经性疼痛的发生,而激活该微环路则可以在正常小鼠中诱导出类似慢性疼痛的行为。
进一步研究表明,NAcS-NAcC微环路中表达多巴胺D2受体的神经元在疼痛慢性化中起着核心作用。特异性抑制这些D2受体表达的神经元可以有效预防疼痛慢性化,而激活它们则会诱导慢性疼痛样行为。这表明多巴胺D2受体在NAcS-NAcC微环路中对疼痛转归具有重要的调控作用。
综上所述,本研究深入揭示了伏隔核微环路在急性痛向慢性痛转归中的神经机制,为慢性疼痛的预防和治疗提供了新的靶点和策略。特别是针对NAcS-NAcC微环路中多巴胺D2受体表达的神经元进行早期干预,可能成为阻止疼痛慢性化的有效途径。未来的研究可以进一步探索该微环路在不同类型的慢性疼痛中的作用,以及开发针对该微环路的新型治疗方法和药物,为慢性疼痛患者带来新的希望。
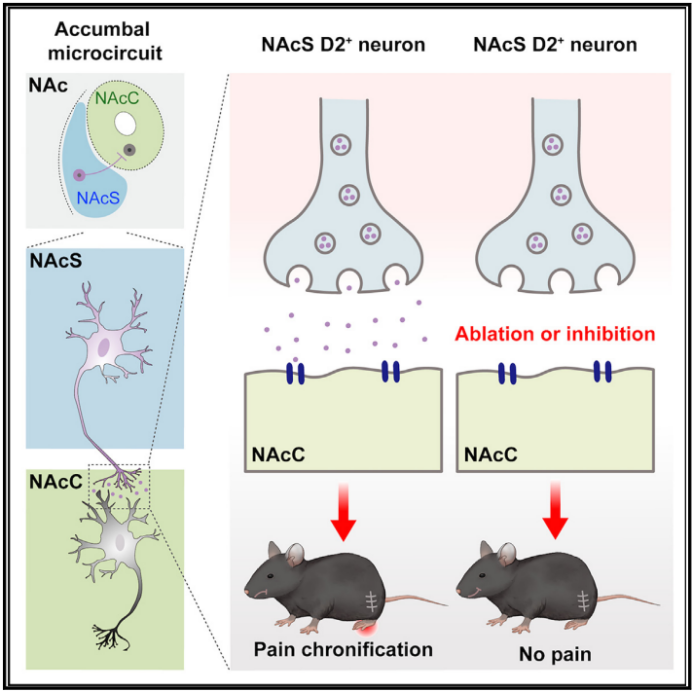
图 研究模式图
原始出处:
Yu-Mei Yu. et al. 2025.An accumbal microcircuit for the transition from acute to chronic pain.Current Biology.

本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言
















#慢性疼痛# #伏隔核#
8