CAR-T之父Carl June教授:从概念到治愈,CAR-T的过去、现在和未来
2025-03-21 聊聊血液 聊聊血液 发表于陕西省
CAR-T 细胞疗法革新癌症免疫疗法,源于免疫疗法发展,经多阶段演进。其历经多代创新,在血液瘤和实体瘤等治疗中取得进展,也用于非肿瘤疾病。现面临生产和安全等挑战,下一代技术有望解决,前景可期。
CAR-T
嵌合抗原受体(CAR)-T细胞疗法在21世纪彻底革新了癌症免疫疗法,这种方法源于细胞治疗领域几十年的迭代发展,并且一直在不断进化以克服重大挑战,使得血液肿瘤(如淋巴瘤、多发性骨髓瘤、急性淋巴细胞白血病)、实体瘤症(如前列腺癌和胶质母细胞瘤)以及非肿瘤性疾病的治愈成为可能。
CAR-T细胞疗法包括收集患者的T细胞,使用病毒载体对其进行基因工程改造,使其表达针对特定抗原的CAR,然后将这些改造后的细胞重新输注到患者体内。这些CAR-T细胞独立于主要组织相容性复合体(MHC)抗原呈递机制发挥作用,能够选择性地识别和消除靶细胞。第一代CAR-T细胞将单克隆抗体的单链可变片段(scFv)与CD3ζ细胞内信号传导结构域(ICD)结合,能够在不依赖MHC的情况下溶解靶细胞。随着共刺激分子的发现,后续几代CAR-T细胞被开发出来,使得CAR产品的增殖、激活和存活能力得到增强。
《Molecular Therapy》近日发表Pre-proof版本综述,CAR-T之父Carl June 教授等重点介绍了CAR-T细胞演变过程中的关键里程碑,概述了导致CAR-T细胞发明的历史时间线,讨论了将其转变为突破性疗法的主要成就,并解决了剩余的挑战,包括制造成本高、可及性有限以及细胞因子释放综合征(CRS)和免疫效应细胞相关神经毒性综合征(ICANS)等毒性问题,还探讨了该领域的未来方向和进展,例如开发下一代CAR-T细胞,旨在最大化疗效、最小化毒性和拓宽治疗应用范围。

CAR-T细胞发展史
免疫疗法导致 CAR-T 细胞疗法的不断发展,主要里程碑见图1,从18世纪的疫苗接种开始,到2024年治疗实体瘤和非肿瘤疾病的临床试验获得成功。
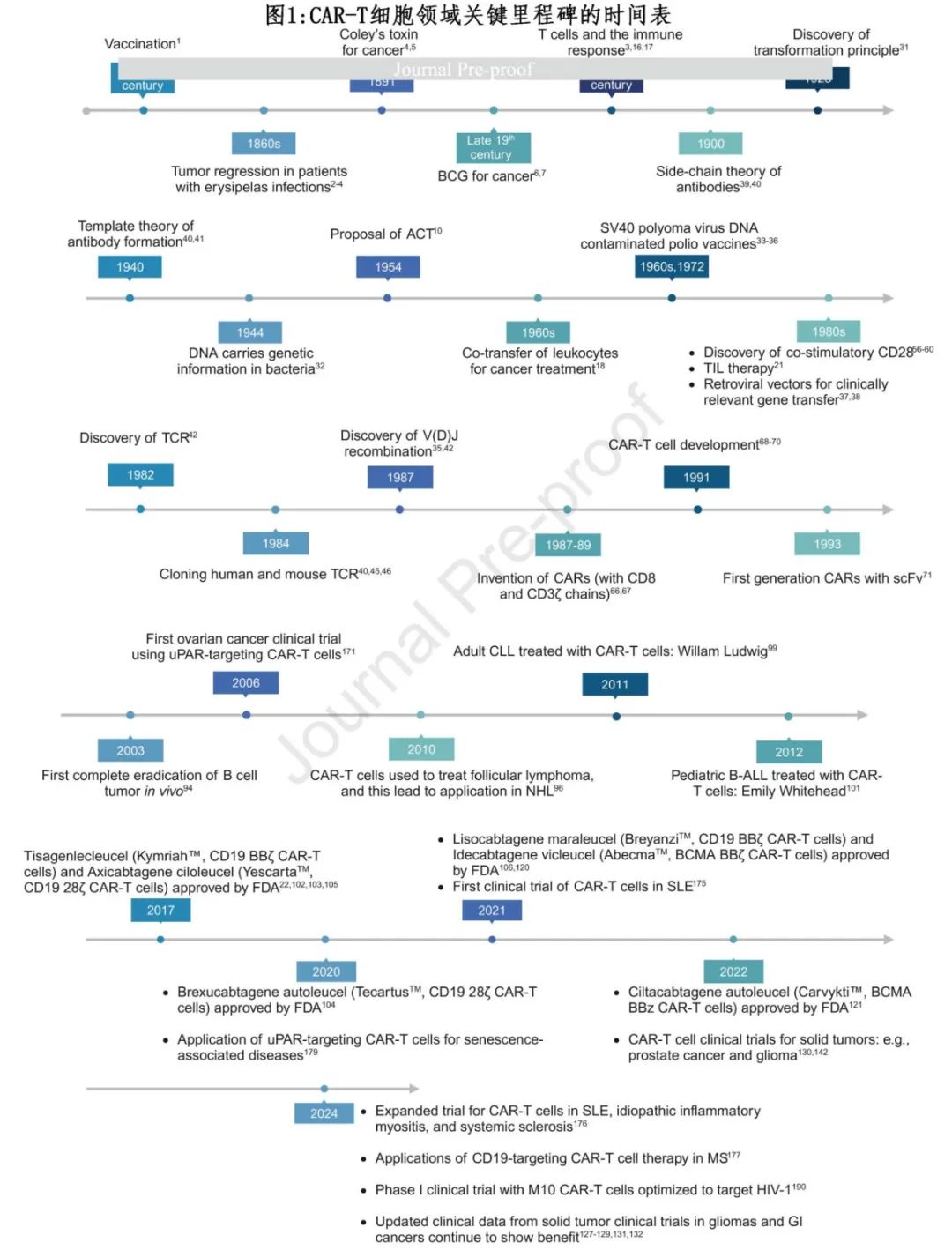
免疫疗法的出现
免疫疗法是一种治疗多种疑难疾病很有前景的策略,它通过调节患者的免疫系统,可增强其对抗癌症和感染,或诱导免疫耐受以预防自身免疫性疾病。对于那些对传统治疗无效的难治性、转移性或晚期疾病患者,免疫疗法为他们带来了新的希望。
免疫疗法最早的有效形式始于18世纪,当时用与天花病毒相关的牛痘病毒进行疫苗接种,以抵御天花感染。该方法基于这样的观察:经常感染牛痘病毒的农民由于交叉免疫对天花具有抵抗力。19世纪60年代,两位德国医生布什和费莱森独立地观察到,在患有丹毒(erysipelas)感染的患者中,肿瘤有显著的消退。1891年,“免疫疗法之父”的威廉·科利,成为第一个尝试利用免疫系统治疗骨癌的人。他的治疗方法称为“Coley’s Toxins”,在接受治疗的一千多名患者中,导致了显著的癌症消退。这些早期的科学努力为免疫系统与癌症之间的相关性提供了初步的见解。然而由于缺乏明确的机制理解,随着化疗和放疗后来逐渐占据主导地位,这些方法的热情也随之减退。
细菌感染对癌症的预防作用重新唤起了人们对免疫疗法的兴趣,特别是使用减毒活细菌疫苗卡介苗作为癌症治疗方法。卡介苗首次使用于19世纪晚期,至今仍是高危非肌层浸润性膀胱癌的标准治疗方法,该进一步凸显了免疫疗法的变革潜力。卡介苗能诱导“训练免疫”,即对先天免疫细胞进行表观遗传重编程,使其在后续接触各种病原体时产生增强的反应。
过继细胞疗法(ACT)
免疫疗法可以通过药物管理或治疗性疫苗接种来诱导全身免疫改变,或者通过一种被称为被动免疫的既定方法,即输注预先形成的细胞或抗体,也就是所谓的过继细胞疗法(ACT)。这种方法能诱导“细胞介导的免疫”,这是一种独立于抗体或全身药物管理的适应性免疫反应,涉及免疫细胞(例如,成熟的T淋巴细胞亚群),它们能特异性识别、靶向并摧毁感染宿主细胞或肿瘤细胞。1954年,鲁珀特·比林汉姆、莱斯利·布伦特和彼得·梅达瓦首次提出了“过继细胞转移(adoptive cell transfer)”的术语,证明了从供体向受体转移免疫细胞可以产生免疫力。如今ACT是一种个性化医疗方法,在诱导靶向抗肿瘤免疫、增强疫苗效力和克服移植物抗宿主病(GvHD)方面具有巨大潜力。
在各种类型的免疫细胞中,由于具有以下优势,T细胞在ACT中获得重点使用:1)它们能够通过识别细胞表面差异表达的抗原来特异性靶向并消除肿瘤细胞,2)它们的寿命长且具有免疫记忆能力,3)它们在放大更广泛的免疫反应中的作用,4)它们适合进行基因工程改造。
1957年,托马斯和伯内特提出了癌症免疫监视的开创性理论,这一概念意味着免疫系统能够识别并摧毁大多数肿瘤细胞的前体。在20世纪,施莱伯、邓恩、奥尔德及其团队证明了T细胞在抗肿瘤监视和启动抗肿瘤免疫反应中起着关键作用。在20世纪60年代,切斯特·萨瑟兰等证明,在大约一半的患者中,通过转移自体白细胞可以抑制晚期癌症患者中人类肿瘤自体移植的皮下生长。尽管这些研究缺乏足够的样本量以达到统计学意义,但它们表明,来自肿瘤患者的白细胞(或淋巴细胞)对同一个人起源的癌细胞生长具有特定的抑制作用。这些实验是在未获得知情同意的情况下进行的,从而引发重大的伦理问题。虽然萨瑟兰的实验为免疫细胞在消除癌症中的作用提供了早期见解,但它们也代表了不道德的人体实验及其潜在的负面后果,提高了人们对患者对治疗的理解和接受的重要性认识,并导致《贝尔蒙特报告》和患者知情同意等政策的发布。
自体(自身)或异体(供体)T细胞的来源可以是“多克隆”,即指从多个免疫细胞克隆中获得的、能识别肿瘤或感染细胞上各种表位(抗原的特定部分)的T细胞群体,也可以是“单克隆”,即指从单一细胞克隆中获得的、能特异性靶向抗原上单一表位的T细胞群体。多克隆T细胞可提供广泛的抗原识别,可能增强治疗的整体效果,并降低免疫逃逸的风险,而单克隆T细胞则能提供高度针对性的免疫反应,具有非凡的特异性和精确性,可能减少脱靶效应。
肿瘤浸润淋巴细胞(TIL)疗法
过继细胞疗法(ACT)的一种特定形式利用肿瘤浸润淋巴细胞(TILs),它们是自然存在于患者肿瘤中的T细胞。ACT是一个广义的细胞治疗术语,使用患者自身的免疫细胞来对抗癌症和其他疾病,而TIL疗法则使用已经迁移到肿瘤本身的T细胞。TIL疗法的过程包括从肿瘤中收集TILs,在体外激活和扩增它们,然后将这些激活的T细胞重新输注回患者体内。这些T细胞没有经过基因改造,该过程假设它们是富含针对肿瘤抗原的特异性群体,从而能够特异性地靶向并消灭肿瘤细胞。
TIL疗法最早于20世纪80年代末由美国国家癌症研究所(NCI)的史蒂文·罗森伯格博士等作为癌症治疗方法进行临床研究和开发,特别是用于治疗黑色素瘤。TIL疗法主要用于黑色素瘤,它是“免疫源性热”肿瘤,主要是因为获取黑色素瘤活检样本相对容易。它在治疗晚期转移性黑色素瘤方面已显示出成功。2024年2月16日,美国食品药品监督管理局(FDA)加速批准了Lifileucel——第一种被批准用于不可切除或转移性黑色素瘤的TIL疗法,标志着实体瘤TIL疗法的首个商业化里程碑。
影响ACT或TIL疗法效果的因素包括体外培养条件、使用化疗和放疗等清淋疗法对宿主进行预处理,以及对于TIL疗法而言,还取决于手术中肿瘤样本的质量和体外生长及扩增的效率。尽管前景广阔,TIL疗法仍面临一些重大障碍:(1)获取肿瘤活检样本的难度,限制了患者资格,特别是对于某些实体瘤类型;(2)部分肿瘤中TIL群体不足,使这种方法不太可行;(3)复杂且昂贵的生产过程,带来了超出生物限制的物流和财务障碍;(4)TIL输注后使用白细胞介素-2(IL-2)相关的毒性,导致全身性和脱靶副作用;(5)T细胞耗竭和功能障碍,可能进一步削弱TIL疗法的整体治疗效果。
T细胞中的DNA整合
在探索T细胞在免疫系统中的作用以及测试利用T细胞治疗疾病的想法时,该领域面临的一个巨大挑战在于提高抗原特异性。TILs的发现有望克服这一挑战,但发现T细胞如何实现特异性仍然是免疫学领域的圣杯之一。幸运的是,其他领域的数十年研究已经开始理解遗传信息是如何传递的,以及如何利用这种技术。这始于格里菲斯的肺炎球菌实验,引入了细菌转化现象,揭示了遗传性状可以在菌株之间转移。该发现暗示了一种可转移的“转化因子”的存在。在此基础上,艾弗里等通过实验表明,DNA是负责遗传的分子,推翻了之前认为蛋白质是遗传物质的信念。20世纪60年代,对哺乳动物细胞的实验表明,外源DNA可以被整合并表达在细胞中。开创性的研究集中在如SV40的多瘤病毒,将遗传物质整合到宿主基因组中。这些病毒显示了稳定和可遗传的遗传修饰的潜力。1972年,西奥多·弗里德曼和理查德·罗布林正式提出使用改造后的病毒进行治疗性基因转移,下面详细说明为什么基因治疗的概念进入医学实践用了将近50年。到了20世纪80年代,已经具备了产生具有高效细胞系的逆转录病毒的能力,这些细胞系可以产生高滴度的载体,能够引入具有治疗意义的基因,从而为将合成开发的受体基因引入T细胞以提高抗原特异性奠定了基础。
T细胞受体(TCR)疗法
1900年,德国医学科学家、诺贝尔奖得主保罗·埃尔利希提出了侧链(side-chain)理论,认为细胞会产生抗体来对抗疾病,他将这些抗体称为“魔法子弹”,因为它们能够特异性地靶向病原体而不对身体造成意外伤害。1940年,林纳斯·鲍林提出了抗体形成模板理论(antibody formation),认为抗原作为模板塑造抗体的形成,抗体随后获得与抗原互补的结构,从而实现精确的抗体-抗原结合。这些发现为后续实验和T细胞受体(TCR)的发现铺平了道路。
1982年,詹姆斯·艾莉森等利用单克隆抗体和近交系小鼠,确定了小鼠T淋巴瘤细胞上克隆表达的T细胞表面表位,就是现在所知的T细胞受体。在此基础上,埃利斯·莱因赫兹在1983年通过针对特定T细胞克隆的单克隆抗体,定义了人类T细胞受体的结构。与此同时,菲利帕·马拉克和约翰·卡普勒在小鼠身上进行了互补研究,为TCR的功能提供了重要见解。1984年,塔克·马克和马克·戴维斯确定了编码人类和小鼠T细胞受体的互补DNA(cDNA)克隆。1987年,苏苏穆·托内加瓦因其发现V(D)J重组而获得诺贝尔生理学或医学奖,这一遗传机制解释了抗体的巨大多样性。这些里程碑式的发现使科学家能够研究T细胞受体,通常被称为免疫学的“圣杯”。此外,这些研究强调了T细胞受体与抗原之间的关键相互作用,极大地推动了对免疫反应的理解。
然而,并非所有患者都拥有能够识别其肿瘤抗原的T细胞。在某些情况下,患者可能有肿瘤特异性T细胞,但这些细胞可能激活不足或扩增不良,无法达到有效排斥肿瘤的数量。对于这些患者,可以采用一种称为TCR疗法的治疗策略。该方法从患者体内分离T细胞,并为它们配备合成或改良的T细胞受体,从而实现对肿瘤抗原的精确识别和消除。与专注于激活和扩增自然存在的抗肿瘤T细胞的TIL疗法不同,TCR疗法允许选择最佳的肿瘤特异性靶点和工程改造特定的T细胞亚群。
为了有效识别抗原,T细胞需要有合适的MHC分子,也称为人类白细胞抗原(HLA)。肿瘤免疫逃逸的一个重要机制为TCR对自身抗原的亲和力低于对外来抗原的亲和力,该挑战可通过TCR疗法来解决。通过根据患者肿瘤的独特特征(例如,靶向已知的肿瘤相关抗原)量身定制治疗,TCR疗法可以提供更个性化和有效的策略,为改善预后带来希望。例如,用TCR靶向纽约食管鳞状细胞癌1(NY-ESO-1)抗原的T细胞在治疗多发性骨髓瘤和滑膜肉瘤患者方面显示出良好的效果。此外,FDA最近批准了第一种用于实体瘤的工程化T细胞疗法,该疗法使用表达靶向人类黑色素瘤抗原A4(MAGE-A4)的HLA-A2限制性肽的、经过TCR修饰的T细胞,用于治疗不可切除或转移性滑膜肉瘤,这是基于临床试验取得令人鼓舞的结果。尽管TCR疗法前景广阔,但其主要局限性在于难以确定同时表达靶肿瘤抗原和相应HLA分子的候选患者,因此显著限制了患者的资格。
揭示CD28的共刺激作用
T细胞的激活需要多个信号。信号1涉及T细胞受体(TCR)识别抗原呈递细胞(APCs)上由MHC分子呈递的特异性抗原,这一相互作用与CD3复合体相关。然而仅靠信号1不足以使T细胞完全活化,T细胞的完全活化需要信号2和信号3,其中信号2由共刺激分子如CD28介导,信号3则由细胞因子如IL-2介导。在20世纪80年代末,保罗·马丁、约翰·汉森和舒曼·富首次描述了一种称为“clone 9.3”的单克隆抗体的激动剂和刺激特性,该抗体后来称为CD28。CD28是一种膜糖蛋白,也是T细胞活化过程中TCR介导的关键共刺激受体,在小鼠和人类中都是T细胞活化的主要共刺激分子。学者利用CD28的激动剂刺激在体外扩增T细胞,并启动了几项研究,以探索在人类免疫缺陷病毒/获得性免疫缺陷综合征(HIV/AIDS)患者中进行工程化T细胞的过继转移。关于HIV/AIDS治疗发展的更多细节见下文。CD28的发现对于加深对T细胞活化、信号传导、功能及细胞因子产生的理解至关重要。此外,它在细胞疗法的发展和改进中也发挥重要作用,这些疗法通常利用CD3/CD28珠刺激和IL-2处理来实现体外T细胞的生长、扩增和最佳活化。
CAR-T细胞治疗的发展
尽管TCR疗法具有潜在的成功前景,但肿瘤可以通过下调MHC蛋白来逃避内源性抗原识别,而MHC蛋白对于抗原呈递和识别至关重要。此外,正如前几部分所述,找到同时表达靶肿瘤抗原和相应HLA的候选患者非常困难,从而构成一个重大挑战。一种替代策略是使用嵌合抗原受体(CARs),它可以通过MHC非依赖性和不受限制的方式增强T细胞的特异性,从而靶向肿瘤相关抗原。这种策略通过将信号传导功能直接整合到CAR设计中,绕过了对TCR介导的抗原识别(信号1)和CD28刺激(信号2)的依赖。CAR-T细胞通常通过体外病毒转导来生成,以实现基因转移。逆转录病毒和慢病毒在所有目前获批的CAR-T细胞疗法中都有使用。“chimaera(嵌合)”一词源自古利西亚,指的是一种部分是狮子、部分是山羊、部分是蛇的神话生物。同样地,CAR中的“chimaera”代表一种杂交分子,部分是抗体,部分是T细胞受体。该概念由Kurosawa等在1987年首次提出,它结合了抗体衍生的可变重链和轻链(VH/VL)区域与TCR衍生的恒定区域。1989年,Eshhar等报告了通过CAR将T细胞重新定向以MHC非限制性方式识别抗原。后来,CAR-T细胞在1991年被三个实验室独立开发:Irving和Weiss、Letourneur和Klausner、以及Romeo和Seed。虽然由CD8铰链和跨膜结构域(TMD)以及CD3ζ细胞内信号传导结构域(ICD)组成的CAR足以激活T细胞,但Eshhar等在1993年通过引入抗体结构域(现在称为单链可变片段(scFv))与信号传导结构域结合,进一步完善了设计,从而创建了第一代CAR。这一创新使得能够创建针对不同抗原的多样化CAR-T细胞库,标志着CAR-T细胞疗法的重大进展。
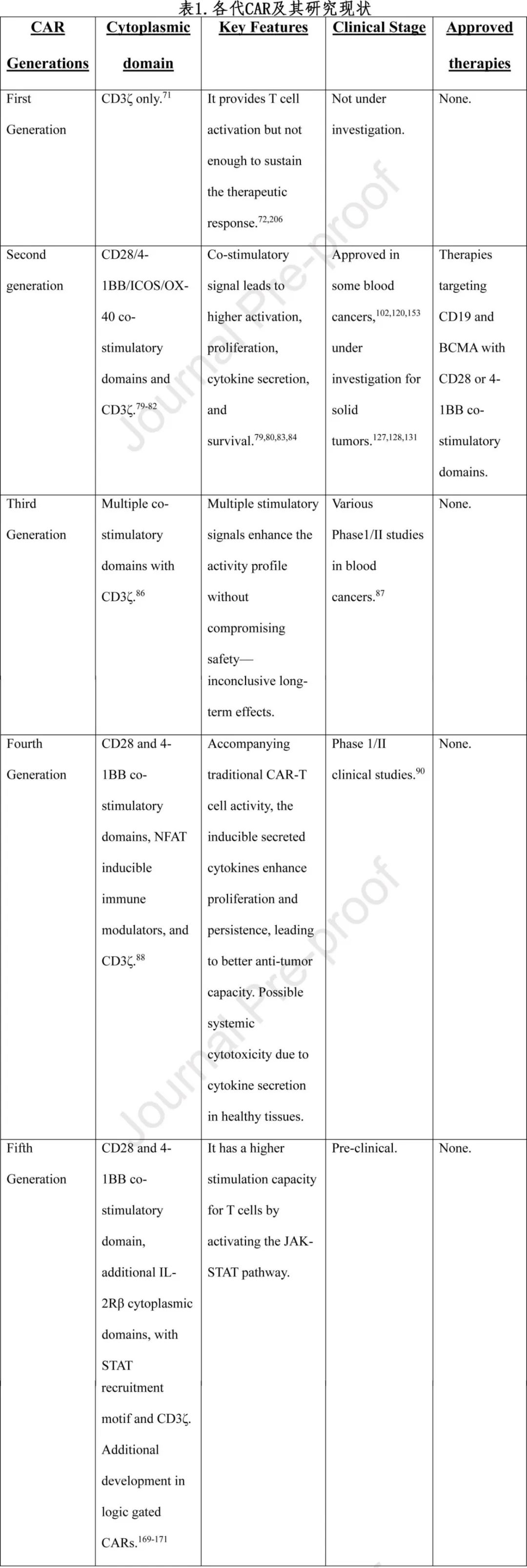
CAR-T细胞世代的创新
如前所述,Eshhar在1993年描述了第一代CAR,其基于从单克隆抗体衍生的scFv和CD3ζ链的免疫受体酪氨酸基激活基序(ITAMs)来介导T细胞活化。这使得T细胞在不依赖MHC的方式下,在体内外均实现了TCR样信号传导、靶细胞溶解和细胞因子分泌。然而由于CD3ζ介导的激活较弱,导致细胞因子分泌不足、增殖受限以及通过凋亡发生的细胞死亡,使得治疗效果不够理想。
为了应对这些挑战,第二代CAR被开发出来,通过引入共刺激域来增强效果。研究最多的共刺激域是CD28,它包含一个信号域,与CD3ζ融合后,能提供第二激活信号,从而增强CAR-T细胞控制肿瘤的能力,这主要归因于增殖增加、细胞因子分泌改善、抗凋亡蛋白上调以及激活诱导的细胞死亡(AICD)延迟。其他共刺激域也被报道,与CD28相比各有优势。例如,4-1BB(CD137)、诱导型T细胞共刺激物(ICOS)和OX-40(CD134)是第二代CAR中常用的共刺激域。多项研究表明,这些共刺激域在功能上存在层次关系。大多数研究表明,结合CD28或4-1BB共刺激域对于治疗各种癌症具有更高的效力。尽管在不同情况下,这两种共刺激方式并未始终表现出优劣之分,但在多种背景下均显示出了相似的疗效。一些研究观察到显著差异,CD28共刺激的细胞表现出更高的细胞因子释放,而4-1BB共刺激的细胞则显示出更强的持续性。
第三代CAR旨在将多种共刺激域的优势整合到一个更强大的版本中。CD28-4-1BB-CD3ζ结构预计能结合CD28ζ和4-1BBζ CAR的优点。多项临床前研究一致证明了第三代CAR的增强功能,其安全性和抗癌效果与前两代相当。一项针对CD19的第三代CAR-T细胞临床试验显示,与第二代CAR-T细胞相比,其扩增和循环能力更高。一些数据表明,CAR-T细胞的耗竭可能是由于多个共刺激域的过度刺激所致。最近,一项独立的I/II期临床试验显示,在对第三代CAR-T细胞治疗有反应的患者中缺乏耗竭标志物CD39,而非应答者中则有更高表达。
第四代CAR-T细胞(或称TRUCKs,即T细胞重定向用于抗原非限制性细胞因子启动的杀伤)旨在通过结合一种可诱导的细胞因子来改进第二代CAR-T细胞,这种细胞因子在CAR-T细胞激活时选择性产生。这些CAR-T细胞被设计为包含一个额外的活化T细胞核因子(NFAT)反应性表达盒,用于诱导表达多种细胞因子,包括IL-7、IL-12、IL-15、IL-18、IL-23以及这些细胞因子的组合,以增强CAR-T细胞的细胞毒性和疗效。针对复发/难治性多发性骨髓瘤的首个人体临床试验,使用第四代B细胞成熟抗原(BCMA)CAR-T细胞设计分泌IL-7和C-C基序趋化因子配体19(CCL19)(NCT03778346),在前两名入组患者中显示出令人鼓舞的安全性和疗效。接受治疗的患者在一个月内有效反应,未出现>2级不良事件,并且在超过12个月的时间内未见复发。
第五代CAR-T细胞,或称下一代CAR-T细胞,涵盖多种旨在提高CAR-T细胞疗法安全性和疗效的策略。在第四代CAR-T细胞的基础上,下一代CAR-T细胞可以在设计中结合膜受体,通过不同的机制发挥作用。更多实例在“利用合成生物学调节CAR-T细胞”部分展示。表1总结了CAR的各个代际,包括其细胞质域、关键特征以及临床阶段(如有)和获批疗法。
T细胞受体融合结构(TRuCs)
2019年,Baeuerle等描述了T细胞受体融合构建体(TRuCs),他们通过将嵌合抗原受体(CAR)的单链可变片段(scFv)结构域与T细胞受体(TCR)的不同亚基融合,创建了一种新型T细胞受体。TRuCs整合到TCR复合体中,并且每当细胞表面存在TCR复合体时就会被表达;与传统的CAR-T细胞相比,TRuCs具有更好的安全性,因为其细胞因子释放减少。最近,一项针对间皮素的TRuCs研究进行了首次临床试验,结果显示单次输注使93%的患者出现放射学肿瘤消退。在同项研究中,在清淋后使用TRuCs,间皮瘤和卵巢癌患者的总缓解率(ORR)分别为21%和29%。尽管这是一项里程碑式的试验,但治疗反应有限,可归因于T细胞耗竭和抗原逃逸。这种治疗方法在血液和实体肿瘤方面都显示出令人难以置信的前景。
CAR-T细胞治疗肿瘤的关键进展
CD19 CAR-T
首个针对B细胞恶性肿瘤的CAR-T细胞试验以CD20为靶点,但Brentjens和Sadelain的研究显示,CD19是B细胞恶性肿瘤的更佳靶点,因其表达水平高于其他谱系限制性抗原。第二代针对CD19的CAR-T细胞包含CD28或CD137(4-1BB)信号域,在临床前模型中进行了开发和测试。早期临床试验中,CD19 CAR-T细胞在复发或难治性B细胞肿瘤(如急性和慢性白血病及淋巴瘤)中展现出显著疗效。
William Ludwig是宾夕法尼亚大学首位接受CAR-T细胞疗法的成年患者,患有难治性慢性淋巴细胞白血病(CLL),经治疗后缓解,十多年内未再患白血病,但遗憾于2021年1月因COVID-19并发症去世。2012年4月,Emily Whitehead成为首位接受CD19 CAR-T细胞疗法的B细胞急性淋巴细胞白血病(B-ALL)儿童患者。Emily出现严重的细胞因子释放综合征(CRS),经托珠单抗治疗后,十多年内无癌生存。随后的大规模临床试验促使FDA于2017年批准Kymriah™和Yescarta™,2020年批准Tecartus™,2021年批准Breyanzi™。这些试验的长期随访数据显示,B细胞淋巴瘤和CLL患者的总缓解率(ORR)为44%至91%,完全缓解率(CR)为28%至68%,且多数患者维持缓解超过两年。对于急性白血病,大多数研究的CR率超过80%。CAR-T细胞疗法后是否进行异体干细胞移植取决于风险因素、微小残留病以及患者是否维持B细胞发育不良(可表明CAR-T细胞具有持续活性)。
BCMA CAR-T
BCMA是肿瘤坏死因子家族的一员,在B细胞的增殖和成熟中发挥作用。它在B细胞和多发性骨髓瘤细胞中均有表达,但在后者中表达更为丰富,但有时表达水平可能较低。2021年,Abecma™(BCMA-41BB-CD3ζ CAR-T细胞)获得美国食品药品监督管理局(FDA)批准(基于 KarMMa临床试验)。2022年获批的Carvykti™则在CARTITUDE-1 Ib/II期临床试验中进行了评估。市售BCMA CAR-T细胞的长期随访数据显示,Abecma在33%的患者中达到完全缓解(CR)或更好,缓解持续时间为19个月。而Carvykti™在83%的患者中达到≥CR,无进展生存率(PFS)为55%。
CAR-T治疗实体瘤
如上文所述,CAR-T细胞疗法在治疗血液恶性肿瘤方面取得了显著成功,但在实体瘤治疗中的应用却面临诸多挑战,主要障碍包括肿瘤异质性、T细胞在肿瘤内的迁移能力差以及肿瘤微环境(TME)因素导致的T细胞功能障碍。尽管存在这些挑战,近期临床试验仍显示CAR-T细胞在多种实体瘤中具有令人鼓舞的安全性和疗效。最近有一篇综述全面回顾了正在进行的实体瘤CAR-T细胞试验,接下来简要总结其中的关键临床试验结果。
近期几项临床研究显示,局部应用CAR-T细胞疗法在治疗侵袭性恶性胶质瘤方面具有潜力。在一项纳入65例复发性高级别胶质瘤患者的一期研究中,评估了局部区域输注白细胞介素13受体α2(IL13Rα2)CAR-T细胞的效果。在58例接受至少三次CAR-T细胞输注的患者中,50%实现≥SD,包括两例PR和两例CR。虽然未报告剂量限制性毒性(DLTs),但35%的患者出现了可能或很可能与CAR-T细胞疗法相关的≥3级毒性。在另一项一期研究中,6例复发性胶质母细胞瘤(GBM)患者接受靶向表皮生长因子受体(EGFR)和IL13Rα2的双价CART细胞的鞘内给药。在CAR-T细胞给药后24-48小时进行的首次磁共振成像(MRI)检查显示,所有六例患者的肿瘤大小均有所减小。在2级剂量下一例患者出现DLTs,表现为3级厌食、全身肌肉无力和疲劳。
此外,Choi等人报告了一项针对3例复发性GBM患者的一期研究结果,患者接受脑室注射CARv3-TEAM-E T细胞,这是一种旨在靶向EGFRvIII的同时分泌针对野生型EGFR的T细胞结合抗体分子(TEAMs)的CAR-T细胞产品。所有三例患者均经历快速的肿瘤消退,其中一例患者(患者2)获得持续超过150天的持久反应。未观察到≥3级良事件或DLTs。在一项纳入K27M突变弥漫性中线胶质瘤的儿童和年轻成人的研究中,11例患者首先接受静脉输注靶向GD2的CAR-T细胞。其中9例患者获得了临床获益继续接受额外的脑室输注GD2 CAR-T细胞。在这9例患者中,7例在CAR-T细胞治疗后肿瘤大小有所减小。值得注意的是,一例患者实现持续30个月的完全缓解。该研究还比较了局部区域和全身CAR-T细胞给药,与局部脑室给药相比,全身静脉输注CAR-T细胞后调节性T细胞和免疫抑制髓系细胞的存在更高。此外,在全身输注CAR-T细胞后观察到更高级别的CRS。
CAR-T细胞在脑癌之外也显示出有希望的结果。例如,靶向Claudin18.2(CLDN18.2)的CAR-T细胞在98例CLDN18.2阳性胃肠道(GI)肿瘤患者中显示出38.8%的客观缓解率(ORR)。值得注意的是,未报告≥3级的CRS、ICANS、治疗相关死亡或DLTs。此外,一项评估靶向癌胎抗原Claudin 6的CAR-T细胞联合CAR-T细胞扩增RNA疫苗治疗CLDN6阳性实体瘤的临床试验报告了33%的未确认ORR,其中包括一例CR。一例患者(5%)出现3级CRS。这些研究结果凸显了在开发和应用CAR-T细胞疗法治疗实体瘤方面所取得的显著进展。
下一代CAR-T技术
在研的下一代 CAR-T 细胞利用创新技术增强 T 细胞效力,克服肿瘤异质性和抗原逃逸,提高安全性和特异性。这些进展和新技术总结于图2。
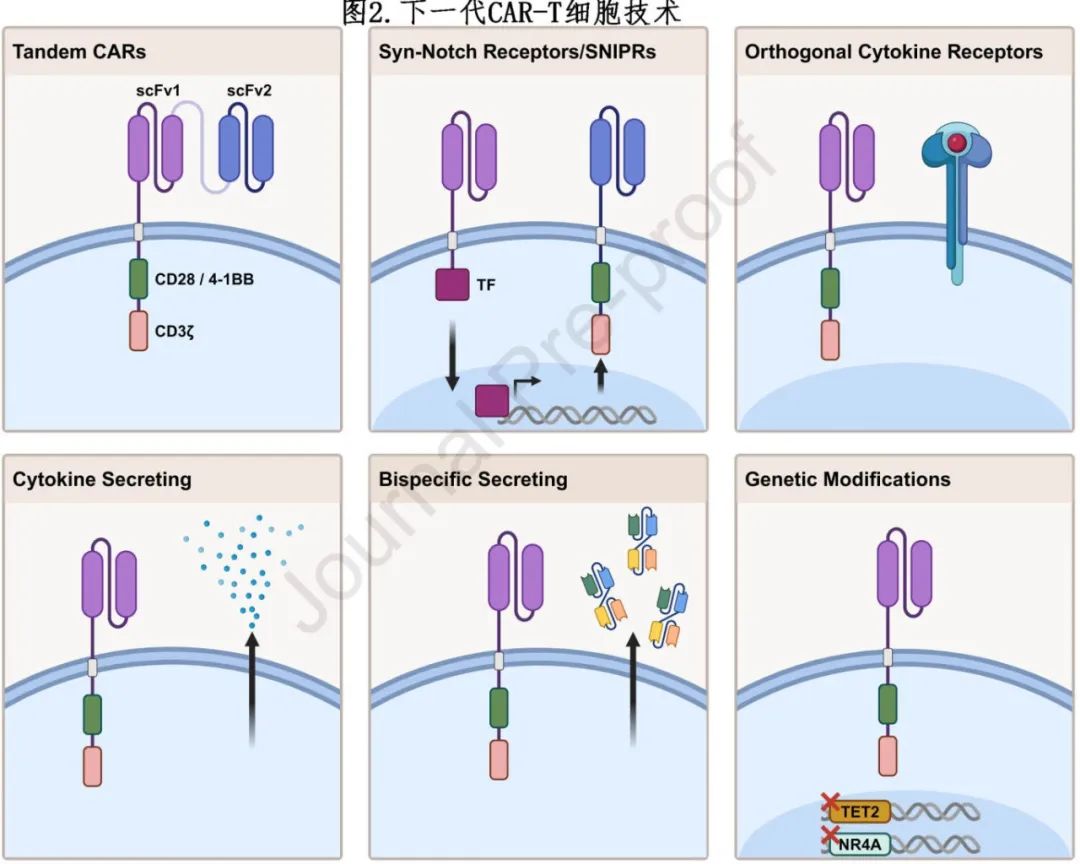
增强CAR-T细胞效力
CAR-T细胞在长时间暴露于持续抗原和实体瘤TME中的免疫抑制因子后,可能会出现耗竭或功能障碍,从而降低抗肿瘤效力,迫切需要提升其效力。增强CAR-T细胞效力的方法之一为改造“装甲”CAR-T细胞,使其能够分泌促炎细胞因子。Steffin等发现,添加IL-15分泌能够增强CAR-T细胞的抗肿瘤活性。在其研究中,患者接受靶向Glypican-3(GPC3)的CAR-T细胞治疗,其中部分细胞被改造为分泌IL-5。在接受标准GPC3 CAR-T细胞治疗的六名患者中,未观察到抗肿瘤反应。相比之下,接受IL-15分泌型CAR-T细胞治疗的患者中有33%达到PR。此外,Svoboda等发现,在先前接受CD19 CAR-T细胞治疗后复发的非霍奇金淋巴瘤(NHL)患者中,使用经过改造以分泌IL-18的CD19靶向CAR-T细胞进行治疗,3个月ORR达到80%,其中50%的患者达到CR。
另一种增强CAR-T细胞效力的方法为改造CAR-T细胞,使其表达能够结合实体TME中的免疫抑制因子(如转化生长因子[TGF]-β)的诱饵受体。例如,CAR-T细胞被改造为共表达一种显性负TGF-β受体II(dnTGF-βRII),这是一种缺乏细胞内信号传导结构域(ICD)的截短受体。这种策略在转移性前列腺癌中得到成功验证,其特征是TGF-β水平升高。表达dnTGF-βRII的前列腺特异性膜抗原(PSMA)和六跨膜上皮抗原2(STEAP2)CAR-T细胞在转移性去势抵抗性前列腺癌(mCRPC)患者中增强了抗肿瘤反应。
另一种提升CAR-T细胞效力的方法是利用CRISPR敲除(KO)筛选,以识别和靶向CAR-T细胞增殖、细胞毒性和持续性的负调节因子。这些筛选揭示了几个限制CAR-T细胞适应性的基因(例如,TET2和核受体NR4A1/2/3),研究表明,删除这些基因可以显著增强CAR-T细胞的抗肿瘤活性。
克服抗原逃逸和异质性
抗原逃逸是限制CAR-T细胞疗法长期效果的关键因素之一,发生在癌细胞下调或失去靶抗原表达,或抗原阴性群体过度生长时,作为对靶向疗法的耐药机制。大约30%的患者在CD19 CAR-T细胞疗法后复发时会出现CD19阴性疾病。为了克服抗原逃逸和异质性,双靶点疗法很有前景。例如,靶向CD19和CD20的双特异性CAR-T细胞在临床前模型中显示出预防CD19阴性复发的潜力,并且目前正在进行临床试验。同样,CD19/CD22和CD19/BCMA双特异性CAR-T细胞也在研究中,以减轻抗原逃逸并实现更持久的反应。
在实体瘤中,肿瘤异质性和抗原逃逸更为显著,双靶点CAR-T细胞显示出显著前景。例如,在胶质母细胞瘤(GBM)中,双价CAR-T细胞靶向EGFR和IL13Rα2,通过同时结合两个不同的肿瘤抗原来解决抗原逃逸。EGFR表位在50-60%的患者中表达,而IL13Rα2在50-75%的病例中表达,这突显了该策略在改善治疗效果方面的潜力。
另一种克服抗原逃逸的策略是使用经过改造的CAR-T细胞分泌双特异性抗体,使CAR-T细胞在靶向一个抗原的同时,通过双特异性介导的旁观者T细胞活化来结合第二个肿瘤抗原。例如,CARv3-TEAM-E T细胞被设计为靶向EGFRvIII,同时分泌针对野生型EGFR的TEAMs。
此外,STAb-T细胞(分泌T细胞结合剂)通过基因工程改造,分泌双特异性抗体,同时靶向癌细胞上的肿瘤相关抗原和T细胞上的CD3分子,促进工程T细胞和内源性T细胞与癌细胞之间形成免疫突触,增强免疫系统识别和消除恶性细胞的能力。
利用合成生物学调控CAR-T细胞
部分CAR-T细胞疗法在实体瘤中显示出令人鼓舞的结果,然而由于缺乏特异性和均一性的肿瘤抗原,on-target/off-tumor毒性仍然是一个重大挑战。下一代CAR-T细胞利用合成生物学工具,可实现精确的功能调控。例如,罗伊巴尔等人开发了合成Notch(synNotch)受体,它由一个细胞外结合结构域(ECD)、一个可裂解的Notch基础跨膜结构域(TMD)和一个转录激活结构域(AD)组成。在这个系统中,CAR-T细胞识别一种抗原,并触发第二种CAR分子或治疗性有效载荷的表达。最近的一项研究表明,一种设计用于结合BCAN(一种定位于大脑的细胞外基质蛋白)的synNotch受体可诱导抗EphA2和IL13Rα2 CAR的局部表达,从而完全清除GBM患者来源的异种移植瘤(PDX)。
贝克和罗伊巴尔团队最近开发了一种先进的、用于细胞通信和疾病感知的工程受体,称为合成膜内蛋白水解受体(SNIPR)。这种受体可以被天然和合成的可溶性配体激活,例如TGF-β和血管内皮生长因子(VEGF)。他们成功地利用这项技术指导CAR-T细胞特异性地靶向和摧毁存在可溶性疾病相关因子的实体瘤,从而最小化on-target/off-tumor毒性。
另一个例子是正交IL-2细胞因子-受体对(orthogonal IL-2 cytokine-receptor pairs)。IL-2是一种能够促进过继转移T细胞的扩增和功能的强效细胞因子,然而全身给予IL-2可能会导致严重的、危及生命的毒性,这种毒性在TIL疗法后给予IL-2时也会出现。索科洛斯基等人开发了正交IL-2细胞因子-受体对,可选择性地激活工程化T细胞。在这个系统中,T细胞被改造为表达一种突变的IL-2受体,该受体仅与相应的突变IL-2配体结合。在临床前模型中,经过改造表达正交IL-2受体的CD19 CAR-T细胞在全身给予正交IL-2时,表现出增强的增殖和抗肿瘤活性,同时避免IL-2相关毒性。
另一种正在测试的方法是在CD28和CD3ζ之间添加全长或截短的IL-2Rβ细胞质结构域,并在CD3ζ的C末端添加一个用于招募信号转导子和转录激活因子3(STAT3)的基序,以抗原依赖的方式激活Janus激酶/信号转导子和转录激活因子(JAK/STAT)通路。可增强T细胞的活性,并促进记忆T细胞的生成。
其他方法包括开关受体和来那度胺门控CAR的开发,后者包含一个对来那度胺有反应的关闭开关。
扩大CAR-T细胞治疗的应用
CAR-T 细胞疗法已经显示出肿瘤肿瘤的希望,正越来越多地探索其治疗多种非肿瘤慢性疾病的潜力,特别是自身免疫性疾病。CAR-T 细胞通过选择性靶向和消除故障的 T 或 B 细胞,为重置功能失调的免疫系统提供了一种新的方法(图3)。
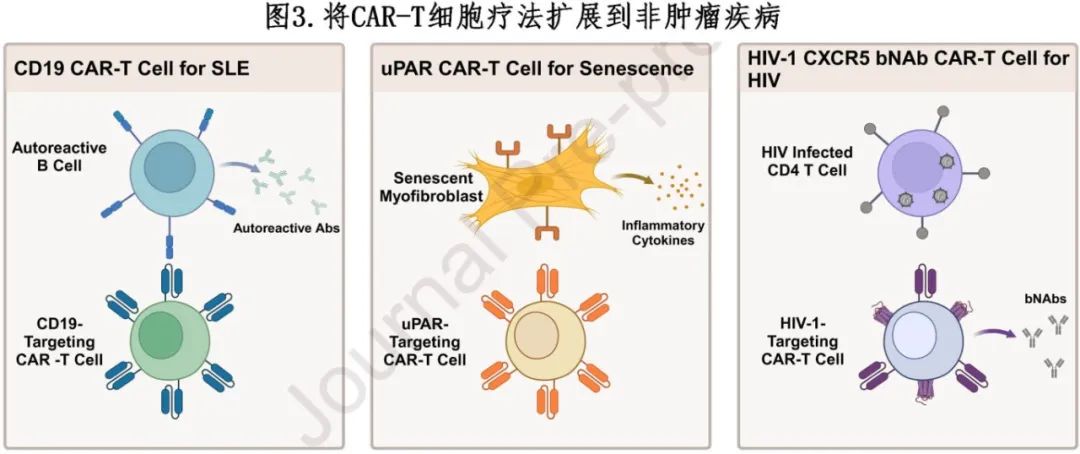
CAR-T用于自身免疫性疾病
CD19已成功用作CAR-T细胞治疗B细胞恶性肿瘤的靶点,并将同样的技术应用于治疗系统性红斑狼疮(SLE)等自身免疫性疾病,该疾病是由于干扰素途径失调和自身抗体的发展导致的自身耐受性丧失。由于靶向CD20的单克隆抗体疗法(如利妥昔单抗)缺乏反应,进一步促使了使用CD19 CAR-T细胞靶向自身反应性B细胞。2021年一项单患者试点研究显示,在输注后一周内CAR-T细胞显著扩增,随后抗双链DNA(dsDNA)自身抗体减少。这些有希望的结果在随后对15名SLE患者、特发性炎症性肌病患者和系统性硬化症患者进行的随访研究中得到进一步证实。患者表现出类似的CAR-T细胞扩增、自身反应性抗体耗竭和临床症状改善。输注后反应持续时间长达2年,整个治疗过程中未见高级别CRS。这些结果为多种疾病病理学显示了希望,目前正扩展到更大的患者群体,并评估长期疗效。同样,针对CD19的CAR-T细胞平台KYV-101也已成功用于治疗多发性硬化症(MS),这是一种由自身反应性细胞靶向髓鞘蛋白而发展的疾病。2024年发表的一项关于两名进展性MS患者的病例报告表明,尽管CAR-T细胞有效增殖和迁移,但自身反应性抗体减少,且未出现ICANS迹象。
CAR-T细胞治疗衰老相关疾病
细胞衰老是一种不可逆的细胞周期停滞状态,当细胞经历压力或损伤(如DNA损伤、端粒缩短或致癌基因激活)时会发生这种状态。衰老细胞不会经历凋亡,而是保持代谢活跃,但失去增殖能力,这一过程通过阻止受损细胞的无控制分裂(可能导致肿瘤)而发挥保护作用。然而随着时间的推移,衰老细胞的积累与年龄相关疾病有关。衰老细胞还会分泌多种促炎因子,可能会导致慢性炎症和组织功能障碍。研究人员开发了一个平台,通过使用针对尿激酶型纤溶酶原激活剂受体(uPAR)的CAR-T细胞成功地清除衰老细胞,uPAR在衰老细胞表面常见且之前已被用于治疗卵巢癌。在肺癌和肝纤维化小鼠模型中证明了治疗效果。尽管低剂量治疗可耐受,但接受高剂量治疗的小鼠出现与致命CRS相关的症状。
最近,通过靶向自然杀伤组2成员D配体(NKG2DL),包括MICA、MICB、ULBP1、ULBP2和ULBP3,在小鼠和非人灵长类动物模型中,使用CAR-T细胞治疗衰老相关疾病的应用范围得到拓展。研究人员证明,通过NKG2DL定向的CAR-T细胞成功清除了小鼠胚胎成纤维细胞(MEFs),并在效应CAR-T细胞中增加包括干扰素γ(IFN-γ)、肿瘤坏死因子(TNF-α)和白细胞介素6(IL-6)在内的炎性细胞因子的转录。在小鼠衰老模型中,通过检测NKG2DL转录本在各种组织中的表达减少,进一步证实了对衰老细胞的有效靶向。在恒河猴模型中,CAR-T细胞输注后,脂肪组织中的衰老相关β-半乳糖苷酶(SA-B-Gal)染色显著减少,也观察到类似的有效结果。这些结果在进一步验证毒性和疗效后,为未来转化为临床试验带来了希望。与其他CAR-T细胞应用一样,CRS和长期持续存在相关的毒性是一个潜在问题,但这些可以通过kills-witch circuits和药物介导的免疫抑制来调节。
CAR-T细胞治疗HIV/AIDS
HIV之所以难以治愈,是因为它能够逃避免疫系统的攻击,具有高突变率,并且能够潜伏性地持续存在。由于CAR-T细胞具有快速增殖和靶向细胞毒性作用,可作为治疗这一具有挑战性疾病的一个很有前景的途径。CD28介导的抗病毒效应与CD4 T细胞上HIV-1辅助受体C-C趋化因子受体5(CCR5)的下调有关。研究团队进一步证明,通过锌指核酸酶(ZFNs)敲除CCR5,使输注的CD4 T细胞对HIV-1产生抗性,并且在HIV-1感染患者中断抗逆转录病毒治疗(ART)期间,这些细胞能够在体内持续存在。这些经过改造的T细胞在体内相对抵抗HIV-1感染。研究团队还成功开发了一种符合GMP的细胞培养系统,进步促进了首批将CD4 T细胞过继转移应用于晚期HIV/AIDS患者的临床试验。
在其他研究中,对HIV感染患者反复给予CD4/CD3-ζ CAR-T细胞治疗后,通过显示输注后一天CAR转录本拷贝数的增加以及CAR-T细胞产品持续存在超过一年,观察到CAR-T细胞的增殖。结果显示,在治疗开始后10周,基线血浆病毒载量的两名患者中HIV转录本显著减少。尽管临床结果较为温和,但该试验进一步激发了增强抗病毒疗效的需求。最近的研究致力于将HIV-1包膜蛋白定向的CAR结构与滤泡归巢的C-X-C趋化因子受体类型5(CXCR5)和广谱中和抗体(bNAbs)相结合,称为M10细胞,以增强细胞溶解效应并靶向潜伏的病毒储存库。通过结合bNAbs和CXCR5,不仅可以中和细胞自由病毒颗粒,防止其下游进入宿主细胞,还可以分别改善T细胞向B细胞滤泡的迁移。在给予chidamide刺激潜伏病毒储存库后,M10细胞治疗显示,在18名患者中有10名与基线相比HIV1 RNA转录本显著减少,且所有患者均耐受治疗,未出现治疗相关的临床毒性迹象。
针对HIV的CAR-T细胞治疗面临诸多挑战,包括工程细胞内感染的风险、靶抗原水平低、脱靶毒性以及难以有效靶向潜伏的HIV储存库。近期的进展旨在通过改进下一代HIV靶向CAR-T细胞的设计和功能来克服这些障碍。
扩大CAR-T细胞的生产
随着CAR-T细胞疗法在疗效和应用范围上的提升,扩大生产规模和降低成本以提高可及性变得愈发重要。关键挑战包括通过血细胞分离术收集细胞、T细胞扩增技术、通过病毒方法整合CAR结构、细胞冻存以及基础设施的总体成本。异体CAR-T细胞疗法展示了扩大生产规模的潜力。通过开发这些“现货型”疗法,无需对每位患者进行血细胞分离,而是可以使用健康供体的细胞进行改造,制成可给予多位患者的治疗产品。这种方法的主要挑战在于预防GvHD和避免宿主免疫排斥。已描述的策略包括TCR基因编辑、HLA修饰、CD52缺失和使用alemtuzumab(阿仑单抗)等。
为了进一步提高现货型CAR-T细胞产品的可及性和疗效,诱导多能干细胞(iPSCs)被建议用作具有常见HLA变异的健康供体T细胞来源,以容纳广泛的患者群体,使它们可以作为“通用”治疗方法,并通过基因工程避免免疫排斥和GvHD。为了提高细胞质量和降低生产成本,研究人员优化了在24小时内制造具有改进抗肿瘤疗效的CAR-T细胞的方案。为减少病毒基因传递相关的成本和风险,正在采用脂质纳米颗粒(LNP)递送信使RNA(mRNA)来在体外和体内改造CAR-T细胞。通过mRNA的LNP递送CAR结构,可以诱导瞬时表达,从而消除对病毒载体的需求。在B细胞白血病小鼠模型中进一步证实了该平台的抗肿瘤疗效和增殖能力。
最令人兴奋的发展之一是使用负载修饰mRNA编码CAR的靶向LNPs,并用抗体修饰LNP以特异性靶向T细胞。Weissman等最近发表了一份报告,描述了将CD4特异性抗体与负载mRNA的LNPs结合,这些LNPs在静脉注射到小鼠体内后能特异且高效地靶向T细胞。与Weissman团队合作,作者也在小鼠中证明,T细胞靶向LNPs可以递送编码抗活化成纤维细胞CAR的mRNA,在体内产生功能性CAR-T细胞。在体内进行CAR-T细胞工程可以提高效率,同时降低体外扩增CAR-T细胞的营运成本,使更多患者能够接受治疗。为解决CAR-T细胞增殖和持续时间的挑战,研究人员在给予CAR-T细胞时结合使用CAR-T细胞扩增mRNA疫苗(CARVac)。一项1/2期试验显示,通过mRNA技术递送肿瘤抗原至APCs,可增强CLDN6靶向CAR疗法的效果,从而整体提升肿瘤清除率。此外,为增强对实体瘤的免疫反应,研究人员在给予CAR-T细胞时结合使用了溶瘤病毒。目前一项1期试验正在结合使用HER2特异性CAR-T细胞与瘤内注射CAdVEC,后者是一种含有产生促炎分子(包括IL-12p70和抗程序性细胞死亡配体1(PD-L1)抗体)的腺病毒。为了将CAR-T细胞疗法扩展到肿瘤学领域及其他领域,正在采用多种方法以提高其可扩展性。通过进一步优化,可以将CAR-T细胞疗法用于治疗超过3万名患者所取得的令人鼓舞的结果进一步推广,以治疗更多患者。
工程T细胞的长期安全性
CAR-T细胞疗法虽然在癌症治疗上取得了革命性进展,但人们对其长期安全性仍存在担忧,特别是插入突变和细胞转化的风险。体内T细胞的稳态在T细胞受体水平上通过克隆竞争来控制,相对抗基因毒性。然而对于缺失T细胞受体的异体T细胞产品,T细胞稳态不再在克隆水平上受到控制,从而增加了第二次打击突变(即Knudson假说)和克隆转化的可能性。
插入突变发生在用于引入CAR结构的病毒载体整合到宿主基因组中可能破坏正常基因功能或激活癌基因的位点,可能导致恶性转化。例如曾报道,在制造过程中,CAR DNA意外地整合到一个白血病B细胞的基因组中,导致治疗后九个月疾病复发。还报道了一个在治疗CLL期间的病例,其中慢病毒载体整合到TET2基因与CAR-T细胞的扩增和良性克隆增生有关。
除了这些理论风险,临床观察也发现实际的不良事件。2023年11月,美国FDA发布了一份报告,描述了在接受针对BCMA或CD19的CAR-T细胞疗法治疗的患者中发现的T细胞恶性肿瘤。这些恶性肿瘤在输注后几周内就可能出现,并且包括致命结果;FDA已强制要求更新所有获批CAR-T细胞疗法的黑框警告,以包括T细胞恶性肿瘤的严重风险。作者最近评估了宾夕法尼亚大学38项T细胞疗法试验中783名患者的安全结果,总观察时间为2200患者年。这些试验使用整合性伽马逆转录病毒或慢病毒载体将工程受体传递给靶向HIV-1感染或癌症的T细胞,未没有发现高水平标记或其他插入突变的迹象。因此,输注自体工程T细胞的转化风险较低,因为大多数病例与先前化疗引起的DNA损伤有关。相比之下,异体T细胞的输注据报道会导致转化,特别是当在非常高插入拷贝数下制造、使用转座子系统进行CAR基因传递时。
总结
本文探讨了CAR-T细胞疗法从过去到现在的演变以及未来的展望。从最初发现过继细胞疗法,到如今能够稳健地改造T细胞以表达合成受体和基因电路,这一领域在治疗多种恶性肿瘤、感染和自身免疫疾病方面展现出日益增长的前景。虽然第二代CAR-T细胞疗法已经取得了显著的临床成功,但提高其持续性、降低毒性和克服肿瘤耐药机制等挑战使得推进到下一代变得更加复杂。此外,新型CAR-T细胞设计的开发通常需要标准化的生产方案、最佳给药途径的确定、剂量优化和毒性监测,所有这些都需要相当长的时间。然而,我们认为,综述中讨论的下一代CAR-T细胞的早期临床数据为这些疗法获得监管批准、进入标准患者护理展示了有希望的前景。尽管未来还有许多挑战,但过去的经验预示着未来,该领域将不负众望,继续优化CAR-T细胞平台,为患者提供更安全、更有效的治疗选择。
参考文献
Patel KK, Tariveranmoshabad M, Kadu S, Shobaki N, June C, From Concept to Cure: The Evolution of CAR-T Cell Therapy, Molecular Therapy (2025), doi: https://doi.org/10.1016/j.ymthe.2025.03.005.

本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言
















#Car-T细胞疗法# #过继细胞疗法#
6