扬州大学陈昊/王永祥/王辉辉团队《Biomaterials》:具有时间响应性核壳结构水凝胶微球用于脊髓损伤修复
2025-03-20 BioMed科技 BioMed科技 发表于陕西省
扬州大学团队研发 Mg-Zn 掺杂核壳水凝胶微球用于 SCI 治疗,其能按病理进程时序释放金属离子,改善损伤处离子紊乱,实验证实可促进小鼠后肢运动功能恢复。
金属离子在维持神经细胞功能和促进神经修复方面具有重要作用。脊髓损伤(Spinal Cord Injury, SCI)作为一种严重的中枢神经系统疾病,由于损伤后血脊髓屏障的破坏、细胞膜通透性的改变以及炎症反应的激活,金属离子的浓度在损伤部位会出现异常波动。例如,在初期,Mg2+浓度在SCI后会迅速下降,这不仅会导致神经兴奋性毒性增加,还会加剧炎症反应。相反,Zn2+在损伤初期会从受损的神经元中释放并积累,尽管其在一定浓度下对神经修复有积极作用,但随着神经修复的进程,锌离子的需求增加,导致损伤区域的的锌离子浓度出现波动。这种损伤区域的金属离子的随着病理进程出现的紊乱不仅会干扰细胞内的信号传导和代谢过程,还会进一步加剧神经细胞的损伤和死亡,从而影响脊髓的修复和再生能力。因此,深入理解SCI后金属离子的动态变化,开发针对不同时期的金属离子补充策略不仅使损伤位置的离子达到生理水平而且可根据金属离子的生物学特性在不同的病理阶段发挥治疗作用。
针对以上问题,扬州大学陈昊、王永祥和王辉辉研究团队报道了一种具有时间响应性金属离子供应的Mg-Zn掺杂核壳结构的水凝胶微球,用于SCI的治疗(图1)。微球外壳由Mg2+交联的甲基丙烯酸化明胶(GelMA)构成,GelMA经过苯硼酸(PBA)改性后,其与Mg2+形成配位键,从而增强了GelMA的离子负载能力和释放控制能力,不仅提供物理支撑,还能模拟细胞外基质环境。内核则包含负载Zn2+的聚乳酸-羟基乙酸共聚物(PLGA)微球,这种内核设计使微球能够根据病理环境的变化,实现金属离子的精准释放。整个微球呈球形,尺寸均匀,表面光滑,具有良好的生物相容性和降解性。这种结构设计巧妙地结合了两种材料的特性,使微球在脊髓损伤修复中既能提供即时的物理支持,又能通过时序性释放金属离子来调控病理微环境,为神经再生创造有利条件。相关工作以“Phase-adapted Metal Ion Supply for Spinal Cord Repair with a Mg-Zn Incorporated Chimeric Microsphere”为题发表于《Biomaterials》期刊。
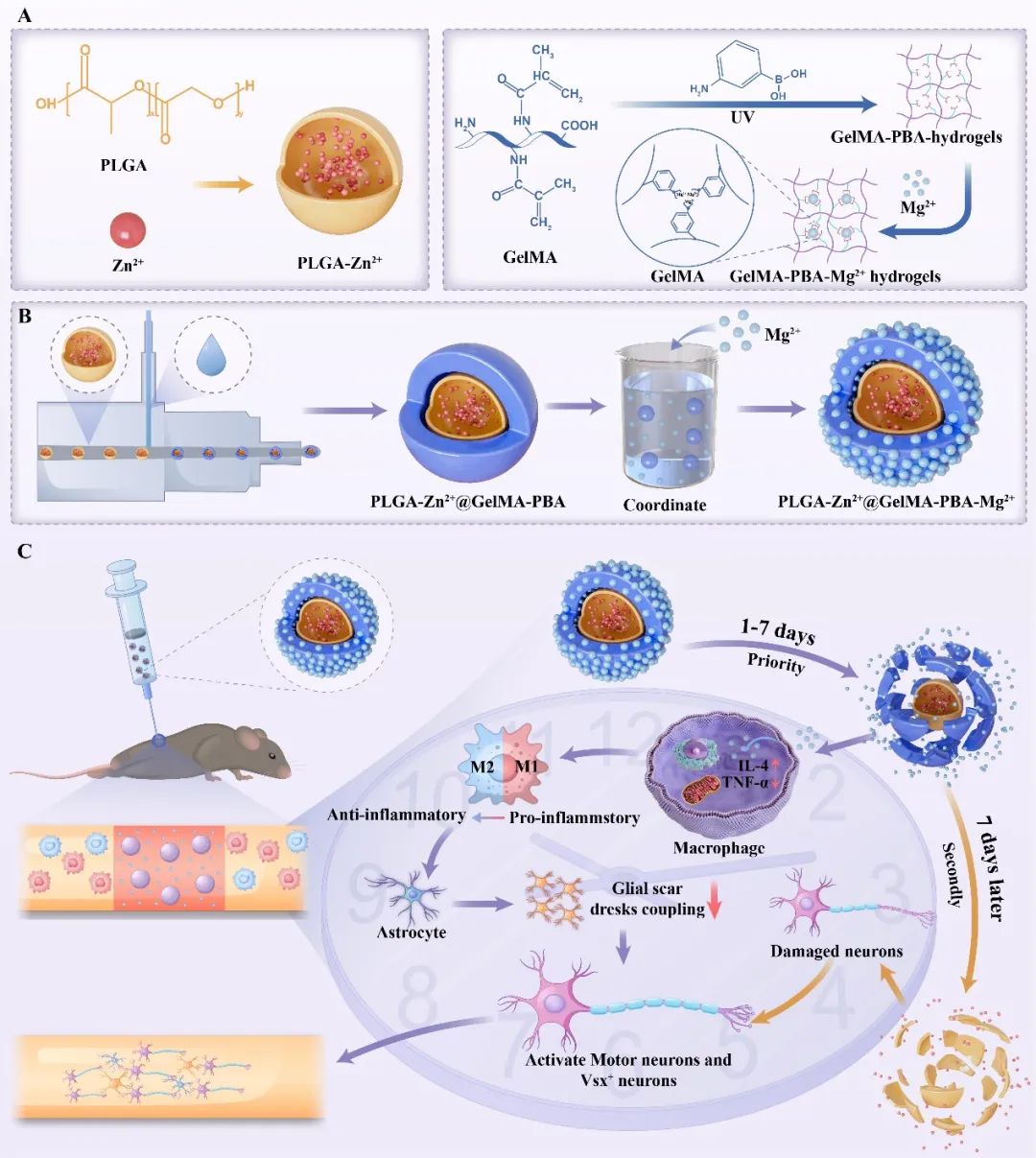
图1 Mg-Zn核壳结构水凝胶微球治疗脊髓损伤示意图
通过微流控技术,GelMA滴液在紫外光下聚合成为凝胶微球。在PBS环境下,GelMA微球表现出良好的稳定性,而在胶原酶环境下则表现出浓度依赖性的降解特性。特别是15%浓度的GelMA微球,其降解时间与SCI中Mg2+的损失时间线高度匹配。此外,经过改性后,降解和离子释放特性得到了进一步优化,特别是在胶原酶环境下,Mg2+的释放更加可控,这为SCI治疗中金属离子的精准、时序性补充提供了可能(图2)。

图2 GelMA微球的制备、表征及降解特性分析
PLGA微球在PBS环境下表现出良好的稳定性和Zn2+的持续释放特性。成功将PLGA微球封装在GelMA微球内。核壳结构微球表现出良好的降解特性和金属离子释放行为。Mg2+先释放,后Zn2+释放,这种时序性释放与SCI的病理过程高度匹配,有助于在不同阶段提供相应的治疗作用(图3)。

图3组合形成的核壳结构微球
活体成像显示微球在植入后均匀分布并逐渐降解。组织学分析和显微镜观察结果与荧光数据一致。(图4)。

图4微球在SCI小鼠模型体内的降解情况

图5评估复合微球对SCI后肢运动功能恢复的影响
术后8周内的BMS评分以及8周后的Footprint、MRI成像、MEP等结果表明复合微球组能够有效促进后肢运动功能的恢复(图5)。本研究得到了国家重点研发计划,国家自然科学基金项目,江苏省研究生科研创新项目的资助。
原文链接:
https://www.sciencedirect.com/unsupported_browser

本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言
















#脊髓损伤# #运动功能恢复#
9