皮肤干细胞在银屑病中的研究进展
2025-01-01 海龙话皮 海龙话皮
针对皮肤干细胞与银屑病之间的关系尚未完全阐明,但因其能够调节免疫系统和促进组织再生的优势,银屑病的干细胞治疗正在被探索作为一种潜在的治疗选择。
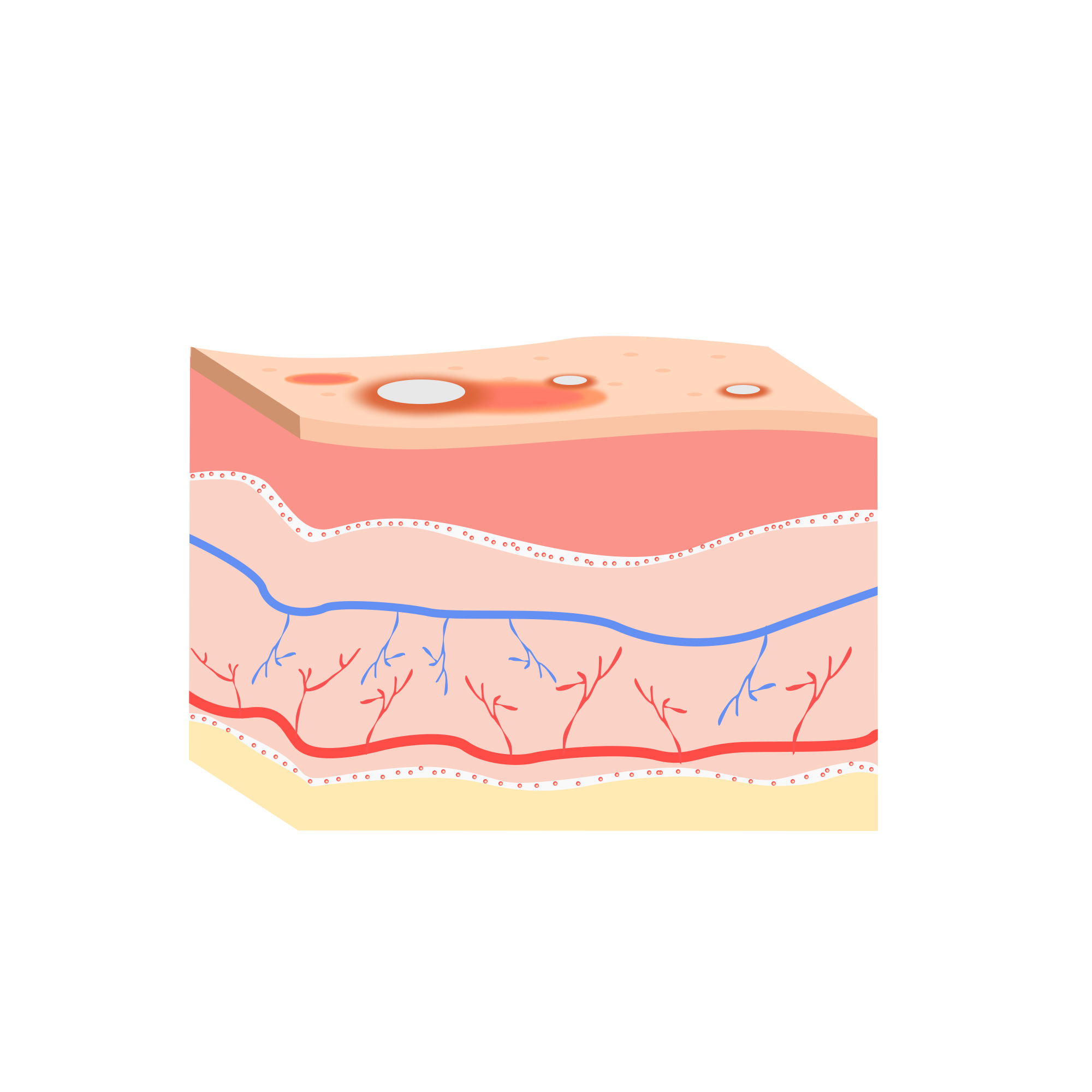
银屑病是一种易复发的由免疫系统介导的慢性炎症性皮肤病,全球患病人数超过1.25亿人,约占全球人口总数的2%~3%。当前,普遍认为银屑病是由遗传和环境因素共同作用导致的疾病。大量的研究深入解析银屑病的发病机制并将结果应用于银屑病的诊疗中,现已取得较好的疗效。正常生理状态下的角质形成细胞离开基底层即开始分化,其中位于基底层的表皮干细胞(epidermal stem cells,ESCs)通常处于静息状态,激活后可以促进表皮的增殖、修复和分化并在胚胎发育及成熟后维持组织稳态中发挥重要作用。

而银屑病患者的角质形成细胞的分化、增殖及ESCs的激活状态出现显著异常,角质形成细胞过度生长导致厚积的鳞屑性丘疹、斑块。当前关于银屑病的研究主要针对表皮的角质形成细胞的功能,而干细胞作为皮肤重要的细胞类型之一,在银屑病中的作用机制至今仍未完全阐明。尽管人们早已意识到两个领域具有一定的交叉性,但此方向的研究仍然较局限。
皮肤干细胞
1、表皮干细胞:
ESCs是皮肤组织的特异性干细胞,具有非成熟细胞的特征,即细胞体积小且细胞器少。ESCs主要来源于皮肤基底层,占基底层细胞数的2%~ 4%,具有分化为表皮角质形成细胞和皮肤其他附属器官的潜能,是皮肤组织创伤修复和再生的理想干细胞。ESCs的表面标志物有细胞角蛋白(cytokeratin,CK)19和整合素β1,分化为成熟的角质层细胞后可以表达CK10。
ESCs具有终身、无限的自我更新及分化成角质形成细胞的能力。其增殖方式通常有两种:一是不对称分裂,表现为一个干细胞分裂成一个短暂扩增细胞(transit amplifying cell,TA细胞)和一个干细胞;二是高度调控式分裂,可以分裂成两个干细胞或两个TA细胞。
对比正常表皮和创伤处表皮的基因表达水平发现ESCs在体内平衡过程中可能存在不同的高炎症和低炎症两种状态,并在伤口愈合过程中出现炎症、迁移相关基因的表达上调。更值得关注的是,ESCs具有能向皮肤的各种附属器分化的能力,故成为创伤修复的理想干细胞。但若ESCs异常增殖和分化可能会导致基底细胞癌 (basalcell carcinoma,BCC)和鳞状细胞癌,尤其是G蛋白偶联受体(leucine-richrepeat-containingr-protein coupledreceptor,LGR)5+ESCs与BCC的发生发展密切相关。
2、滤泡间表皮干细胞:
滤泡间表皮(interfollicular epidermis,IFE)中ESCs存在于基底层,有良好的增殖能力,可以通过LGR6、富亮氨酸重复序列和免疫球蛋白样结构域1(leucine-rich repeats and immuno globulin like domains1,LRIG1)或 P63和组蛋白脱乙酰酶1(histone deacetylase1,HDAC1)联合对其进行标记。IFE中的ESCs通过增殖和分化替代衰老或受损的表皮细胞维持表皮结构的完整性。大多数情况下ESCs处于静息状态,当受到外界因素刺激,ESCs被激活并开始增殖,维持角质形成细胞增殖、 脱落速度的平衡,参与皮肤稳态的维护。
针对IFE中干细胞的功能及分化的探索,有研究通过单细胞RNA测序技术(single-cellRNA sequencing,scRNA-seq)解析人类包皮表皮分离出的单细胞,探究IFE中细胞的异质性。研究者将表达相似且已知的标记基因的细胞分为一组队列,其中位于基底层的干细胞队列所富集的细胞标记基因为角蛋白(keratin,KRT)5、KRT14和钙黏着蛋白3(cadherin-3,CDH3)。
随后,通过对IFE中干细胞的分化过程进行谱系轨迹追踪,发现随着IFE中ESCs的不断分化,KRT5、KRT14和胶原蛋白ⅩⅦα1链(collagentypeⅩⅦ alpha1 chain,COL17A1)的表达量呈现减少的趋势,而棘层标志 物KRT10和颗粒层标志物钙调蛋白5 (calmodulinlike5,CALML5)的表达量则不断增加,表现良好的分化能力。此外,IFE区域的干细胞表现整合素β1、整合素α6的高表达和CD1的低表达。但是,银屑病中IFE区域的干细胞的活化和调控机制仍不确切。
3、毛囊干细胞:
人体覆盖大约有500毛囊,毛囊作为一种多细胞的微观器官,位于真皮及皮下组织中,由上皮细胞和结缔组织构成。毛囊是毛发生长的必需结构, 由上至下分为漏斗部、峡部及毛囊下部,自外而内包括毛干外毛根鞘 (outer root sheath,ORS)和内毛根鞘(inner root sheath,IRS)。
毛囊结构中广泛分布的毛囊干细胞(hairfollicle stemcells,HFSCs)具有很强的分化潜能,能最终分化形成毛囊、皮脂腺及表皮,这为其在皮肤移植中发挥潜能提供了功能基础。HFSCs属于多能干细胞,具有分化成多种细胞的潜力,如黑色素细胞、 角质形成细胞、脂肪细胞、平滑肌细胞和骨细胞等,具有显著的多谱系增殖分化能力。
ORS作为毛囊中的重要结构,其中包含角质形成细胞、黑素细胞、干细胞等。ORS在皮脂腺导管与立毛肌附着点之间有一明显的向外突起的区域,称之为毛囊隆突区,该区内有大量的HFSCs富集,是HFSCs的主要储存库。
毛发的生长周期分为3个时期:生长期、退行期和休止期,该过程与 HFSCs密不可分。初期,处于静息状态的HFSCs被激活后即离开隆突区形成祖细胞,祖细胞不断增殖分化构成ORS。周期结束时,ORS处细胞又返回至隆突区恢复静息状态,至此完成一次循环。
目前,HFSCs已知的常用表面标志包括整合素α6、整合素β1、KRT15、KRT19、CD34、CD200、CD71、转录因子P63、Lgr5。现已证明整合素β1和KRT19在毛囊新生时高表达,并提出KRT15作为HFSCs的标志物的可能性,认为KRT15的缺失可能是未分化干细胞分裂的最早迹象之一。KRT15还被发现在表皮基底层、汗腺和口腔上皮细胞中均持续表达,故也有学者提出标记HFSCs时应当使用KRT15联合其他标志物一同标记,以提高标记的准确性。因此KRT15和CD200常联合作为人HFSCs的表面标志物。
4、间充质干细胞:
间充质干细胞(mesenchymalstem cells, MSCs)是一种源自未成熟胚胎结缔组织的细胞, 属于多能干细胞,存在于骨髓、脂肪、血液、皮肤等组织中,具有自我复制、自我更新、多向分化潜能、造血支持和促进干细胞植入等特点。此外,MSC具有低免疫原性和独特的免疫调节作用,能逃避免疫识别,抑制免疫应答,并具有定向归巢和损伤趋化作用。皮肤中的MSCs具有免疫调节功能,从而发挥免疫重建的功能,通过直接分化或旁分泌的方式参与修复和再生过程。
此外,它能够分泌多种生长因子和细胞因子,促进血管生成、细胞增殖和迁移,从而加速损伤皮肤的修复和再生。MSCs来源的细胞外囊泡影响血管生成、抗纤维化、促进巨噬细胞极化及细胞增殖与迁移等生理过程,提示在皮肤炎症性疾病治疗及瘢痕修复领域中的潜力。此外,MSCs通过抗氧化、抗凋亡、抗炎等作用及激活真皮成纤维细胞增殖发挥抗皮肤光老化作用。皮肤MSCs分泌的细胞因子能促进毛囊周围血管生成,从而促进毛发生长。在治疗雄激素性脱发和自身免疫导致的斑秃等方面同样具有潜在的应用价值。
皮肤干细胞与皮肤病
干细胞因其维持正常的皮肤稳态及对受伤细胞的修复和再生的功能,已用于多种疾病的治疗,包括雄激素性脱发、斑秃、银屑病、白癜风、大疱性表皮松解症、创面修复等。目前治疗所使用的干细胞多来自造血干细胞,皮肤干细胞的治疗应用相对较少。但通过对皮肤干细胞的生物学行为及机制的探索,可能帮助解释炎症性疾 病、遗传性皮肤病及肿瘤等疾病的发生机制并发现多种疾病的治疗新靶点。
研究发现ESCs在机体受到创伤后修复皮肤的能力与它 们向创面中心增殖和迁移的能力相关。皮肤受损后,创面边缘的干细胞激活参与修复,HFSCs从隆突区迁移至创面,参与再上皮化的过程。而来自毛囊上峡部及其他区域的ESCs激活速度较HFSCs更加迅速作,用时间更长,维持表皮层细胞的更新及长期修复。
此外,有学者提出ESCs具有炎症记忆,该功能定位于染色质中,表现为炎症消退后保留炎症感应调节元件和与增强子相关的基因。当再次受到炎症刺激即可增强基因的转录并促进伤口修复,增强皮肤的敏感性及修复能力。这种功能主要涉及表观遗传重编程、 炎症小体和白细胞介素(interleukin,IL)1β,不需要巨噬细胞和T细胞参与。该研究对于ESCs炎症记忆的探索可能帮助阻断炎症性皮肤病(如特应性皮炎、银屑病等)的进展并提供治疗的新思路。
银屑病与干细胞
1、银屑病与表皮干细胞:
银屑病是一种慢性皮肤疾病,角质形成细胞增殖过度导致皮肤上形成厚重的鳞状斑块。组织病理学特征包括角化过度伴角化不全、真皮血管扩张及炎症细胞浸润。其中,ESCs作为皮肤再生过程的重要组成部分,其功能障碍会加剧银屑病的发生和进展。银屑病中免疫细胞尤其是T细胞在发病机制中起重要作用。激活的免疫细胞释放炎症细胞因子会破坏ESCs的正常功能。正常生理状态下 ESCs可以产生角质形成细胞并促进细胞分化,而银屑病皮损处的ESCs会产生未成熟或仅部分分化的角质形成细胞从而导致皮损处角质层增厚。这些异常的角质形成细胞无法像正常细胞一样脱落,进一步加剧了银屑病症状。
此外,皮损处ESCs的增殖和分化之间的平衡被破坏,皮损处干细胞具有更高的增殖率,可促进角质细胞的快速生成及分化过程。有研究使用流式细胞术对比银屑病皮损和正常皮肤后发现皮损区角质形成细胞较非皮损区体 积更小、增殖更明显。且皮损处角质形成细胞的干性标志因子CD29、CD44、CD49f和P63的表达量均增加,故可以认为银屑病的炎症进展与ESCs的分化与增殖密不可分。
2、银屑病与间充质干细胞:
在银屑病的机制研究和干细胞治疗领域,MSCs同样受到许多研究者的关注。有研究探究银屑病的炎症微环境与MSCs之间的相互作用,提出MSCs可能作为银屑病发病的始动因素。
皮肤来源的MSCs可调节皮肤组织的发育和再生,并通过分泌细胞因子影响皮肤微环境。MSCs可以阻碍T细胞的增殖过程,从而调控T细胞介导的免疫反应。目前人 们已经开始尝试使用MSCs治疗银屑病患者,但是具体机制仍未完全明确。MSCs的抗炎和免疫调节特性被应用于自身免疫性疾病治疗,现已成功地在患者和小鼠身上进行测试。
有研究通过以健康人群皮肤作为对照,分离银屑病患者皮肤中MSCs并对Th1、Th2及Th17的相对表达进行分析,观察到编码Th1和Th17的部分细胞因子的基因[如肿瘤坏死因子α(tumournecrosisfactoralpha,TNF-α)、γ干扰素(interferon-γ,INF-γ)、C-X-C基序趋化因子配体 (motif chemokineligand,C-X-C)10、CXCL9等]相对表达含量升高,而编码Th2的细胞因子基因[如IL-27、转化生长因子β1(transforming growth factor beta1 ,TGF-β1)、CXCL12等]的相对表达在两种人群中并无差别。在银屑病患者皮肤的MSCs中表现出的Th1-Th17和Th2通路表达的异常情况,加强了MSCs参与银屑病早期发病的猜想。
研究证实经咪喹莫特诱导的银屑病小鼠模型静脉输注人脐带间充质干细胞(human umbilical cord MSCs,hUC-MSCs)后,表皮中基质金属蛋白酶-13(matrix metalloproteinase-13, MMP13)的表达下调并抑制了角质形成细胞的增殖,使细胞周期阻滞在G1期,故认为hUC-MSCs可能通过TNF-α/NF-κB/MMP13通路对银屑病发挥治疗作用。其他的体外实验及小鼠实验也已验证了MSCs具有抗皮肤炎症、促角质细胞增殖和促炎细胞因子的分泌作用,证实MSCs作为银屑病治疗的新手段的可行性。
3、银屑病与毛囊干细胞:
头皮是银屑病的好发部位,约80%的银屑病患者皮损会累及头皮,但是极少出现脱发的情况,故针对银屑病的研究时很少关注其与毛发之间的关系。但因头皮部位影响美观程度,故有效管理头皮银屑病对于改善患者的生活质量及减轻心理压力至关重要。也有研究者提出虽然银屑病与毛发生长看似没有联系,但是二者之间可能存在一种潜在 “开关”机制,该 “开关”可以同时控制毛囊细胞的增殖和银屑病病变。
Suzuki等也提出双向的 “毛囊-银屑病轴”的概念推测二者之间的相关性。具体解释为:毛囊中受损的角质形成细胞可以分泌相关的信号因子诱导银屑病的进展。若存在压力源或者使用促银屑病药物时会 抑制毛发生长,但使用抑制银屑病的药物时往往 可以刺激毛发的生长。人胸腺基质淋巴细胞(thymic tromal iymphopoietin,TSLP)被认为是促进细胞增殖的影响因子,研究者发现在银屑病模型小鼠中用阻断TSLP的表达可以减轻小鼠的表皮增殖及皮肤炎症反应。
在已知二者之间存在关联后,研究者们从信号转导通路和细胞因子的角度寻找HFSCs与银屑病发病机制间的联系。在大鼠胡须毛囊中无翅型MMTV整合位点家族 (wingless-type MMTV integration site family, wnt)10b、 Wnt10a、 Wnt5a、β-连环蛋白(β-catenin)及下游的淋巴细胞增强结合因子1(lymphoid enhancer binding factor1,Lef1)、转录因子3(transcription factor 3,Tcf3)与CD34、CK15共表达并可以用来定位大鼠的HFSCs。而Wnt/β-catenin通路被认为是导致毛发从静止期过渡到生长初期阶段的中央通路。若Wnt信号转导通路被激活,可以促进银屑病皮损处角质形成细胞增生并激活静止期的HFSCs并诱导再生。Hawkshaw等通过实验提出人类的隆突区HFSCs具有释放和抑制Wnt信号的功能,认为其具有调节Wnt通路活性的能力。
除Wnt/β-catenin通路和HFSCs间的关系以外,通过对已构建的DKO*-银屑病样小鼠模型(敲除c-Jun和JunB基因的小鼠)与对照组小鼠进行基因本体论富集分析,发现突变的隆突区HFSCs表现出与银屑病的促炎介质有关的基因的特异性富集,特别是与花生四烯酸代谢相关的基因及特定的细胞因子,如TNF-α、IL-23和IL-1α。而非突变型的HFSCs则出现与血管生成和上皮细胞迁移等相关的基因富集现象。故提出突变型的HFSCs在银屑病进展中具有重要的促炎作用。并且利用该小鼠模型提出HFSCs中c-Jun和JunB的缺失可以启动并维持小鼠耳部皮肤出现银屑病样斑块并促进表皮增生和炎症的表达。
小结与展望
目前,针对皮肤干细胞与银屑病之间的关系尚未完全阐明,但因其能够调节免疫系统和促进组织再生的优势,银屑病的干细胞治疗正在被探索作为一种潜在的治疗选择。
参考文献:
1.周芯竹,许静凯,夏青月等.皮肤干细胞在银屑病中的研究进展[J].中国医学前沿杂志(电子版),2024,16(12):16-21.
2.MOKRYJ,PISAL R.Developmentand maintenance of epidermal stem cells in skin adnexa [J].IntJ MolSci,2020,21 (24):
3.SINGH R.Basal cells in the epidermis and epidermal differentiation[J].Stem Cell Rev Rep,2022,18 (6):1883-1891.
4.其他文献略。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言













感谢您的短信
28
#银屑病#银屑病的干细胞治疗正在被探索作为一种潜在的治疗选择。
33
#银屑病# #皮肤干细胞#
36