Autophagy:广州医科大学刘浩等团队研究发现靶向NSD2可能是TNBC患者的有前途的治疗策略
2025-04-13 iNature iNature 发表于陕西省
该研究揭示了组蛋白甲基转移酶NSD2/WHSC1(核受体结合SET结构域蛋白2)是TNBC进展中自噬的新型表观遗传调控因子。
三阴性乳腺癌(TNBC)患者治疗失败和预后不良的主要原因是肿瘤转移。巨自噬/自噬在肿瘤生长和转移中起着至关重要的作用。自噬相关因子的遗传或表观遗传调控会改变自噬水平,从而促进癌症进展并影响治疗效果。然而,目前尚未阐明TNBC进展中自噬的转录和表观遗传调控的分子基础。
2025年3月25日,广州医科大学刘浩,中山大学江冠民和北京大学肿瘤医院云南医院刘熙共同通讯在Autophagy(IF=14.6)在线发表题为“H3K36me2 methyltransferase NSD2/WHSC1 promotes triple-negative breast cancer metastasis via activation of ULK1-dependent autophagy”的研究论文。该研究揭示了组蛋白甲基转移酶NSD2/WHSC1(核受体结合SET结构域蛋白2)是TNBC进展中自噬的新型表观遗传调控因子。
作者发现,NSD2的表达在TNBC细胞中显著上调,且高NSD2表达与TNBC的不良生存率相关。NSD2表达升高在多种TNBC模型中显著促进TNBC转移。从机制上讲,ULK1(unc-51样自噬激活激酶1)被确定为NSD2的新型靶标,NSD2介导的组蛋白H3K36me2甲基化直接激活TNBC细胞中的ULK1转录。值得注意的是,NSD2诱导的ULK1表达有助于自噬体的成熟并增加自噬通量,从而促进TNBC中与自噬相关的恶性肿瘤进展。此外,使用MS159和MCTP-39对NSD2进行药理学抑制可在体内和体外显著抑制TNBC的自噬、生长和转移。总之,作者的研究结果证实了NSD2-H3K36me2轴在调节ULK1表达中起着关键的表观遗传作用,并确定了在促进TNBC进展中的新型NSD2-ULK1-自噬信号轴,这表明NSD2抑制可能是治疗TNBC的有效策略。

乳腺癌是全球范围内最常见的女性癌症类型,并且是女性癌症相关死亡的主要原因。三阴性乳腺癌(TNBC)的特征是缺乏雌激素受体(ESR)和孕激素受体(PGR)的表达,并且没有erb-b2受体酪氨酸激酶2(ERBB2/HER2)的过度表达或基因扩增。TNBC占所有乳腺癌病例的15–20%,是一种生物学上侵袭性强的肿瘤,具有较高的远处转移发生率和较差的预后。大约46%的TNBC患者在诊断后的第三年会出现远处转移。在当前治疗下,转移后的中位生存时间仅为13.3个月。然而,针对特定分子靶点的治疗很少能在临床上显著提高转移性TNBC患者的生存率。因此,了解TNBC转移的确切机制至关重要,且有效的治疗方法正在涌现。
自噬是一种高度保守的分解代谢过程,通过形成自噬体来降解未折叠的蛋白质和受损的细胞器,从而维持细胞功能和稳态。多项研究表明,自噬与TNBC的进展密不可分。考虑到其侵袭性,TNBC的自噬水平高于其他乳腺癌亚型。自噬相关蛋白(如MAP1LC3A/LC3A和LC3B)在TNBC中的表达高于其他亚型。此外,最近的研究报道,自噬参与癌症的进展,包括侵袭和转移。自噬通过增强癌症干细胞表型、调节细胞粘附、诱导上皮-间充质转化(EMT)以及为肿瘤细胞侵袭提供能量来促进肿瘤侵袭和转移。因此,阻断自噬被认为是治疗TNBC的一种有前途的方法。
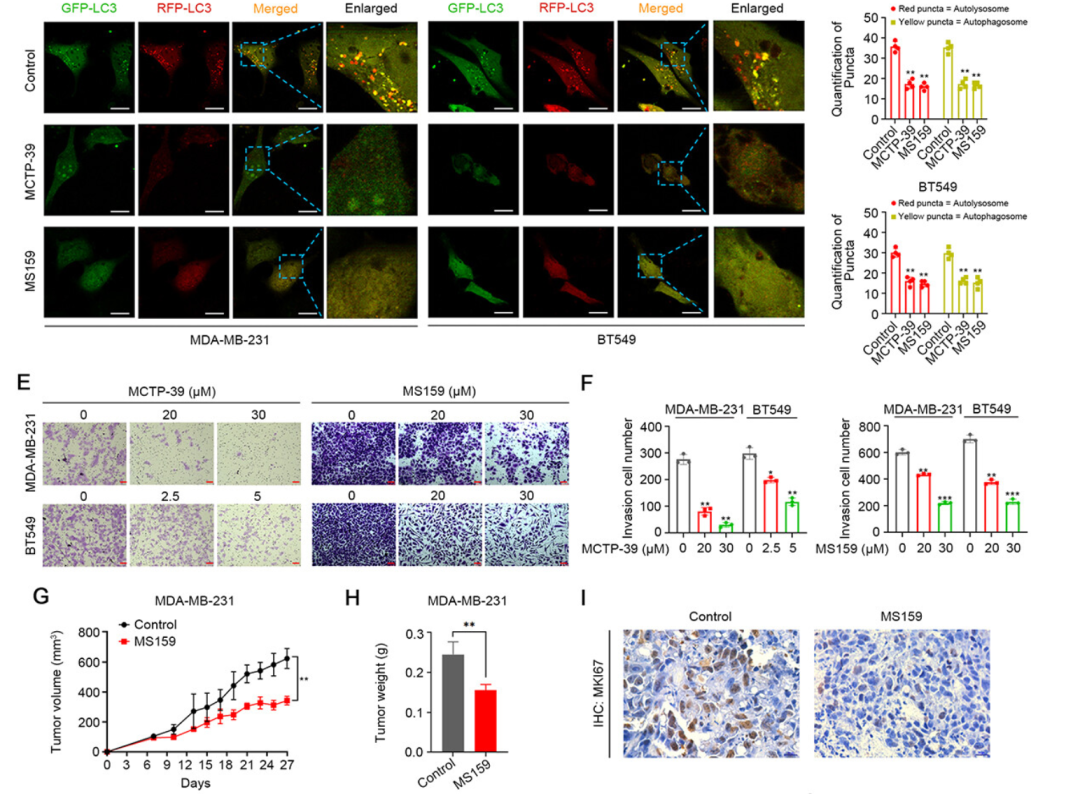
靶向NSD2抑制TNBC自噬、生长和转移(图片源自Autophagy)
越来越多的证据表明,表观遗传修饰(包括组蛋白修饰、DNA甲基化、染色质重塑和非编码RNA表达)的失调与各种恶性肿瘤的发生和发展密切相关。最近的证据揭示了组蛋白修饰在从肿瘤起始到TNBC远处转移过程中的潜在影响。参与TNBC进展的一个重要组蛋白修饰是组蛋白甲基化,它由组蛋白甲基转移酶(HMTs)和组蛋白去甲基化酶(HDMs)调节,这些酶分别在组蛋白H3和H4的赖氨酸和精氨酸残基上添加或去除甲基基团。异常的组蛋白甲基化和去甲基化在TNBC进展中发挥着多种作用,并导致TNBC患者的生存率降低。
NSD2(核受体结合SET结构域蛋白2)/WHSC1/MMSET是一种含有SET结构域的组蛋白甲基转移酶,可催化组蛋白H3的第36位赖氨酸的双甲基化(H3K36me2)。H3K36me2的广泛分布与一系列基因的活跃转录相关。NSD2的功能对于早期哺乳动物发育至关重要。近年来,发现NSD2在多发性骨髓瘤、结肠癌、前列腺癌和肺癌中过度表达。越来越多的证据表明NSD2与多种实体肿瘤的发病机理有关。例如,NSD2通过甲基化和激活结肠癌中的STAT3蛋白来促进肿瘤血管生成。Li N等人报道,NSD2通过靶向前列腺癌中的MTORC2信号传导来增强癌症转移。然而,NSD2在TNBC进展中的生物学功能和潜在机制仍不清楚。
在本文中,作者证明了NSD2在TNBC细胞和组织中的表达显著上调。NSD2介导的H3K36me2激活ULK1转录,从而驱动自噬以加速体内外TNBC的进展。药理学抑制NSD2显著抑制TNBC中的自噬、生长和转移。作者的研究结果表明,靶向NSD2可能是TNBC患者的有前途的治疗策略。
原文链接:
https://doi.org/10.1080/15548627.2025.2479995

本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言
















#三阴性乳腺癌# #NSD2#
9