有明显癌症家族史的健康人应行遗传肿瘤相关多基因检测,5%检出致病性/可能致病性变异
2024-10-26 苏州绘真医学 苏州绘真医学 发表于上海
本研究对无在世患病亲属的健康受试者进行基因检测,发现致病性变异率约 5%,强调基因检测对高风险家庭的重要性,为遗传性癌症预防和治疗提供思路,讨论了检测的意义、挑战及未来方向。
由胚系突变引起的遗传性癌症综合征占所有癌症的5-10%。该基因突变的发现可能对药物治疗、个性化预防策略和级联检测产生深远影响。根据美国国家综合癌症网络(NCCN)和意大利肿瘤医学协会(AIOM)的指南,只有在患者无法获得的情况下,未患病的家庭成员才应接受检测。本文探讨了即使在缺少在世患病亲属的情况下,是否仍可以为高风险家庭提供遗传性癌症相关的胚系基因检测。2017年至2023年,对103名健康受试者进行了回顾性研究。研究者纳入了至少有两名一级或二级亲属患乳腺癌、卵巢癌、胰腺癌、胃癌、前列腺癌或结直肠癌的所有受试者。采用二代测序(NGS)技术对所有受试者进行27个肿瘤相关基因的多基因panel检测。在研究人群中,发现致病性/可能致病性变异(PVs/LPVs)5个(约5%),意义未明变异(VUS)40个(42%)。这项研究强调了对有明显遗传性恶性肿瘤家族史的个体进行基因检测的重要性。这种方法将使检测结果呈阳性的个体能够根据其个人突变状态接受量身定制的治疗和预防策略。在个体化医疗时代,对无幸存的受影响亲属的健康人进行基因检测,对于早期诊断、临床监测和手术选择至关重要。
研究背景
遗传性癌症风险的基因检测越来越多地用于风险管理和治疗计划。事实上,已经确定的是,在癌症易感基因中发现有害突变的个体对患者及其家人具有临床意义。家族调查显示,在受影响个体的一级亲属(父母、兄弟姐妹和子女)和二级亲属(祖父母、阿姨或叔叔、孙辈、侄女或侄子)中,多种癌症类型的风险增加。这可能是由于亲代胚系细胞的致病性变异。20世纪90年代中期,BRCA1和BRCA2基因变异被发现,这些变异使个体面临较高的乳腺癌和卵巢癌风险。此外,通过遗传连锁分析、DNA测序和定位克隆技术,发现了与中危和低危相关的其他突变基因(图1)。当有与癌症遗传易感性相一致的个人或家族史时,通常需要进行基因检测。根据美国癌症协会(American Cancer Society)的指南,应建议对以下人群进行基因检测:(i)有特定类型癌症的强烈家族史;(ii)当其他因素表明可能有遗传易感性时被诊断为癌症(显著家族史,早发性癌症或罕见癌症,如男性乳腺癌);(iii)已知携带增加癌症风险的遗传基因突变患者的亲属。当患者有致病突变时,建议将一级亲属纳入分析,因为每个家族成员携带相同突变的概率为50%。特别是,对于旁系亲属患卵巢肿瘤或早发性乳腺癌、双侧疾病、男性乳腺癌、多种原发性肿瘤或与可能的遗传性疾病相关的其他恶性肿瘤(通常为常染色体显性)的未患癌症的个体,可建议进行基因检测。健康携带者可受益于风险管理策略,如乳腺癌和卵巢癌的筛查、化学预防和降低风险的预防性手术。国家和国际指南建议,只有在患病亲属不可获得的情况下,才应对未患病的家庭成员进行检测,并强调检测患病亲属比检测健康成员更能提供信息。只检查未患病个体而不检查患病家庭成员可能带来重大挑战。可能有必要对多个家系成员进行评估,因为一名未患病亲属无致病性变异并不排除其他家系成员可能存在致病性变异。为了准确地确定家族癌症的模式,分析家族的母系和父系是至关重要的。关键是要解决在解读检测结果方面的严重局限性,因为由于存在未知的显著性变异,大多数检测结果为阴性或不提供信息。因此,重要的是要强调,如果致病性突变不是遗传的,那么其发生风险与一般人群相似。在这种情况下,遗传咨询对于解释“无信息”结果的有限意义至关重要,治疗应关注其他危险因素,而不是检测结果。很少有研究对未患病的受试者进行基因检测,阳性携带者的百分比低于5%。例如,Trottier等人发现,在有乳腺癌或卵巢癌家族史的未患病女性中,有2.8%的BRCA1/2致病性变异。然而,近年来,多基因panel检测已成为在肿瘤易感基因高危人群中检测有临床意义变异的关键方法。目前的研究涉及约100名未患病的个体,仅根据他们家族的癌症病史进行选择,而没有一个患病的家族成员幸存。此外,研究者重点研究了基于二代测序(NGS)的包括BRCA1/2基因在内的27个基因的多基因panel的潜在影响(表1),旨在了解将分析扩展到更大的基因panel是否会导致携带癌症易感基因变异的健康受试者比例高于以往研究报道的比例。根据ENIGMA指南,基因变异被分为5类:良性(C1)、可能良性(C2)、意义未明变异(VUS,C3)、可能致病性(C4)和致病性(C5)。
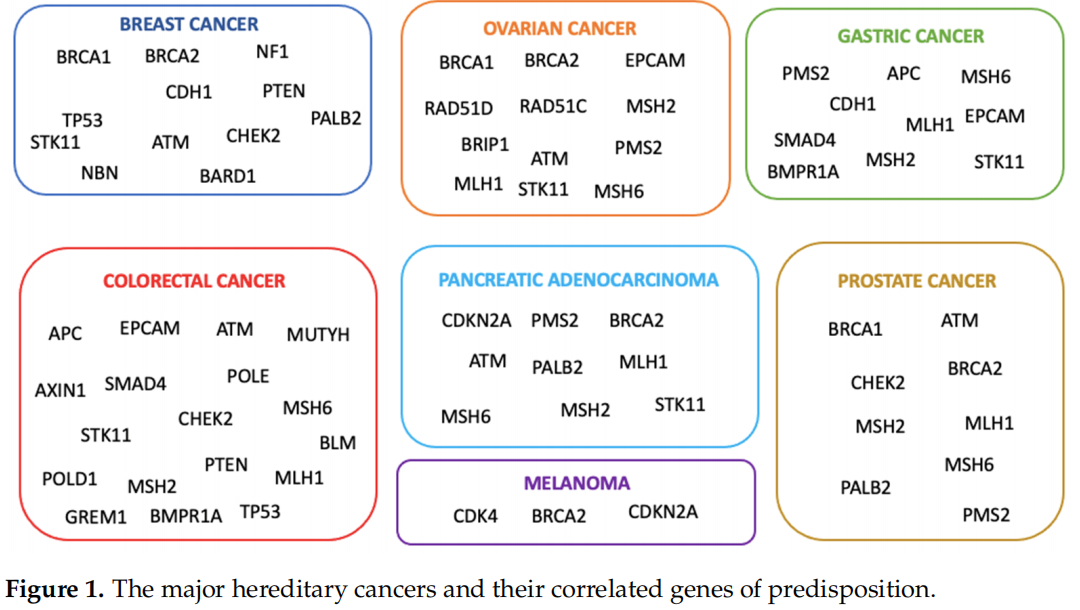
图1
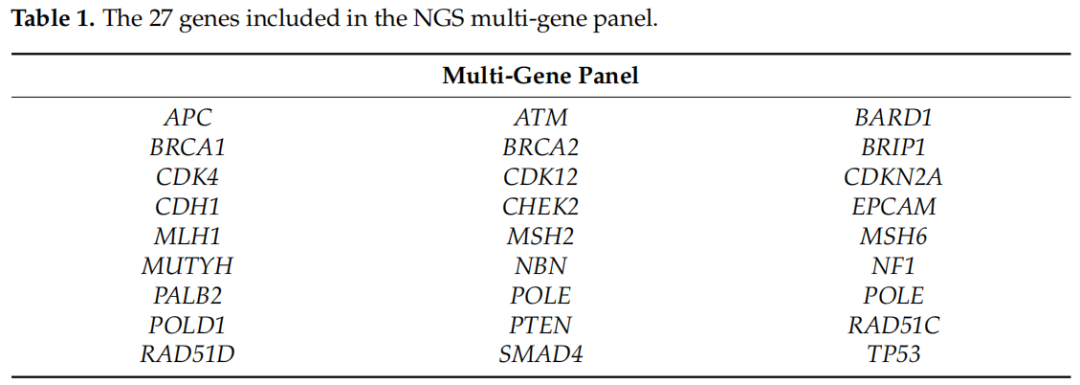
表1
研究结果
103名健康受试者(95名女性和8名男性)在检测咨询前报告有明显的遗传性癌症家族史,平均年龄为49岁(范围28 ~ 65岁)。研究人员对27个癌症易感基因panel进行了检测。致病性变异的发生率为5%。特别是,在发现的5个致病变异中,在BRCA1和BRCA2中检出2个,CHEK2、POLE和MUTYH中各检出1个(表3)。其中4名女性为阳性,只有1名男性的POLE基因有PV。所有致病变异均为杂合状态。在检测的103例未患病个体中,36例(35%)在18个不同的基因中携带VUS,包括ATM、BARD1、BRCA1、BRCA2、PALB2和CHEK2,共40个被归类为C3的变异。其余62例(60%)未检出有害变异,也未检出VUS。
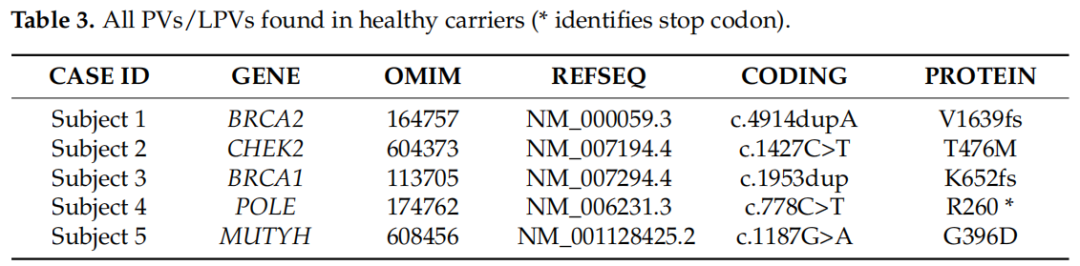
表3
与同源重组(HR)和相关家族史相关的基因变异:
这项研究揭示了健康受试者家族病史的两个关键方面。在许多案例中,家庭中的几名成员都患有同一种或不同类型的癌症,而在另一些案例中,至少有一名家庭成员在50岁前患了癌症。从研究受试者1的基因学分析开始,研究者发现了位于BRCA2基因第10号外显子的c.4914dupA致病性突变,该突变导致翻译移码,并带有预测的替代终止密码子(V1639fs)。该患者的家族史显示有3名亲属患病:母亲在65岁时患胃癌,外祖父在77岁时患结直肠癌,姨妈在37岁时患乳腺癌(图2),这些人在接受检测前咨询时均已死亡。
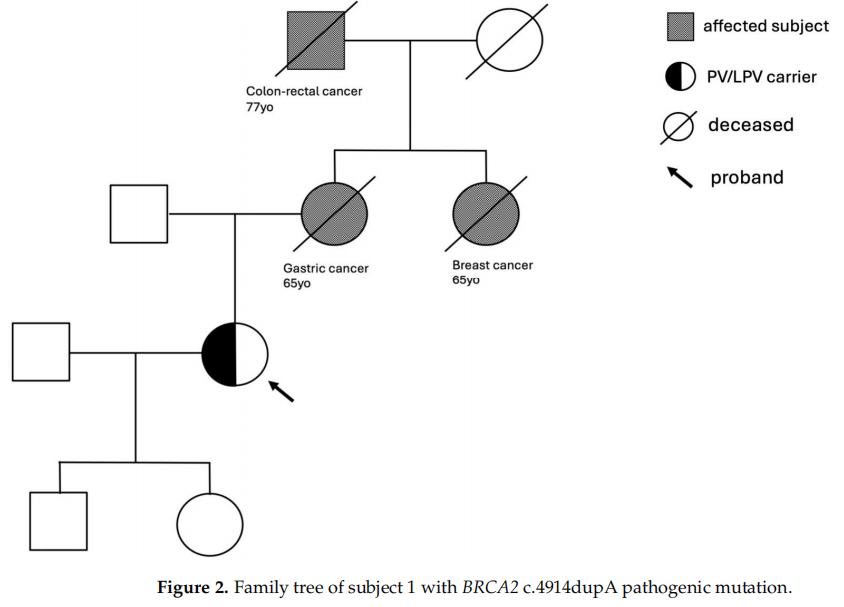
图2
受试者2显示CHEK2基因中存在c.1427C>T LPV,从而导致激酶活性降低或缺失和DNA损伤反应的损伤效应。该病例的家族史显示,69岁的祖母患卵巢癌,51岁的姨妈患卵巢癌。在其他病例中,研究者在两名家庭成员中发现了同样类型的癌症。
在咨询检测前期间,受试者3报告其姐姐和姑姑分别于54岁和58岁死于卵巢癌。在该患者中,基因检测证实了BRCA1基因的致病性突变,位于编码外显子9的c.1953dup,该突变是由核苷酸位置1953的鸟嘌呤复制引起,导致翻译移码,并有一个预测性替代终止密码子(K652fs)。
受试者4表现为POLE基因c.778C>T的致病性突变,该突变导致翻译提前停止信号,预计将导致蛋白产物缺失或中断的功能性缺失(R260*)。该家系中肿瘤明显存在,且多为不同类型,少数家系成员患同一类型的肿瘤。母亲在50岁时患卵巢癌,一级叔叔在55岁时患喉癌。父亲方面,父亲在70岁时患喉癌,随后又患结直肠癌。在其他家庭成员中登记的其他肿瘤包括一位姑姑和一位堂兄在55岁时罹患结直肠癌,一位一级叔父在55岁时罹患膀胱癌,一位父亲的堂兄在45岁时罹患喉癌(吸烟者),一位父亲的叔父在85岁时罹患肺癌,最后另一位堂兄在45岁时因脑癌去世(图3)。
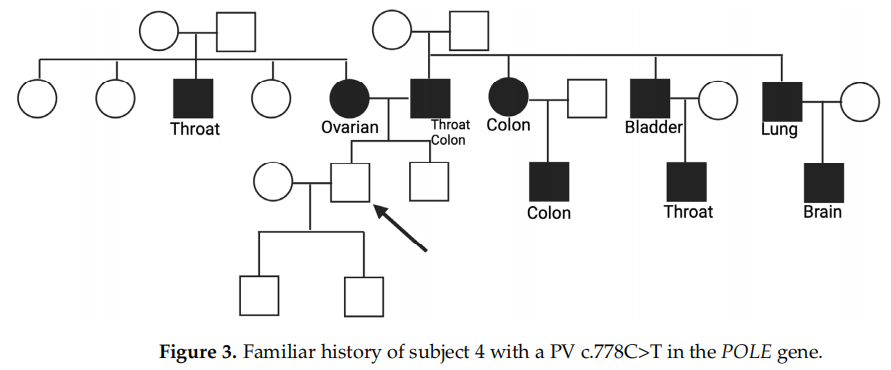
图3
与碱基切除修复(BER)和相关家族史相关的基因变异:
受试者5的父亲在41岁时被诊断为结直肠癌,一级姑母在47岁时被诊断为乳腺癌,一级姑父在45岁时被诊断为结直肠癌。在本例中,发现的PV是MUTYH基因的c.1187G>A,该基因位于编码外显子13,导致密码子396位的甘氨酸被天冬氨酸取代。在多个人群中,这种变异常被报告为始祖突变。M. Nielsen等人表明,这种错义变异改变了MUTYH蛋白的功能。
讨 论
近年来,已发现一些与遗传性癌症综合征相关的基因,并且至少有2%的推测性健康个体携带使其易患癌症的高外显性致病基因变异。患有遗传性癌症综合征的个体在其一生中有较高的罹患多原发癌的风险,或者可能在较年轻时罹患癌症。
早期突变检测和预防是管理遗传性癌症风险的关键,从而支持在该人群中实施针对性筛查和预防策略。在这方面,基因检测可能起到至关重要的作用。然而,根据国际和国家指南,当怀疑有家族易感性时,应对已经发病的家庭成员(指示病例)进行初步的基因检测。或者,当指示病例不愿意进行检测时,可以向在整个一生中有高突变概率(>10%)的健康亲属提供基因检测。本研究首次评估了在无受影响亲属存活的情况下,具有明显遗传性癌症家族史的健康受试者中是否存在致病性突变。作为纳入标准,患者至少有两名一级或二级亲属患乳腺癌、卵巢癌、胰腺癌、胃癌、前列腺癌或结直肠癌。在这一健康受试者人群中,发现与癌症高或中风险相关的基因的致病性突变发生率为5%。这一发现突显出我们有必要将基因检测扩展到具有提示家族史的健康个体,即使没有指示病例。特别是,本研究报告了两名先证者的家系(图2和图3),其中分别检测到BRCA2 c.4914dupA和POLE c.778C>T的致病性突变。在这两个案例中,不同类型的癌症都在描述的那几代人身上被发现。特别是,具有POLE突变的受试者4在母系和父系中都表现出显著的癌症史,因此强调了研究整个家族史以选择符合检测条件的研究对象的重要性。Magrin等人的一项研究报告了对已经存在遗传性癌症的癌症家族史的人群进行生胚系PVs/LPVs以及POLE基因检测的重要性。此外,法国遗传与癌症协作组(French Genetic and Cancer Group-Unicancer)推荐在多基因panel测中包括POLE和POLD1,以评估遗传性消化道癌症的易感性。这些结果表明,可以对目前健康受试者基因检测资格标准的改变进行评估。具体来说,研究者建议对具有以下家族史特征的健康受试者进行检测:(I)至少有两个一级亲属患以下癌症之一:乳腺癌、卵巢癌、胰腺癌、胃癌、前列腺癌和结直肠癌;(II)至少1名一级、二级或三级亲属患早发性肿瘤(<45岁);(III)至少有两名亲属患同一类型的癌症。此外,研究者建议在55岁之前进行检测,因为在临床实践中,有帮助的预防性筛查从25岁或癌症发生前10年开始,从最年轻的患病家族成员开始。NCCN肿瘤学临床实践指南提供了针对健康个体检测到的突变基因类型的具体建议和监测项目,如影像学检查方式、评估频率和降低风险的手术。这种前瞻性方法寻求在癌症的最早、最可治疗阶段诊断出癌症,或完全阻止其发展。此外,基因检测和发现与癌症风险升高相关的突变,不仅对将先证者纳入量身定制的监测项目至关重要,而且对健康的亲属也至关重要。一旦确定了家系突变,应将检测扩展到所有成员。这样就可以评估其可能的携带状态,并将其纳入监测和治疗项目。Di Rado等人最近的一项研究强调了在27个癌症易感基因中有PV/LPV的先证者的高危亲属中进行级联检测的重要性。亲属间的分离加强了已发现的变异与癌症易感性之间的关联。由于遗传性乳腺癌、卵巢癌、前列腺癌、黑色素瘤和胰腺癌的风险增加,致病突变携带者可从适当的风险管理和预防策略中获益。级联检测可以显著提高致病变异携带者的检出率,70%的先证者会告知家人,20%的先证者会接受基因检测,这可能会增加本研究发现的5%的致病变异。一定要强调的是,使用包括27个与遗传性癌症相关的基因的多基因panel,使研究者能够提高携带BRCA1和BRCA2以外基因突变的未患病个体的检出率。此外,研究指出,癌症风险评估不应仅基于是否存在低外显的致病性变异或危险因素变异。事实上,在Stolarova等人的研究中,他们评估了CHEK2基因的460个VUS,他们假设临床需要明确区分PVs和非PVs,因为它们可以改变携带者的临床管理。这项研究表明,CHEK2变异仅与BC风险有中度关联,但与所分析的其他肿瘤无关联。因此,如果没有多基因panel分析,相当大比例的突变将丢失。
从成本效益的角度来看,多基因panel的使用显著减少了分析的时间和成本。避免采用严格的标准选择具有家族史的健康患者进行NGS检测,可以使队列规模更大,降低NGS检测成本。此外,早期发现致病性突变和将健康人纳入监测项目可能会显著降低癌症相关的医疗成本。到目前为止,本研究在未患病个体中进行遗传性癌症检测的经验非常令人鼓舞。检测出突变的所有5个家族均允许女性根据自身突变状态做出降低手术风险的决策。有趣的是,本研究发现,女性更有可能要求进行基因检测,这可能是由于她们长期以来知道被确定为BRCA携带者的好处,而男性更有可能为自己的女儿参加检测。此外,40岁以下未受影响的个体更有可能要求检测前咨询预约。
根据这一观点,遗传咨询通过向人们提供有关其风险、可用的预防措施、化疗方案和其他治疗方案(如预防性手术)的信息,对分析过程做出了重要贡献。此外,遗传咨询是确定提示先证者家谱中存在突变的标准,以及决定考虑先证者是否适合接受检测的策略工具。在这些基础上,检测前咨询在解释“无信息”结果的有限意义方面的作用显得至关重要。遗传学家必须阐明中等外显基因突变与BRCA1/2突变在风险方面的差异。当然,多个家庭成员参与有关基因检测的决定可能会导致紧张和分歧。在未来,克服阻碍家庭之间有效沟通的社会和文化障碍将是至关重要的。此外,预测性基因检测的心理影响也不容忽视。由于罹患癌症的终身风险较高,了解突变状态会引起心理困扰,建议在遗传咨询前后时给予心理支持。挑战和未来方向应集中于支持家庭内沟通,以及改善专业人员和高危亲属之间的沟通过程。此外,影像学筛查、外科医生、妇科医生和“组学”方法应在识别遗传性癌症易感综合征预防的高危个体方面发挥关键作用。在将BRCA基因检测扩展到一般人群中的健康妇女的基础上,有可能勾勒出一个假设的场景。人群筛查还将减少与管理这些遗传综合征相关的总成本,抵消因增加基因检测而产生的额外成本。从临床实践的角度来看,需要制定策略来提高未患病个体的检测率。在这种情况下,最近有人提出,与临床医生收集的癌症家族史相比,使用网络工具可能会获得更高质量的癌症家族史收集,从而提高完成遗传咨询和检测的参与者百分比。
总之,本研究是第一个对高危家庭实施遗传性癌症基因panel检测的研究,为有突变的个体提供更明智的选择,以决定是否进行监测或降低风险的手术。这种方法在个体化癌症预防和早期检测的时代至关重要。尽管有局限性,但本研究结果提供了初步见解,可为未来研究提供基础。
参考文献:
Pilenzi, L.; Anaclerio, F.; Dell’Elice, A.; Minelli, M.; Giansante, R.; Cicirelli, M.; Tinari, N.; Grassadonia, A.; Pantalone, A.; Grossi, S.; et al. The Crucial Role of Hereditary Cancer Panel Testing in Unaffected Individuals with a Strong Family History of Cancer: A Retrospective Study of a Cohort of 103 Healthy Subjects. Cancers 2024, 16, 2327. https://doi.org/10.3390/cancers16132327

本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言


















#基因检测# #遗传性癌症#
43