26.4%的肉瘤患者基于基因检测结果修改诊断,有的甚至改变治疗方案!
2024-08-14 苏州绘真医学 苏州绘真医学 发表于上海
本研究强调了病理学专家在肉瘤诊断和治疗中的重要性,在特定病例中,分子方法也起到了辅助作用。
肉瘤是一组罕见的肿瘤,由100多种不同的实体组成。准确诊断对于最佳治疗至关重要。此外,相当大比例的肉瘤以特定的基因变异为特征。这项前瞻性、多中心、观察性研究由希腊肉瘤和罕见癌症小组(HGSRC)设计,旨在评估专家病理学审查结合分子方法检测基因变异对希腊肉瘤患者诊断和治疗的影响。基于靶向86个肉瘤基因融合的平台对所有样本进行了RNA下一代测序(NGS)。根据病理学专家的意见,还进行了额外的分子方法检测。因此,病理学专家根据组织病理学发现和必要时的分子检测提供最终诊断。
总共评估了122例患者的128份标本。在经非肉瘤病理学家初步诊断的119例病例中,肉瘤病理学家修改诊断37例(31.1%),导致治疗修改17例(14.2%)。在进行分子检测的110例病例中,通过基因检测结果诊断修改29例(26.4%),导致治疗修改12例(10.9%)。本研究强调了病理学专家在肉瘤诊断和治疗中的重要性,在特定病例中,分子方法也起到了辅助作用。
研究背景
肉瘤是一组罕见的软组织和骨肿瘤,其组织病理学、分子特征和临床行为具有显著的异质性。肉瘤约占儿童癌症的15%,占成人癌症的不到1%。2013年WHO软组织和骨肿瘤分类包含120多种亚型,而主要基于分子特征的进一步细化则产生了约170种不同的实体,包括恶性和中等恶性肿瘤。大多数亚型具有不同的组织学、分子和临床特征。基于此,2020年WHO软组织和骨肿瘤分类纳入了一些可以完全使用分子方法诊断的新实体,例如具有NTRK融合和BCOR变异的肉瘤。
肉瘤表现出广泛的基因变异,如涉及转录因子的染色体易位、复杂的染色体畸变、受体激酶配体的过度表达、调节蛋白的失活、基因突变和基因扩增。总共约有30%-40%的肉瘤以明确的反复基因变异为特征,这种变异是其发病机制之一。这些基因变异最初是使用传统的分子方法检测出来的,如聚合酶链式反应 (PCR) 和荧光原位杂交(FISH)。除了这些技术外,如今基因组测序也越来越多地用于确诊特定类型的肉瘤。
鉴于肉瘤的罕见性和异质性,其分类具有一定的复杂性。准确的诊断对于患者的治疗至关重要,以便采取针对组织学的治疗方法,正如肉瘤手术和全身治疗中所建议的那样,因此需要专业病理学家。许多研究表明,肉瘤的初步诊断和专家诊断之间的差异率高达50%,而病理学审查对治疗的影响很少被研究。这些研究主要在美国和欧洲进行,最近也有一些来自印度、澳大利亚和加拿大的报告。然而,他们的回顾性研究设计(除了法国的一项研究)导致选择偏差,因为只纳入了疑难病例。
此外,分子生物学是精确诊断已知存在基因变异亚型的有力工具。几项回顾性特定病例系列、少数包括不同肉瘤组织型的大型回顾性研究和一项在欧洲3个地区开展的基于人群的研究,都证明了分子方法在肉瘤诊断中的重要性。只有一项前瞻性研究调查了分子方法对6种肉瘤组织型诊断和管理的影响。
本前瞻性设计的研究重点是专业病理学审查以及分子分析在 2.5 年期间对希腊新发肉瘤病例的价值。为此,研究者使用了专门用于肉瘤诊断的内部NGS检测,并根据指征结合了传统的分子方法。研究者评估了专业病理学审查与分子诊断相结合对肉瘤患者管理的影响。
研究结果
患者特征:
2020年1月1日至2023年5月31日期间,本研究评估了122名患者的128个标本,其中包括75名男性(61.5%)和47名女性,来自9家公立医院中心和4家私立医院中心/诊所,构成了全分析集。其中6名患者的初始活检标本和手术标本均被纳入研究,共计128个标本。7名患者的8个标本被视为不合格,因为石蜡块从未送达或未经专业病理学家审查,并且未进行分子检测。因此,这些标本未纳入分析。入组时,患者的中位年龄为54岁(18-83 岁)。表2显示了基于初始组织学诊断的不同组织型的分布。在119例(93%)中,初始诊断是由非肉瘤病理学家做出的(初步诊断)。当初始病理学家考虑两个或两个以上的诊断时,表2中仅列出了最可能的诊断。脂肪细胞肿瘤(n=24)是最常见的诊断组,其次是分化不明的肿瘤(n=22)和成纤维细胞/肌纤维母细胞肿瘤(n=20)。在入组患者中,粘液样脂肪肉瘤和未分化多形性肉瘤(UPS)是最常见的组织类型,各有8例。软组织肉瘤占研究人群的绝大多数,只有6例(4.7%)为软骨骨肿瘤。
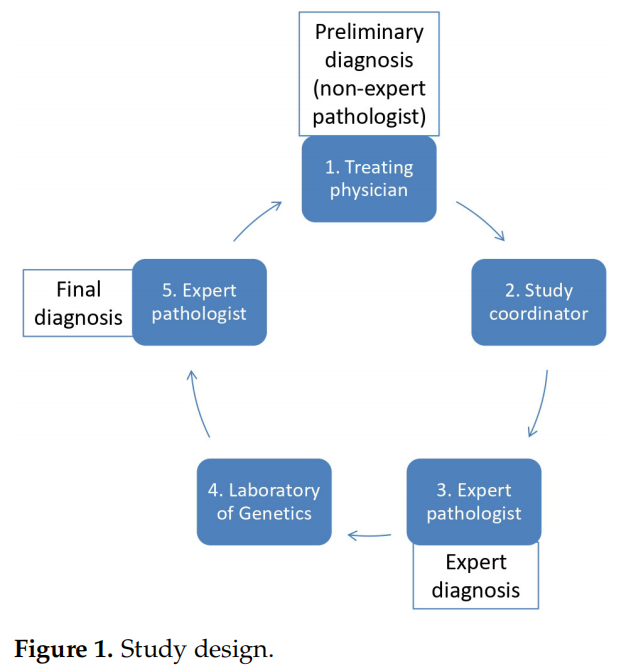
图1
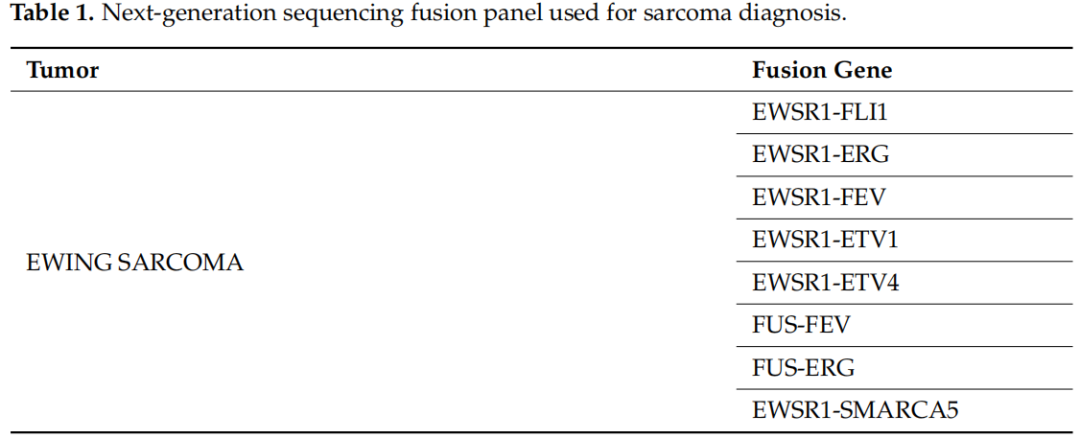

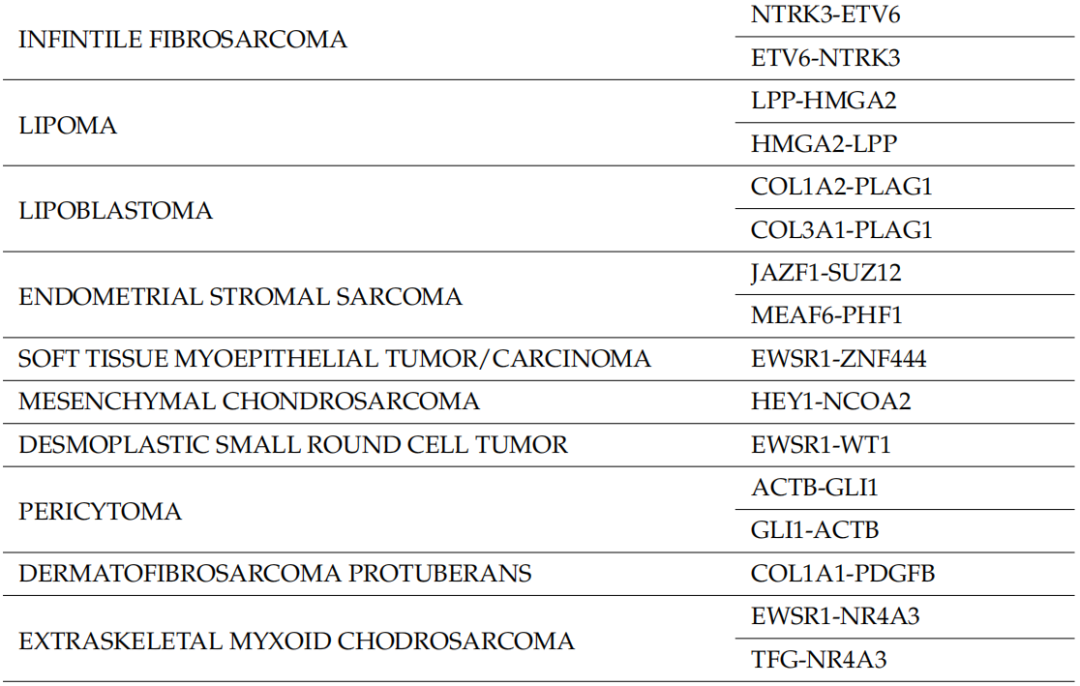

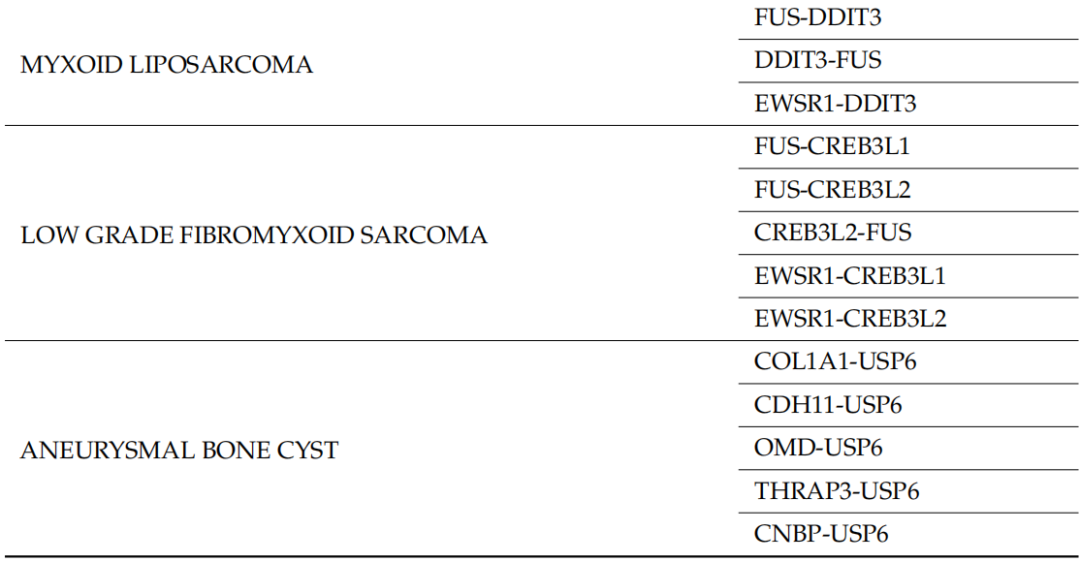
表1
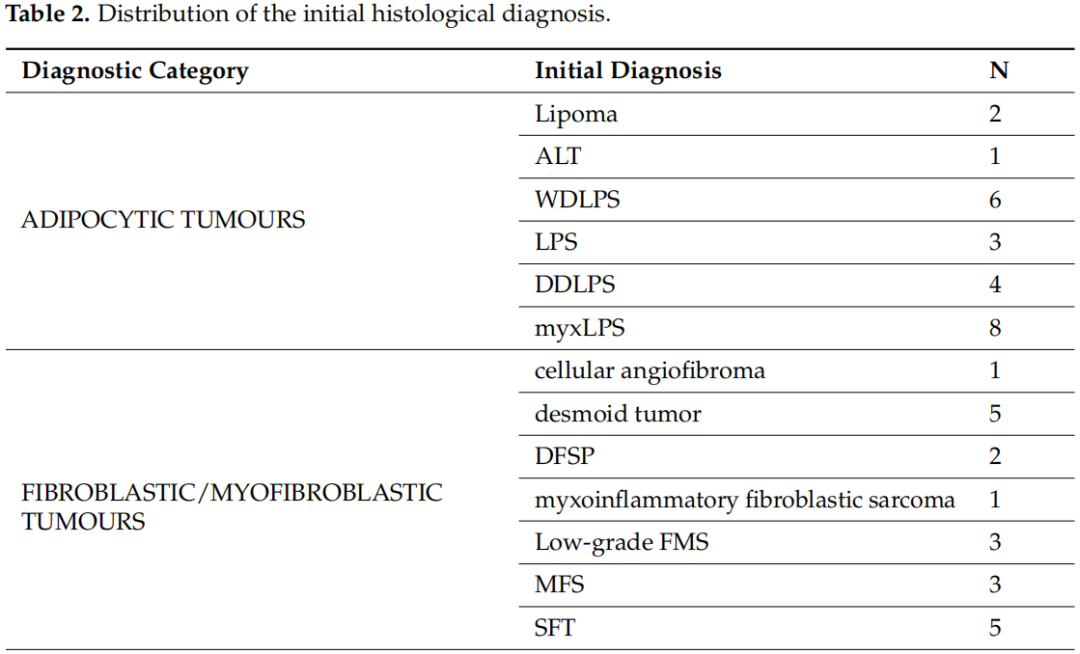
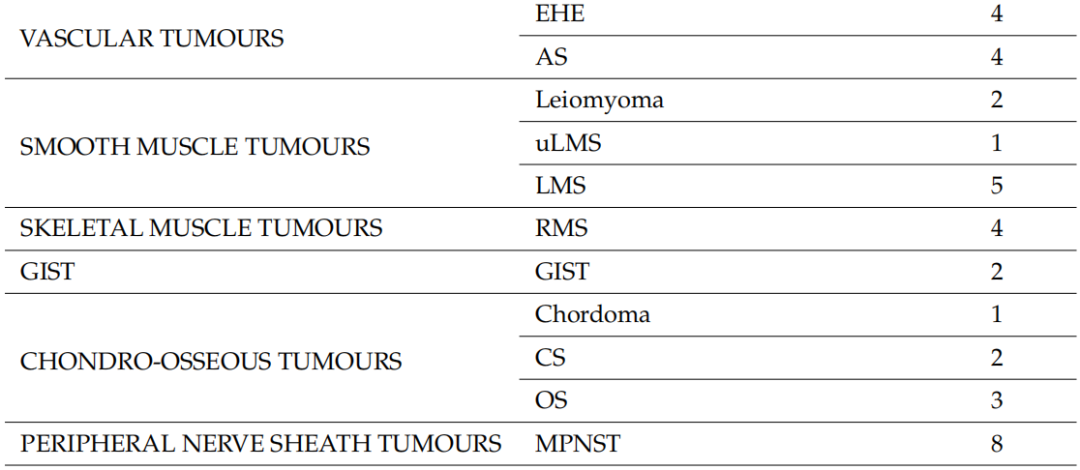
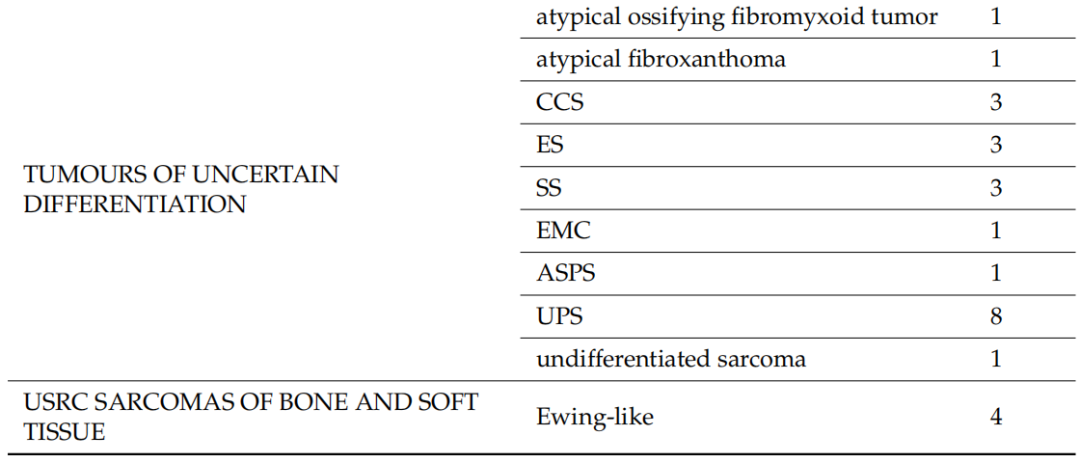
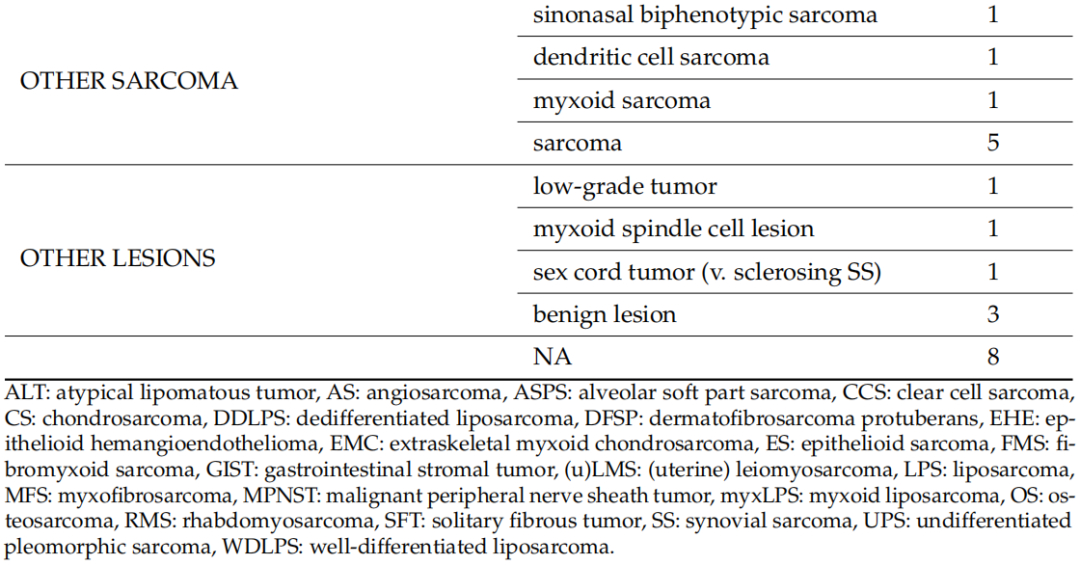
表2
48个(37.5%)患者样本是通过活检获得的,65个(46.1%)是通过手术切除原发肿瘤获得的,而其余15个则无法获得信息。如果已经进行了原发肿瘤的手术切除,则将根据辅助疗法对患者管理的最终调整进行评估。关于研究开始时的疾病分期,65个(50.8%)为局部性,18个(14.1%)为局部晚期,34个(26.6%)为转移性。另外9个肿瘤(7.0%)被认为是局部复发,而一名患者表现为多个良性病变。其余1例(0.8%)的分期未知。原发肿瘤位于下肢(n=46,35.9%)、躯干壁(n=23,18%)、内脏(n=11,8.6%)、上肢(n=12,9.4%)、腹膜后(n=10,7.8%)、头颈部(n=4,3.1%)、子宫(n=2,1.6%)或其他罕见部位(n=5,3.9%),如睾丸。10个(7.8%)肉瘤位于骨骼。其余3名患者(2.3%)的原发部位未知。
专家病理复核的效果:
在119例由非肉瘤病理学家初步诊断的病例中,38例存在轻微不一致(诊断均为结缔组织肿瘤但级别或亚型不同),18例存在严重不一致(误诊为肉瘤、最终诊断为良性病变或对治疗有非常重大的影响),其余63例完全一致(表3)。特别是,肉瘤病理学家对诊断进行了37次修改(31.1%)(表4),导致对治疗进行了17次修改(14.2%)。DDLPS(去分化脂肪肉瘤)是初始病理学家误诊最多的亚型。诊断修改的临床意义包括针对晚期疾病采用不同的化疗方案(n = 9)、避免辅助治疗(n = 4)、更广泛的手术切除(n = 2)、辅助放射治疗(n = 1)以及针对甲状腺癌转移而非原发性肉瘤的完全不同的治疗方法(n = 1)。

表3
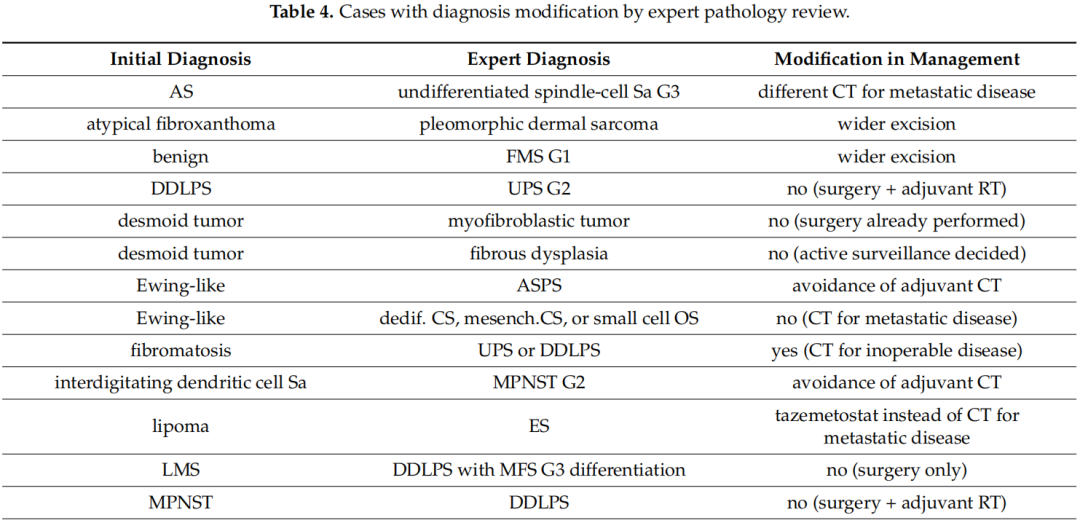
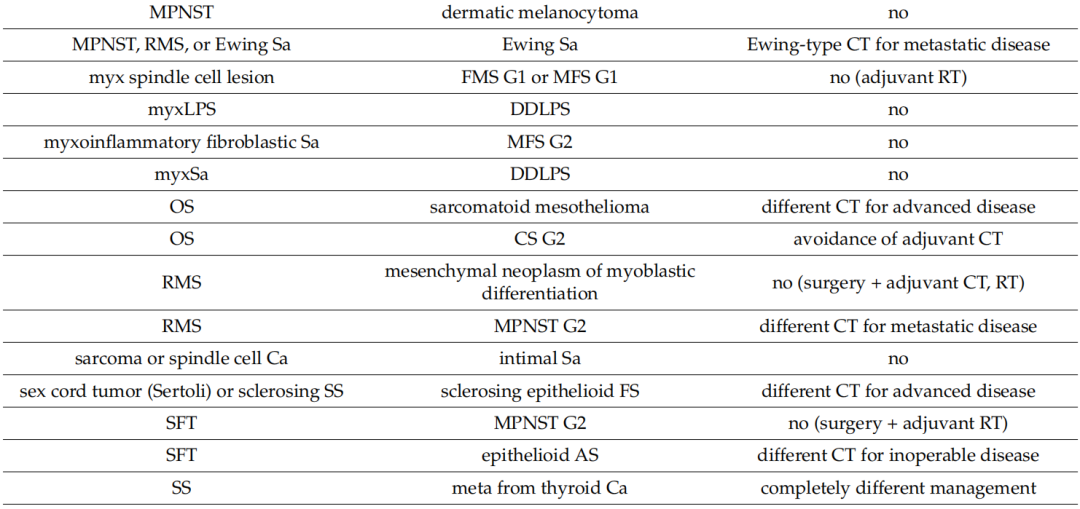
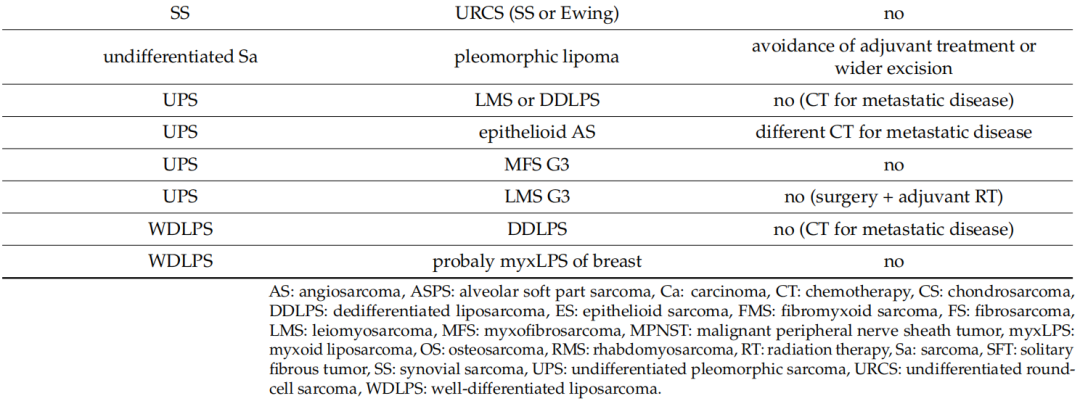
表4
此外,19 例(9.2%)患者的诊断得到改善,但未改变治疗方法。例如,3 例肿瘤最初被描述为脂肪肉瘤(LPS),最终被归类为DDLPS(n = 2)和粘液样LPS(n = 1)。另一例骨肉瘤被细分为骨外软骨母细胞性骨肉瘤。另外三例诊断为“肉瘤”和一例诊断为“低级别肿瘤”的病例被细分为粘液纤维肉瘤(MFS)(n = 3) 和恶性周围神经鞘瘤(MPNST) ( n = 1)。在其余病例中,肉瘤病理学家发现了其他特征,从而导致诊断细化,包括肿瘤级别和肉瘤细胞的形态。
分子检测的效果:
128个样本中,110个被送往基因学实验室进行分子检测,而其余18个样本由于物流问题从未送达。其中,51个样本通过手术切除获得,35个样本通过活检获得,而其余24个信息不可获得。大多数标本(n = 84)进行了特定的肉瘤NGS检测(RNA测序),显示1个无法评估的结果、14个阳性结果和69个阴性结果。在另外17个病例中,RNA样本量不足以进行NGS分析。最后,在9个病例中未进行 RNA NGS,在这些病例中病理学家选择了另一种分子检测(FISH用于检测MDM2扩增:n = 7,RT-PCR 用于检测CTTNB1突变:n = 1,DNA NGS 用于检测GNAS点突变:n = 1)。在11个样本中,除了NGS之外,还进行了第二种分子检测方法(FISH检测MDM2扩增:n = 4,FISH检测FUS-DDIT3融合:n = 1,RT-PCR检测BCOR重排:n = 4,DNA NGS panel检测KIT/PDGFRa点突变:n = 2)。NGS 阳性结果最常见的是尤文氏肉瘤/PNET中的EWSR1基因(n = 5)、粘液样LPS中的FUS基因(n = 4),其次是COL1A1(隆突性皮肤纤维肉瘤)、STAT6(孤立性纤维瘤)、NTRK3(NTRK重排肉瘤)、NR4A3(骨骼外粘液样软骨肉瘤)和USP6基因(结节性筋膜炎),这些基因各有一例。共14例患者进行了FISH检测(13例检测MDM2扩增,1例检测FUS-DDIT3融合),其中1例不可评估,9例阳性,4例阴性。其他分子检测(RT-PCR检测BCOR重排、CTTNB1突变,DNA NGS检测KIT/PDGFRa突变和GNAS突变)有2例阳性,6例阴性。
总体而言,研究者在110个检测样本中检测到25个(22.7%)存在基因变异,17个样本被认为不适合检测,另外2例结果被认为无法评估。在29名患者(26.4%)中,基因检测结果(阳性或阴性结果)改变了诊断(表5),导致12例患者的治疗方案发生变化(10.9%)。其中10例患者的分子检测是在活检标本上进行,19例患者是在手术标本上进行。初始鉴别诊断包括尤文氏肉瘤家族肿瘤的患者从分子方法中获益最多(n = 8),其次是初始诊断为脂肪细胞肿瘤的患者(n = 6)。分子基因学检测的临床效果涉及晚期疾病的不同治疗方案(n = 9)、不同的后续治疗(n = 2)和不同的辅助放射治疗决策(n = 1)。
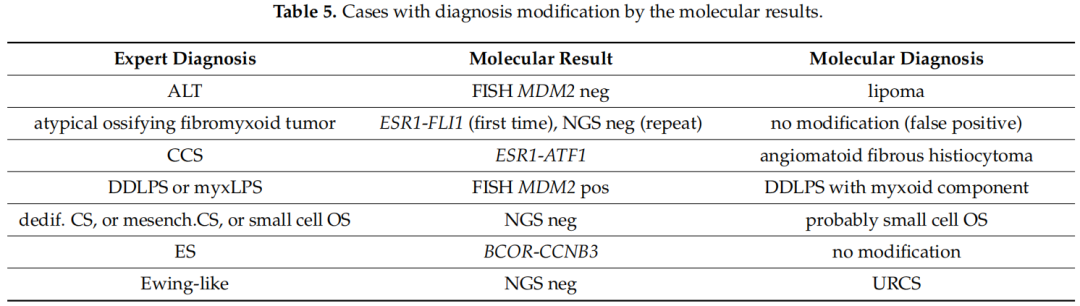

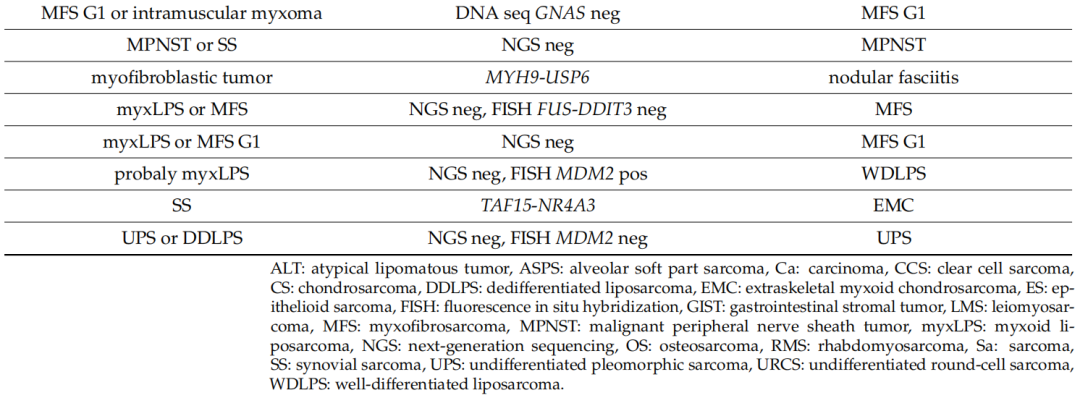
表5
讨 论
本研究评估了专家病理学审查和额外分子诊断对希腊一系列未经选择的软组织和骨肉瘤新病例的临床和治疗影响。本研究目的是前瞻性评估这两种干预措施对肉瘤诊断和管理的影响,而之前的研究主要是回顾性的,只关注诊断。研究发现专家评估导致30.3%的病例诊断改变,13.4%的病例治疗策略受到影响。这是自2018年成立HGSRC(一个全国性的肉瘤专家网络)以来,首次尝试系统审查希腊所有新发的肉瘤病例。从那时起,HGSRC就致力于管理肉瘤患者。
本研究结果与先前的报告一致。30多年前,人们就已经认识到第二意见在肉瘤诊断中的重要性。一项在欧洲3个地区进行的基于人群的研究回顾性分析了1463名肉瘤患者,结果显示,在集中专家病理学审查后,超过40%的病例的诊断发生了改变。美国一项对216例STS和骨肉瘤的较早研究报告了34%的不一致率。美国另一项研究报告的类似比率为37%。这些研究评估了对诊断准确性的影响,并报告了主要涉及组织学分级和亚型的不一致。在本研究中也观察到了这种情况,几个正确的初始诊断缺少组织学等级。日本的一项针对成人STS病例的研究表明,肉瘤病理学家的组织学分级具有高度有效性和可重复性。最近一项澳大利亚回顾性研究报告称,21.3%的肉瘤病例在外部评审后诊断发生变化,对6.6%的病例的治疗策略产生了影响。加拿大的一项研究表明,最初在普通解剖病理学服务中诊断的STS,在北美进行了10年的回顾,发现42.5%的病例部分一致,14.4%的病例完全不一致。瑞士肉瘤网络报告的一致性更高,为77.6%。
在本研究未经选择的肉瘤患者中,26.4%的分子诊断与病理诊断相矛盾。过去有几项回顾性研究评估了分子研究在肉瘤诊断中的贡献,并提到辅助分子测试(FISH、RT-PCR等),对诊断分类和临床管理的影响各不相同。在一项由国际专家肉瘤病理学家领导的研究中,由 FISH(对于大多数已知的肉瘤融合)组成的辅助分子检查(无论是否与靶向RNA测序相关)导致在选定的84例罕见、无法分类的间叶肿瘤系列中32%的诊断得到细化或修订。重要的是,在这项研究中,17%的肿瘤携带最近描述的基因变异,突显了肉瘤分子病理学不断发展的前景。只有6%的病例具有临床意义。法国肉瘤组报告了分子方法在肉瘤诊断和治疗中的临床效果的唯一前瞻性数据。事实上,在这项研究中,使用 FISH、比较基因组杂交、定量PCR或RT-PCR进行分子分析导致13.8%的病例组合诊断改变,其中包括六种已知基因变异的肉瘤类型。对70项研究的荟萃分析评估了分子分析在STS诊断和预测预后中的作用,结果表明,FISH检测MDM2扩增、RT-PCR检测SYT-SSX融合和CTNNB1突变分别对 WDLPS/DDLPS、滑膜肉瘤和纤维瘤有用。
传统分子方法,如FISH和PCR,在诊断改进中发挥着重要作用,WDLPS和DDLPS中MDM2扩增的例子就说明了这一点。过去十年,基于NGS的技术已成为检测特征性肉瘤融合转录本的强大诊断工具。锚定多重PCR已被证明可用于常规诊断。最近发表了几项关于通过NGS在肉瘤患者管理中实施全面基因组分析的回顾性研究,主要来自美国的综合癌症中心。Gounder等人报道通过NGS改进或重新分配了10.5%的肉瘤诊断。NGS技术的应用提高了肉瘤诊断水平,使中国STS患者的64个未分类样本中的15个得以分类。研究者最近在一项横跨多家欧洲机构的大型回顾性研究中发现,NGS的使用使9.1%的肉瘤患者的诊断发生了改变。基于分子方法的诊断改变的治疗相关性在文献中报道甚少,值得在前瞻性研究中进一步评估。重要的是,病理学家和临床医生都应该意识到并非所有肉瘤病例都适合进行 NGS/融合分析。在选择患者时,应认真考虑肉瘤的组织形态学。
在本研究中,携带基因变异的患者比例相对较小(22.7%),而STS的比例较高,约为40%。这可能是因为样本量相对较小以及纳入的组织型较少。分子方法对某些组织型的诊断价值已被证实,包括滑膜肉瘤、横纹肌肉瘤、透明细胞肉瘤和纤维瘤。在本队列中,这些组织型以及GIST(n = 2)的数量并不充足。此外,尽管对绝大多数样本进行了内部诊断NGS,但并非总是采用适合每个样本的分子方法。重要的是,在11例 DDLPS专家诊断病例中,有7例未进行FISH检测(其中1例样本不足,其余6例因组织原因)。同样,在2例纤维瘤样本中,有1例使用了RT-PCR检测CTNNB1突变。
最常见的诊断变更是DDLPS,被最初的病理学家误诊了。用于MDM2扩增检测的FISH是脂肪组织肿瘤分类的成熟工具。对于根据影像学和组织学标准可能与LPS相对应的腹膜后肿瘤或其他肿瘤,强烈建议进行此项分析。通过分子分析,发现腹膜后高级别UPS中有一亚组缺乏脂肪母细胞的组织学证据,结果是DDLPS。此外,对来自荷兰的331个LPS进行分子生物学分析导致大约25%的病例重新分类,这使研究者能够更好地区分有或无DDLPS的WDLPS与粘液样LPS和多形性LPS。这可能导致采用不同的治疗方法,包括使用放射疗法或药物。因此,阴性的MDM2结果可以区分脂肪瘤和WDLPS,在某些情况下可以避免不必要的更广泛的手术切除,就像本研究一位患者的情况一样。
检测尤文氏肉瘤家族肿瘤的特异性易位也是一项有价值的诊断工具。一旦确诊为尤文氏肉瘤,鉴于此类肿瘤的侵袭性及其对化疗的敏感性,需采用特殊的强化化疗方案。在本研究中,对于接受适当化疗方案治疗的患者,NGS可确诊为尤文氏肉瘤。相反,NGS可排除三名患者的尤文氏肉瘤诊断,这些患者最终被诊断为另一种肉瘤亚型,并接受相应治疗,避免了这种有毒的化疗。此外,三名患者最终被诊断为“未分化小圆细胞肉瘤”(USRC),这是一种新疾病,其最佳治疗策略尚待确定。值得注意的是,在过去几年中,已发现了此类肿瘤家族特有的新型易位,例如CIC-DUX4和BCOR重排。
分子方法对于GIST患者极为重要。几乎85%的GIST都会发生KIT或PDGFRα突变,这是一种诊断工具。然而,这些突变对临床医生来说发挥着更重要的作用,因为它们对治疗敏感性具有很高的预测价值;KIT外显子11突变比KIT外显子9突变预测对伊马替尼的敏感性更高。此外,这些突变还具有预后价值,PDGFRα基因外显子18突变预后比KIT外显子11突变的预后好,而 KIT外显子11突变的预后比KIT外显子9突变好。这些要素已被纳入GIST术后管理指南的流程中,涉及是否需要使用伊马替尼进行辅助治疗。
基因组学发现还可以为不同STS组织型的预后提供参考。例如,多项研究表明,与SYT-SSX2易位患者相比,SYT-SSX1易位的滑膜肉瘤预后较差,尽管其他一些研究尚未证实这一点。有必要开展临床试验,评估这些患者更密集的治疗方案。值得注意的是,已确定了67个基因表达特征,可预测局部肉瘤的临床结果,从而为辅助治疗的临床决策提供参考。
鉴于采用RNA NGS平台来检测最常见的肉瘤融合,因此本研究并非旨在探索肉瘤患者中临床可干预靶点的发生情况。尽管如此,ETV6-NTRK3基因融合的检测具有重要的治疗意义,因为研究者用 NTRK 抑制剂拉罗替尼代替细胞毒性化疗来治疗该患者。过去几年,NGS 也被用于检测肉瘤患者中可干预的变异。除GIST外,仅少数肉瘤含有可靶向的驱动基因变异,包括使用克唑替尼和其他TKI治疗的ALK融合IMT,使用伊马替尼治疗PDGFb融合隆突性皮肤纤维肉瘤(DFSP),以及使用CDK4/6抑制剂治疗CDK4扩增WDLPS和DDLPS。NTRK抑制剂是新型强效的组织不可知靶向药物,最近在针对含有NTRK重排的肿瘤的篮子试验中进行了评估。然而,NTRK融合在成人STS中的发生率极低,并且已经提出了用于检测的特定组织学标准。
总而言之,当具体病理诊断不确定或临床表现不常见时,NGS(或其他分子检测)主要推荐用于肉瘤诊断。此外,在怀疑已知组织型存在反复基因变异(如WDLPS/DDLPS、尤文氏肉瘤家族肿瘤或DFSP)的情况下,可以使用NGS检测这种高度特异性的诊断生物标志物并进行诊断改进。最后,如果结果可能具有预后或预测意义,则需要进行分子检测。对于具有可用靶向疗法的亚型,如NTRK重排肉瘤、伴有ALK融合的IMT和GIST,情况就是如此。
在进行这项试验时遇到了一些挑战。研究者注意到在获得最终病理报告(包括分子结果)方面存在一些重大延迟。因此,在某些情况下,临床医生在获得分子方法的结果之前就决定了治疗计划。17名患者的样本主要来自活检,不足以进行分子检测。活检不足是病理学家观察到的另一个挑战,阻碍了详尽的IHC检测。最后,由于分子发现与组织形态学不一致,EWSR1-FLI1检测的假阳性结果误导了临床医生和病理学家,直到NGS的重复。
鉴于这些肿瘤的罕见性和异质性,对肉瘤的精确诊断是为这些患者制定治疗策略的基石,并且需要专家进行病理学评估。许多肉瘤组织类型的分子发病机制已被严格确定。有越来越多的回顾性证据表明,在肉瘤的诊断准确性方面,基因变异的临床相关性,并具有潜在的治疗意义。法国肉瘤研究小组报告了在肉瘤治疗中实施分子方法的附加价值的前瞻性数据。在本研究中,研究者前瞻性地研究了专家病理学审查和分子生物学在肉瘤诊断和治疗中的贡献。研究者注意到初始诊断和专家诊断之间的不一致率为31.1%,对14.2%病例的临床治疗产生影响。26.4%的样本需要分子检测结果才能做出最终诊断。研究者得出结论,病理学专家评估是最佳肉瘤诊断和治疗的支柱,而病理学专家和多学科委员会要求的分子检测在某些情况下可能非常有用。
参考文献:
Kokkali S, Boukovinas I, de Bree E, Koumarianou A, Georgoulias V, Kyriazoglou A, Tsoukalas N, Memos N, Papanastassiou J, Stergioula A, et al. The Impact of Expert Pathology Review and Molecular Diagnostics on the Management of Sarcoma Patients: A Prospective Study of the Hellenic Group of Sarcomas and Rare Cancers. Cancers. 2024; 16(13):2314. https://doi.org/10.3390/cancers16132314

本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言


















#基因检测# #肉瘤#
49