重塑肠道生态系统:研究揭示多界微生物在肺动脉高压发病机制中的关键作用
2025-04-16 刘少飞 MedSci原创
这项研究为我们提供了一个令人兴奋的新视角——远离肺部的肠道,可能正是在肺动脉高压发生发展的早期扮演着“幕后操盘手”的角色。

2025年4月15日,一项开创性研究近日揭示,肠道微生态失衡不仅涉及细菌,还包括古菌与真菌在内的多界微生物,其失调状态可能在特发性肺动脉高压(IPAH)的发生发展中发挥重要作用。研究还表明,粪菌移植(FMT)有望成为肺动脉高压治疗的新策略。
肺动脉高压(PAH)是一种以肺小动脉重构和压力升高为特征的致命性心肺疾病,其病因复杂,治疗手段有限。近年来,肠道菌群作为远端器官疾病的“隐秘推手”受到广泛关注,已有研究表明细菌群落的失衡与PAH存在关联。然而,仅关注细菌显然已不足以全面揭示肠道微生态在PAH中的作用。
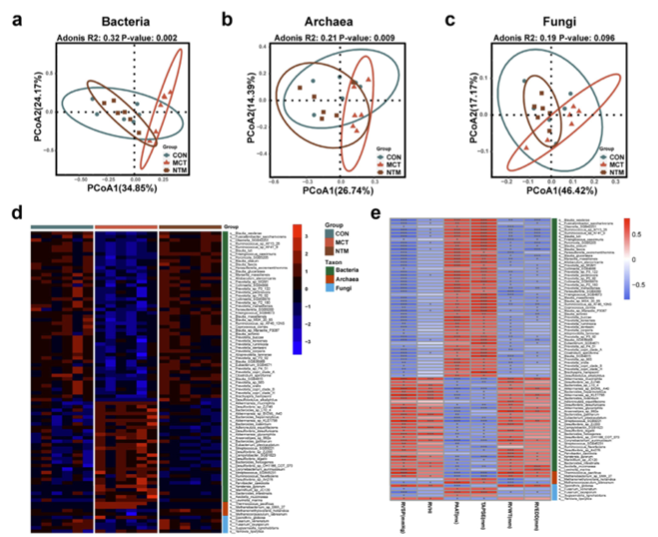
本研究团队采用宏基因组测序技术,对来自特发性肺动脉高压患者(IPAH)与健康对照者的肠道微生物群进行了全景式分析,涵盖细菌、古菌与真菌三大微生物界别。结果发现,IPAH患者的肠道微生物组成在多个层面发生显著改变,其中不仅细菌群落构成异常,古菌与真菌的多样性与丰度也表现出系统性偏移。
更为引人注目的是,研究人员通过粪菌移植(FMT)实验进一步验证了肠道菌群与PAH之间的因果联系。当将来自IPAH患者或单月桂酸毒素(MCT)诱导PAH模型大鼠的粪菌移植至正常大鼠肠道时,受体动物出现了典型的PAH表型,包括肺动脉压力升高和心室结构异常。相反,将健康大鼠的肠道菌群移植至MCT-PAH大鼠体内,显著改善了PAH症状,提示肠道菌群干预可能具有治疗潜力。
多组学分析进一步支持这一结论。RNA测序显示,FMT可影响多条与PAH相关的信号通路的基因表达。此外,FMT后受体动物的血浆代谢谱也向健康状态显著回归,表明肠道微生物可能通过调节宿主代谢参与PAH的发病过程。
值得一提的是,研究还构建了一个包含细菌、古菌和真菌的“多界生物标志物”诊断面板,在识别IPAH患者方面表现出比单一界别更高的准确性,为早期诊断提供了新思路。
研究负责人指出:“我们首次系统地揭示了多界肠道微生物与PAH之间的深层联系。过去我们主要关注的是细菌,其实肠道古菌和真菌在维持宿主免疫稳态与代谢平衡方面同样重要。这些发现为PAH的诊断和治疗开辟了新的可能路径。”
本研究突破了传统“细菌中心论”的限制,强调了一个更为复杂和动态的肠道生态系统对于肺血管健康的重要性。未来,基于微生态调控的精准医学手段,或将成为肺动脉高压治疗的有力补充。
随着FMT技术的逐步成熟和安全性提升,其在心肺疾病领域的应用也值得期待。但研究者也强调,这项技术仍处于早期阶段,大规模临床试验仍需进一步开展,以明确疗效和适用人群。
这项研究为我们提供了一个令人兴奋的新视角——远离肺部的肠道,可能正是在肺动脉高压发生发展的早期扮演着“幕后操盘手”的角色。
参考文献:
Chen Y, Chen Z, Liang L, Li J, Meng L, Yuan W, Xie B, Zhang X, Feng L, Jia Y, Fu Z, Su P, Tong Z, Zhong J, Liu X. Multi-kingdom gut microbiota dysbiosis is associated with the development of pulmonary arterial hypertension. EBioMedicine. 2025 Apr 11;115:105686. doi: 10.1016/j.ebiom.2025.105686. Epub ahead of print. PMID: 40220715.

本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言












#肺动脉高压# #肠道生态系统#
11