巨噬细胞代谢与肿瘤微环境:解码癌症治疗新靶点
2025-03-20 小药说药 小药说药 发表于陕西省
肿瘤相关巨噬细胞在肿瘤微环境中被肿瘤 “策反”,其代谢重编程成关键机制。TAM 在葡萄糖、脂质、氨基酸代谢方面呈现促癌特征,且具有异质性,靶向其代谢的药物开发正推进,有望实现精准免疫代谢治疗。
-01-
引言:当巨噬细胞成为肿瘤的“帮凶”
在肿瘤微环境(TME)中,肿瘤相关巨噬细胞(TAM)是数量最多的免疫细胞群之一。它们本应是抵御癌细胞的“卫士”,却被肿瘤“策反”,成为促进生长、转移和免疫抑制的关键推手。近年研究发现,TAM的代谢重编程是这一功能转变的核心机制。通过干预代谢通路,逆转TAM的促癌表型,正成为癌症治疗的新方向。
-02-
一、巨噬细胞与肿瘤微环境的“共生关系”
TAM通过分泌免疫抑制因子(如IL-10、TGF-β)、消耗关键氨基酸(精氨酸、色氨酸)、表达PD-L1等机制,直接抑制CD8+ T细胞的抗肿瘤功能(图1a)。同时,TAM释放的IL-6、IL-1β等促炎因子激活癌细胞的STAT3和MAPK通路,驱动肿瘤增殖与转移。
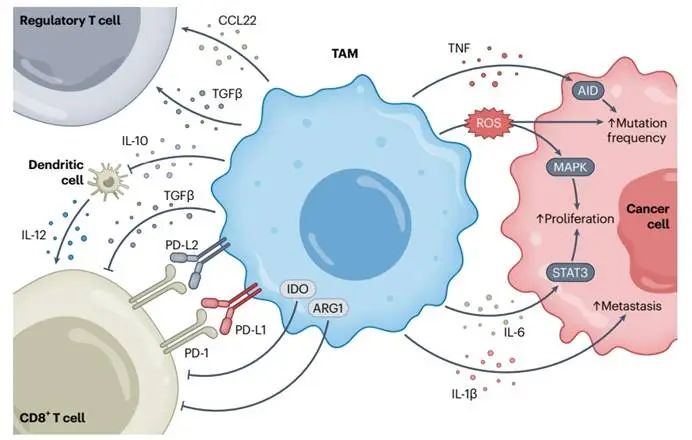
临床数据显示,肿瘤内TAM密度越高,患者预后越差。胰腺癌等高度纤维化的肿瘤中,TAM更通过与胶原互作,形成富含免疫抑制代谢物的“荒漠化”微环境,进一步削弱抗癌疗效。如何在代谢层面“重编程”TAM,成为破局的关键。
-03-
二. TAM的葡萄糖代谢
TAM在肿瘤微环境中表现出显著的葡萄糖代谢重编程,其主要特征及影响如下:
1.糖酵解主导的代谢模式
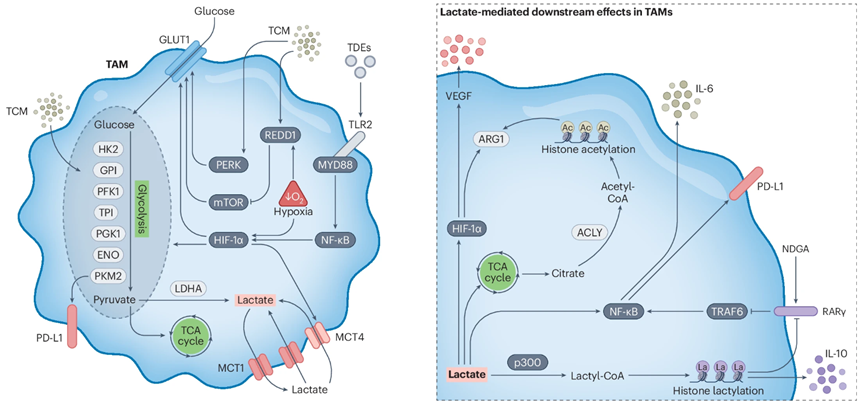
在结直肠癌等肿瘤中,TAM是微环境中单细胞水平的最大葡萄糖消耗者。它们偏好糖酵解而非氧化磷酸化(OXPHOS),即使在氧充足条件下仍以糖酵解为主。这通过上调己糖激酶II(HK2)、丙酮酸激酶M2(PKM2)和乳酸脱氢酶A(LDHA)等酶的表达实现。增强的糖酵解促进了促肿瘤功能,例如分泌成熟组织蛋白酶B,支持黑色素瘤和肺癌的转移与化疗抵抗。
2. 乳酸的关键作用
肿瘤细胞及TAM产生的乳酸通过多种机制稳定缺氧诱导因子-1α(HIF-1α),上调血管内皮生长因子(VEGF)和精氨酸酶1(ARG1),促进肿瘤进展和免疫抑制。乳酸还可转化为乙酰辅酶A,通过组蛋白乙酰化或直接乳酰化介导免疫抑制表型(如胶质母细胞瘤中IL-10高表达)。乳酸的积累还可通过抑制视黄酸受体γ(RARγ)驱动IL-6依赖的结直肠癌细胞生长。
3.微环境调节因子
肿瘤外泌体通过TLR2/NF-κB/HIF-1α通路增强葡萄糖转运体GLUT1表达,增加葡萄糖摄取并诱导PD-L1表达,形成远端转移前微环境的代谢重编程。
缺氧环境通过HIF-1α上调糖酵解酶,触发促血管生成和免疫抑制分子表达。
mTOR信号整合微环境中细胞因子与代谢物信号,调控糖酵解速率;REDD1等内源性抑制剂通过限制mTOR活性影响代谢表型。
4.代谢干预的复杂性
TAM的糖代谢改变可能通过营养竞争间接影响周围细胞。例如,抑制REDD1或谷氨酰胺合成酶(GS)可增强TAM糖酵解,减少内皮细胞葡萄糖利用,从而抑制转移,但也可能因促炎表型的激活而产生治疗矛盾。
-04-
三.TAM的脂质代谢
TAM在肿瘤微环境中的脂质代谢通过多种机制驱动其促肿瘤表型:
1.脂质摄取与积累
TAM通过CD36受体大量摄取肿瘤释放的游离脂肪酸(FFA),进行β-氧化(FAO)供能,维持抗炎表型,CD36的表达增加与TAM的促肿瘤功能相关。此外,癌细胞来源的细胞外囊泡(EVs)通过CD36被TAM摄取,为其FAO提供原料。TAM摄取的脂肪酸可以在细胞内积累形成脂滴,这一过程受到TREM2等受体的调节。脂滴的形成与TAM的免疫抑制表型有关。
2. 脂肪酸氧化(FAO)
TAM通过FAO途径将脂肪酸转化为能量,这一过程对于维持其促肿瘤表型至关重要,FAO产生的能量支持TAM的存活和功能。FAO途径的激活与TAM分泌的免疫抑制因子(如IL-10)有关,这些因子进一步削弱抗肿瘤免疫反应。
3.脂质代谢与肿瘤进展
TAM中的COX-2酶通过FAO产生的前体合成前列腺素PGE₂,PGE₂不仅促进肿瘤细胞的增殖和转移,还抑制T细胞活性。此外,肺癌细胞分泌GM-CSF激活TAM的PPARγ,促进脂肪酸和胆固醇释放以支持肿瘤代谢需求。TAM通过摄取胆固醇支持肿瘤细胞的生长,特别是在去势抵抗性前列腺癌中,TAM释放的胆固醇通过雄激素受体激活促进癌细胞增殖。
-05-
四.TAM的氨基酸代谢
TAM在肿瘤微环境中的氨基酸代谢调控对免疫抑制和肿瘤进展具有关键作用,主要涉及以下几种氨基酸代谢途径:
1. 精氨酸(Arginine)代谢:
TAM通过M2型极化依赖的精氨酸酶1(ARG1)将精氨酸分解为鸟氨酸和多胺,同时耗竭微环境中的精氨酸,抑制CD8⁺ T细胞功能。研究发现,胰腺癌等纤维化TME中,TAM通过ARG1介导的代谢重编程,抑制T细胞活性并促进肝转移。此外,胶原沉积和TGF-β信号通过机械代谢调控进一步加剧精氨酸代谢的免疫抑制效应。
2. 谷氨酰胺(Glutamine)代谢:
TAM与肿瘤细胞竞争谷氨酰胺。肿瘤细胞通过高表达GFPT2(谷氨酰胺代谢关键酶)抢夺谷氨酰胺,导致TAM线粒体分裂受阻、吞噬功能下降。 抑制谷氨酰胺代谢可增强TAM的糖酵解和促炎表型,同时促进抗肿瘤CD8⁺ T细胞活性。在临床前模型中,GS(谷氨酰胺合成酶)抑制剂通过抑制TAM的OXPHOS,减少血管生成并增强免疫治疗效果。
3. 色氨酸(Tryptophan)代谢:
TAM通过吲哚胺2,3-双加氧酶(TDO)将色氨酸降解为犬尿氨酸(kynurenine),激活芳烃受体(AhR),驱动免疫抑制功能。例如,IDH1突变胶质瘤通过分泌2-羟基戊二酸上调TDO,促进CD8⁺ T细胞耗竭。肠道菌群来源的色氨酸代谢物也可通过AhR增强TAM的免疫抑制,例如在胰腺癌中抑制抗肿瘤T细胞应答。
4. 丝氨酸(Serine)代谢:
TAM通过糖酵解旁路(3-磷酸甘油酸)合成丝氨酸,这一过程受PERK信号通路调控。内源性丝氨酸促进TAM线粒体功能,维持免疫抑制表型。例如,黑色素瘤中TAM的PERK激活增强丝氨酸合成,促进肿瘤生长。
-06-
五. TAM代谢的异质性
TAM的异质性源于其起源、空间分布、代谢特征及功能状态的动态调控。理解这种多样性对开发精准靶向策略(如局部纳米递药系统结合代谢干预)至关重要。
1. 空间异质性
在胶质母细胞瘤肿瘤核心缺氧区的巨噬细胞依赖糖酵解,高表达HIF-1α,分泌VEGF促血管生成;在乳腺癌肿瘤浸润边缘的巨噬细胞倾向氧化磷酸化(OXPHOS),具有更强的免疫调节功能;在胰腺癌模型的纤维化区域,胶原沉积通过TGF-β信号激活ARG1,驱动精氨酸代谢抑制CD8⁺ T细胞。
2. 代谢异质性
在结直肠癌TAM是单细胞水平的顶级葡萄糖消耗者,而肝癌TAM通过乳酸诱导组蛋白乳酰化驱动免疫抑制;乳腺癌TAM以依赖CD36摄取脂肪酸为主,而前列腺癌TAM通过TREM2调控胆固醇外排支持癌细胞增殖;IDH突变型胶质瘤中TAM通过AhR激活色氨酸代谢,而胰腺癌TAM通过ARG1耗竭精氨酸。
3. 功能异质性
单细胞测序揭示TAM的多个功能亚群:如促纤维化TARM(TREM2⁺)与脂滴形成相关,释放多胺促进肿瘤基质硬化(如胰腺癌、乳腺癌);免疫抑制M2样TAM(CD206⁺)通过IRG1-衣康酸通路抑制TNF-α(如肝癌、结直肠癌);炎症型TAM(STAT1⁺):在免疫治疗响应初期短暂出现,分泌IL-12激活抗肿瘤免疫(如黑色素瘤模型)。
-07-
靶向TAM代谢的药物开发
在肿瘤微环境中, TAM的代谢重编程是促进肿瘤生长和免疫抑制的重要因素。因此,靶向TAM代谢的药物开发已成为癌症治疗中的一个重要策略。
1. 谷氨酰胺代谢抑制剂
谷氨酰胺是肿瘤细胞和TAM的重要代谢底物,参与多种生物合成途径。通过抑制谷氨酰胺代谢,可以减少肿瘤细胞的生长并改变TAM的功能。JHU083 是一种 6-二氮杂-5-氧代-1-正亮氨酸(DON)的前药,经过酶切后释放活性成分,抑制谷氨酰胺代谢。DRP-104(sirpiglenastat)也是一种谷氨酰胺代谢抑制剂,目前正在临床试验中。
2. 糖代谢调控
TAM 在肿瘤微环境中倾向于糖酵解,而不是氧化磷酸化。通过调节糖代谢,可以改变TAM的免疫抑制特性。TEPP-46 可以防止 PKM2 结合到 Cd274 启动子上,从而减少 TAM 中的 PD-L1 表达,相关的临床试验正在进行中(NCT04328740 )。
3. 脂质代谢干预
TAM 通过摄取肿瘤细胞释放的游离脂肪酸进行脂肪酸氧化(FAO),这一过程与 TAM 的促肿瘤功能相关。TREM2 抑制剂和 DGAT 抑制剂可以抑制 TAM 的脂滴形成和脂肪酸储存,从而改变其代谢和功能。TREM2 抑制剂 PY314 正在进行临床试验(NCT04691375),以评估其对 TAM 的影响。
4. 免疫代谢调节剂
通过激活或抑制特定的免疫代谢通路,可以调节 TAM 的功能和表型。TLR7/8 激动剂(如 Resiquimod)和 TLR9 激动剂(如 SD-101)可以通过激活免疫细胞来改变 TAM 的代谢和功能。
-08-
结语
肿瘤微环境中的代谢暗战,既是癌症猖獗的“帮凶”,也蕴藏着治愈的密码。从“饿死癌细胞”到“免疫重编程”,代谢靶向治疗正带来范式变革。未来,随着单细胞技术与人工智能的融合,我们有望绘制出每个肿瘤的代谢图谱,真正实现精准免疫代谢治疗。
参考资料:
1.Linking macrophage metabolism to function in the tumor microenvironment. Nat Cancer.2025 Feb;6(2):239-252.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言















#代谢重编程# #肿瘤相关巨噬细胞#
10