哈工程杨飘萍教授团队《自然·通讯》:金属间化合物促进抗肿瘤免疫治疗新机制
2024-10-12 BioMed科技 BioMed科技 发表于上海
哈尔滨工程大学材料科学与化学工程学院冯莉莉副教授、杨飘萍教授团队与哈尔滨医科大学附属肿瘤医院周洋教授团队合作构建了一种金属间化合物纳米药物,结合了焦亡、双硫死亡进而引发免疫实现有效的肿瘤治疗。
癌症已成为全球主要死亡原因之一,并且表现出从老年人向中年人的转变,尤其是在50岁以下成年人中占据主导地位。癌细胞通过代谢重编程和基因突变,表现出升高的氧化应激特征,这为开发有效的癌症治疗方法提供了机会。然而,癌细胞倾向于维持足够的谷胱甘肽(GSH)水平以中和过量的活性氧(ROS),从而实现细胞的存活和增殖。因此,阻断GSH的合成有望最大化癌症细胞死亡。
半胱氨酸是GSH生物合成的关键氨基酸。在癌细胞中,SLC7A11蛋白过表达,能够引入细胞外胱氨酸,并在细胞质中还原为半胱氨酸,进而合成GSH。抑制NADPH供应可能导致胱氨酸积累和GSH减少,同时胱氨酸超载可引发二硫键应激,导致肌动蛋白细胞骨架蛋白结构异常。
此外,肿瘤微环境的微酸性和过氧化氢(H2O2)的过表达为纳米催化剂催化产生ROS创造了有利条件。由两种或多种金属元素组成的金属间化合物因其调谐的电子态和协同效应,表现出优异的催化活性。这些化合物具有明确的化学计量比和晶体结构,确保了活性位点的均匀性,从而大量产生ROS,具有增强的催化活性和稳定性。
ROS在诱导免疫原性程序性细胞死亡中起决定性作用,可以引发强烈的抗肿瘤免疫反应。焦亡是一种炎性细胞死亡,特征是Caspase-1激活和GSDMD切割,导致细胞膜破裂,释放促炎因子和肿瘤抗原,促进T细胞激活和浸润,重塑肿瘤免疫抑制微环境。因此,探索在肿瘤微环境中放大氧化应激和同步放大免疫反应的策略,为癌症治疗提供了独特方向。
近日,哈尔滨工程大学材料科学与化学工程学院冯莉莉副教授、杨飘萍教授团队与哈尔滨医科大学附属肿瘤医院周洋教授团队合作构建了一种金属间化合物纳米药物,结合了焦亡、双硫死亡进而引发免疫实现有效的肿瘤治疗(图1)。相关成果以“Intermetallics triggering pyroptosis and disulfidptosis in cancer cells promote anti-tumor immunity”为题发表在Nature子刊(Nature Communications)上。
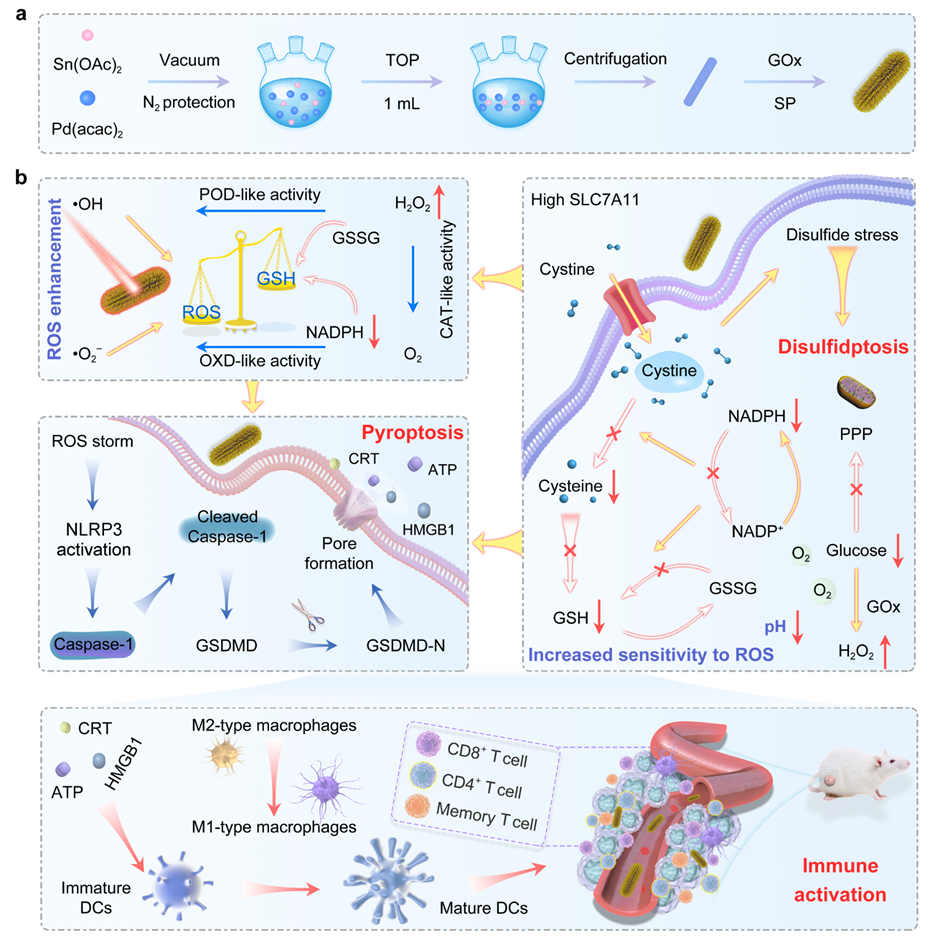
图1 纳米复合材料合成步骤和诱导焦亡和双硫死亡协同治疗过程的示意图
首先,研究团队构建了多种不同形貌的金属间化合物(纳米棒、纳米点),该金属间化合物显示出良好的生物相容性和高效的活性氧产生效果,可以有效的抑制肿瘤生长。TEM图像显示其形貌均匀,具有良好的结晶度,XPS分析确认了Pd 3d和Sn 3d的存在(图2)。该金属间化合物与葡萄糖氧化酶复合后,多种催化活性相互促进,展现出卓越的抗肿瘤效果。
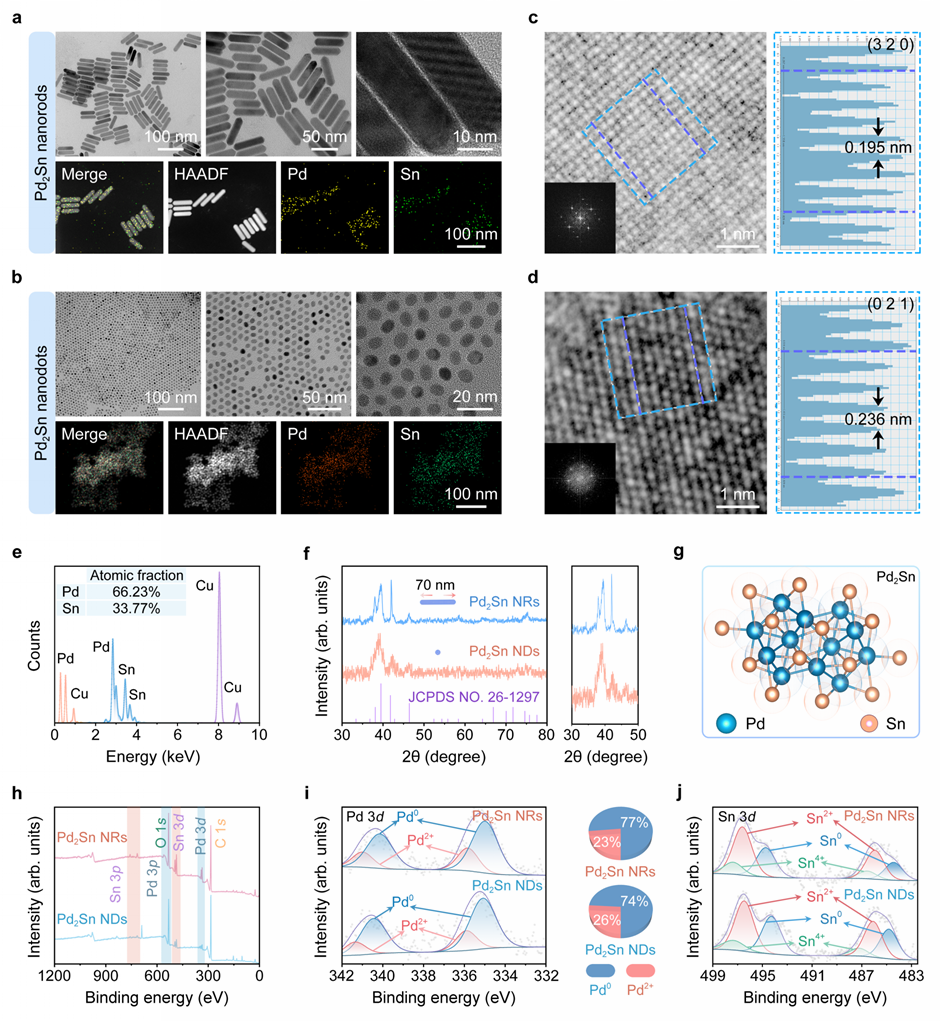
图2 Pd2Sn金属间化合物结构以及组成表征
体外细胞实验表明,该纳米复合材料可以有效诱导癌细胞损伤,增加细胞内Caspase-1以及GSDMD的表达,引起细胞焦亡。同时,细胞内葡萄糖的消耗增加了NADP+/NADPH比值,导致胱氨酸在SLC7A11高表达的肿瘤细胞中大量积累,实现胱氨酸相关的双硫死亡。此外,由于焦亡与双硫死亡的协同作用,进一步诱导了树突细胞的成熟,有望实现肿瘤的免疫治疗(图3)。
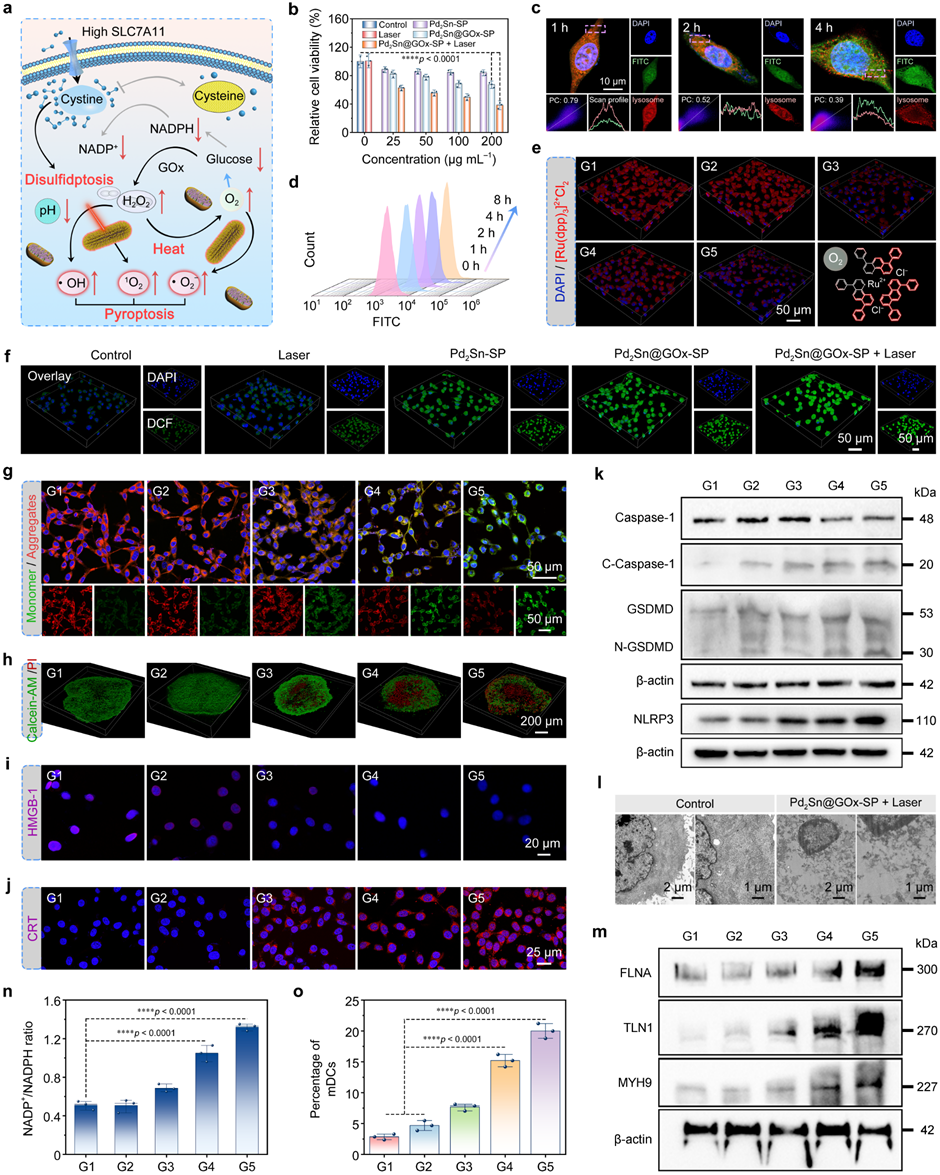
图3 体外增强的焦亡和双硫死亡
基于良好的体外癌细胞抑制效果,研究团队对该纳米复合材料的体内治疗效果进行了研究。研究发现该纳米复合材料具有良好的肿瘤抑制效果,抑制率为83.76%。同时,该纳米复合材料对体内正常器官没有明显的毒副作用,具有较高的生物安全性(图4)。
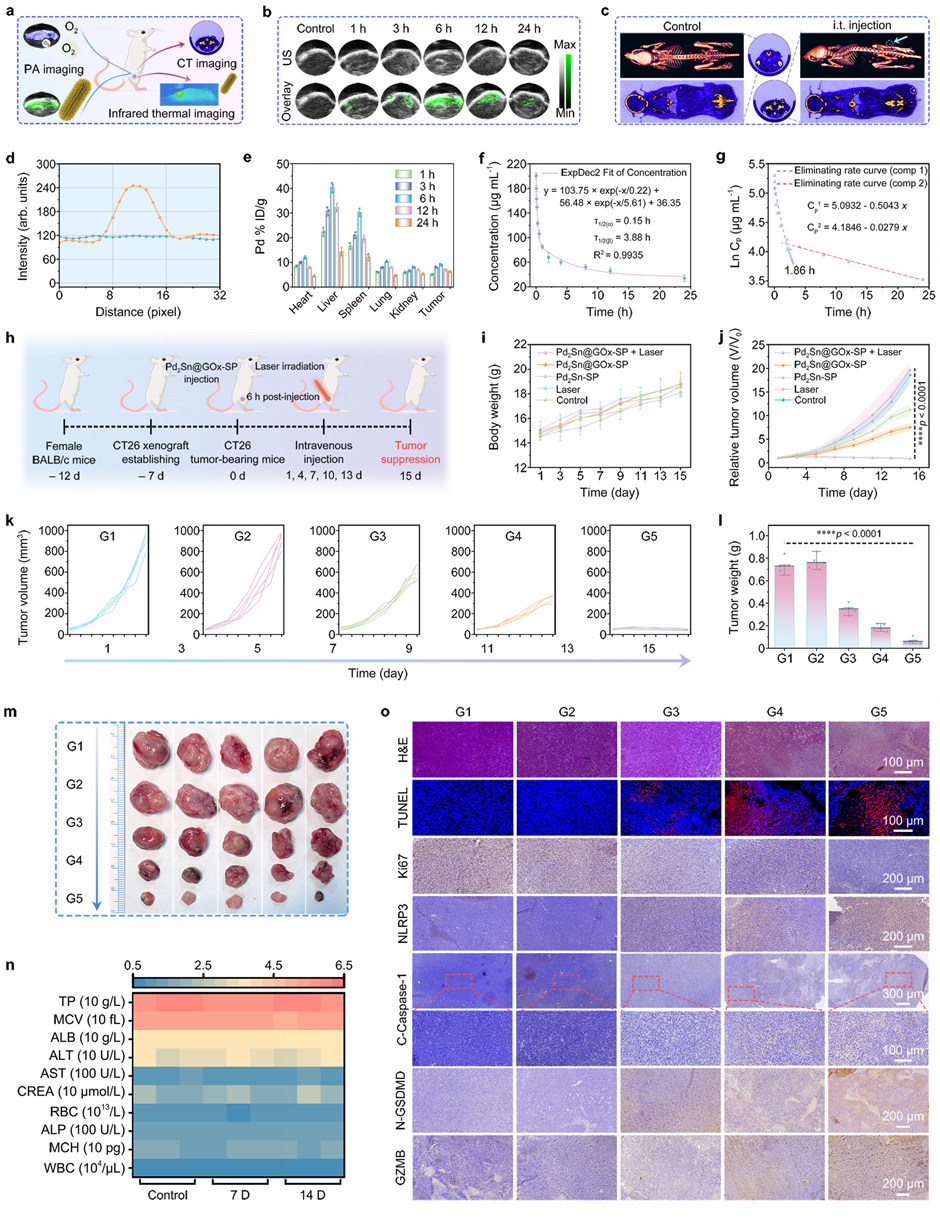
图4 体内PA/CT成像引导协同抗肿瘤治疗
肿瘤细胞焦亡诱导的细胞内容物释放已证明能触发有效的免疫反应,增强抗肿瘤免疫活性。研究发现,该纳米复合材料能够有效诱导脾脏树突状细胞的成熟,激活T细胞从而引发免疫反应。此外,IFN-γ水平在该组小鼠肿瘤中显著升高,表明CD8+ T细胞的有效激活,最终导致抗癌免疫的增强。在肿瘤中,CD8+T细胞增加了4.3倍,颗粒酶B的表达水平也显著上升,证实了抗癌免疫的激活。因此,该纳米复合材料能够有效诱导特异性的抗肿瘤免疫反应,促进免疫细胞的募集和激活,为癌症治疗提供了新的策略。
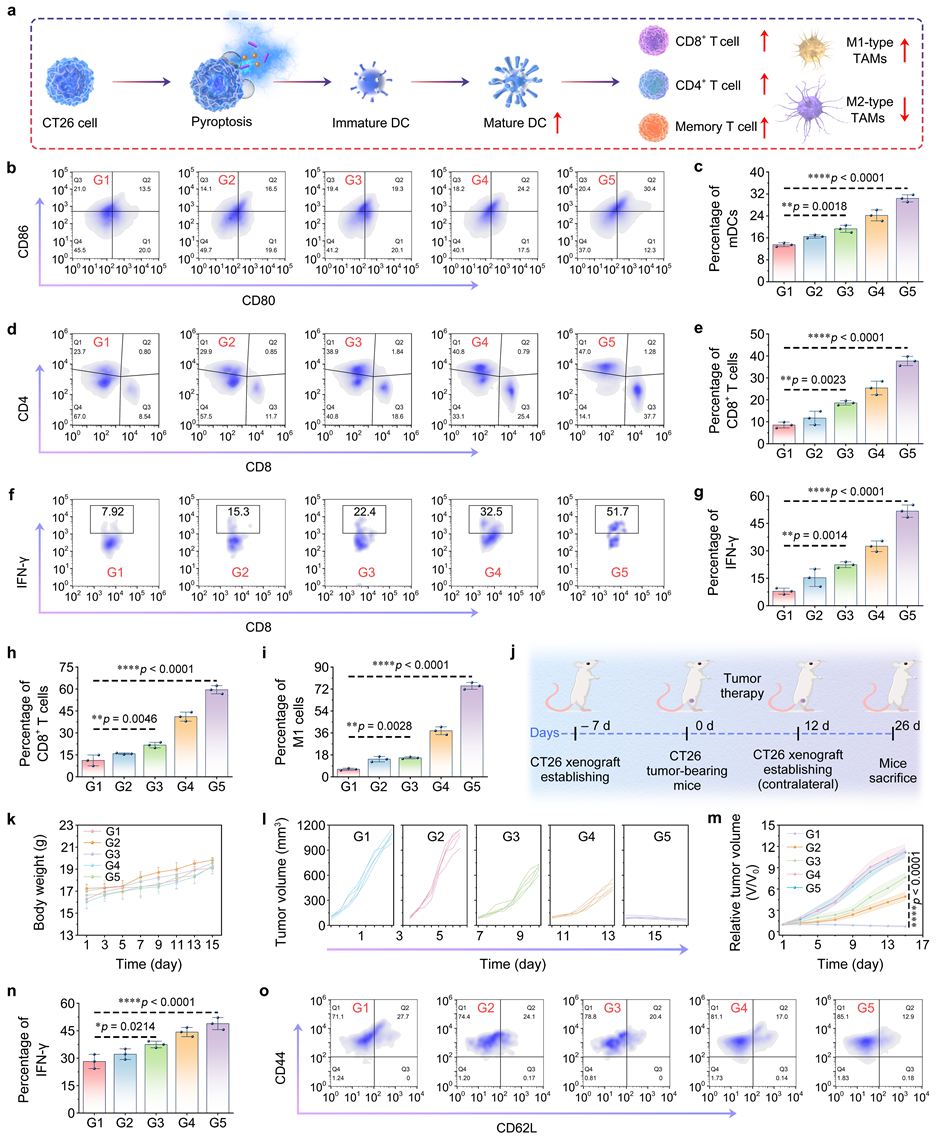
图5 Pd2Sn@GOx-SP的体内免疫刺激作用。
总而言之,作者成功设计并制造了具有均匀形貌的金属间化合物,与葡萄糖氧化酶复合之后显示出自增强的多种酶催化活性,实现了ROS的过量产生,有效诱导了肿瘤细胞的焦亡与双硫死亡。值得注意的是,该纳米复合材料诱导的焦亡与双硫死亡有效地重新编程了肿瘤微环境,缓解了免疫抑制,促进了T细胞浸润,进而增强了T细胞介导的抗肿瘤免疫反应,有效的抑制肿瘤转移与复发。这项工作不仅为成像引导的焦亡和双硫死亡的双诱导剂设计提供了策略,而且拓宽了金属间化合物的生物医学应用,为癌症免疫治疗的未来发展提供了坚实的基础。
参考文献:
Zhu, Y., Wang, X., Feng, L. et al. Intermetallics triggering pyroptosis and disulfidptosis in cancer cells promote anti-tumor immunity. Nat Commun 15, 8696 (2024). https://doi.org/10.1038/s41467-024-53135-2
原文链接:
https://www.nature.com/articles/s41467-024-53135-2
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言

















#抗肿瘤免疫# #金属间化合物#
0