LUNGCA研究更新:四川大学华西医院刘伦旭教授团队联合臻和等多家单位揭示:动态ctDNA指导NSCLC患者术后全程精准管理
2025-04-08 测序中国 测序中国
本研究证实了ctDNA检测在NSCLC患者手术后复发监测、辅助治疗决策、疗效评估及复发后生存预测中的重要临床价值。
肺癌是全球及我国病死率排名第一的恶性肿瘤,约占全球癌症死亡人数18.7%[1]。手术切除是局部非小细胞肺癌(NSCLC)最重要的治疗方法,但仍有很多患者在手术后5年内出现局部复发或远处转移。近年来,已有一些研究报道,基于循环肿瘤DNA(ctDNA)测序可应用于分子残留病灶(molecular residual disease,MRD)检测,可辅助识别肺癌术后复发高风险的患者并提前影像学发现肿瘤复发。但MRD检测的最佳ctDNA监测期和影响MRD检测因素尚未阐明,肺癌患者术后ctDNA检测是否有助于辅助治疗方案的决策,以及辅助治疗前后的ctDNA变化是否与治疗效果相关还需要更多研究,ctDNA检测在疾病复发后的预后价值有待明确。需要大规模多中心前瞻性研究数据来证实。
2021年Clinical Cancer Research杂志发表了由四川大学华西医院刘伦旭教授团队联合四川省人民医院、成都上锦南府医院、臻和科技合作的研究成果“Perioperative ctDNA-based Molecular Residual Disease Detection for Non-Small Cell Lung Cancer: A Prospective Multicenter Cohort Study (LUNGCA-1)”[2]。LUNGCA研究是刘伦旭教授团队牵头发起的大规模多中心前瞻性肺癌预后分子标志物的研究,LUNGCA-1为该研究围术期部分,揭示了围术期ctDNA能有效预测NSCLC患者术后复发,识别高复发患者,可作为NSCLC患者术后早期检测MRD的可靠指标。
继2021年Clin Cancer Res之后,2025年3月,专注于肿瘤学研究的权威期刊 JNCI(Journal of the National Cancer Institute)发表了LUNGCA研究全程的成果 “Dynamic ctDNA Informs Whole-course Postoperative Precise Management of NSCLC(LUNGCA Study)”[3]。下面本文将对研究成果做介绍,以飨读者。

研究亮点
LUNGCA队列是目前国际最大的前瞻性、多中心肺癌手术MRD监测队列;本研究ctDNA动态分析纳入233名NSCLC患者术后3年内2336份动态血浆样本,随访时间长,中位随访时间达51.4个月,采样规律,每位患者平均采集动态血浆样本超过10次。
提出从MRD的角度应将辅助治疗视为根治性治疗的重要组成部分,术后MRD状态可早期预测复发风险并为辅助治疗决策提供参考,而综合治疗后(根治性手术+必要辅助治疗)MRD状态因纳入了辅助治疗的影响,可以判断患者最终是否复发并及时评价辅助治疗效果。
靶向治疗优势:TKI治疗显著改善靶向突变阳性患者的RFS,且ctDNA清除效能优于化疗。
预后预测:复发后ctDNA阴性提示更优生存结局,为二次治疗提供参考。
全程管理策略:动态ctDNA监测数据的综合解析,可为NSCLC患者术后全程精准管理各重要节点(复发监测、辅助治疗决策、辅助治疗疗效评价、复发后生存预测)提供参考。
研究方法
LUNGCA为前瞻性多中心队列研究,对接受根治性手术的I-III期NSCLC患者进行动态ctDNA监测。本次分析纳入LUNGCA队列中的233名患者,ctDNA分析覆盖术前血浆样本、术后3天及1个月样本,之后每3-6个月随访一次,持续至术后3年,共2336份动态血浆样本(图1)。
NGS检测使用臻和MinerVA MRD®技术平台(769基因,tumor-informed MRD)。
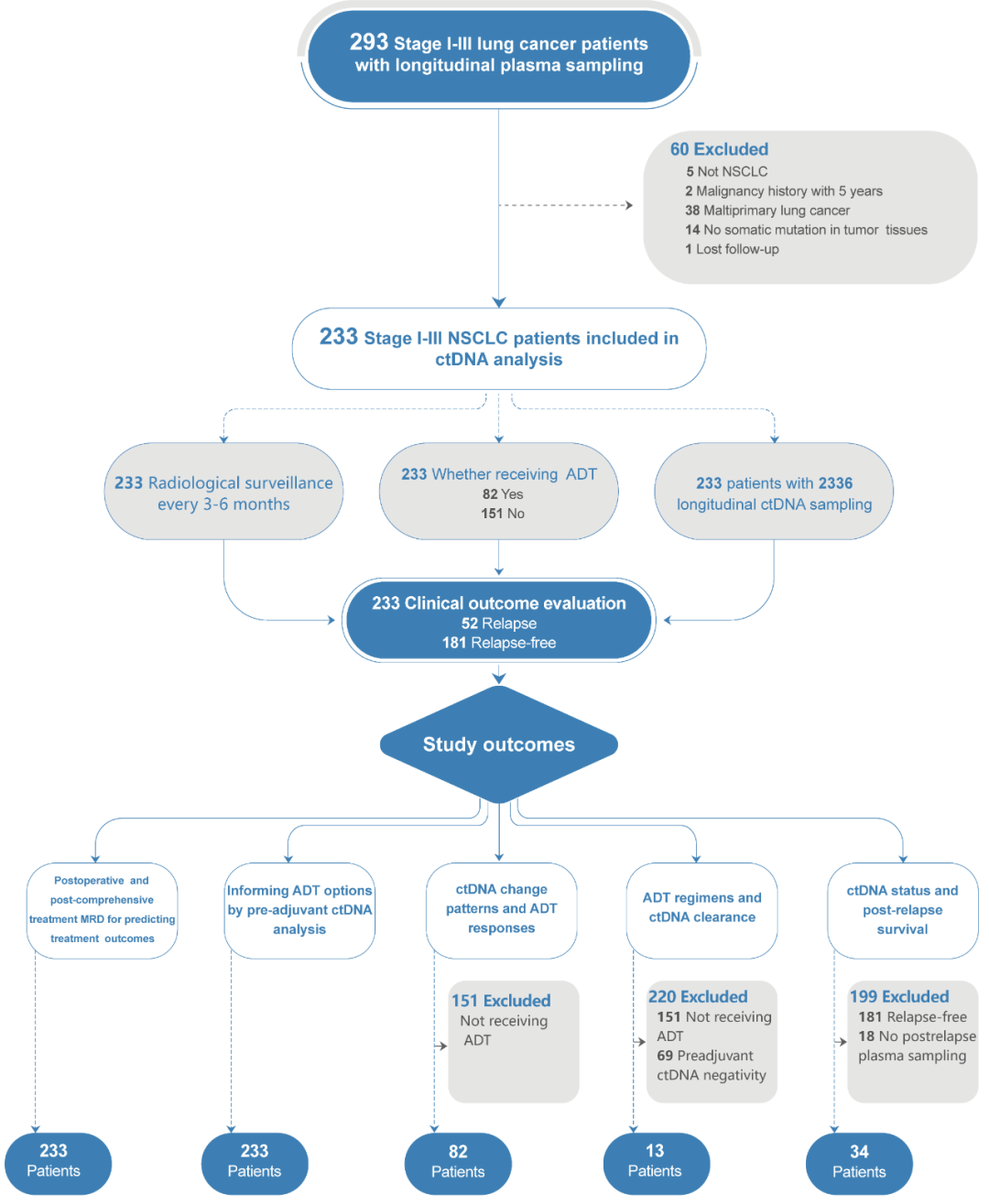
图1. 研究设计流程图
研究结果&结论
研究团队首先比较了术后MRD状态与综合治疗(根治性手术+必要辅助治疗)后MRD状态在预测疾病复发方面的效能是否存在差异。术后MRD阳性的30位患者,27位在术后三年内复发,PPV为90.0%;203位MRD阴性的患者中有183位未复发,NPV为90.1%;术后MRD阳性患者RFS显著较差 (HR = 18.7, 95% CI = 10.4-33.4, P <0 .001)。综合治疗(根治性手术+必要辅助治疗)后MRD阳性的27位患者术后3年内全部复发,PPV达100%;综合治疗后MRD阴性的206位患者中有186位一直未复发,NPV为90.3%;综合治疗后MRD阳性患者RFS显著更差 (HR = 30.5, 95% CI = 16.1-58.0, P <0 .001)(图2)。 以上结果说明术后MRD预测复发具有较高的阳性预测值和阴性预测值,而综合治疗后MRD因纳入了辅助治疗的影响,能判断患者最终是否复发。
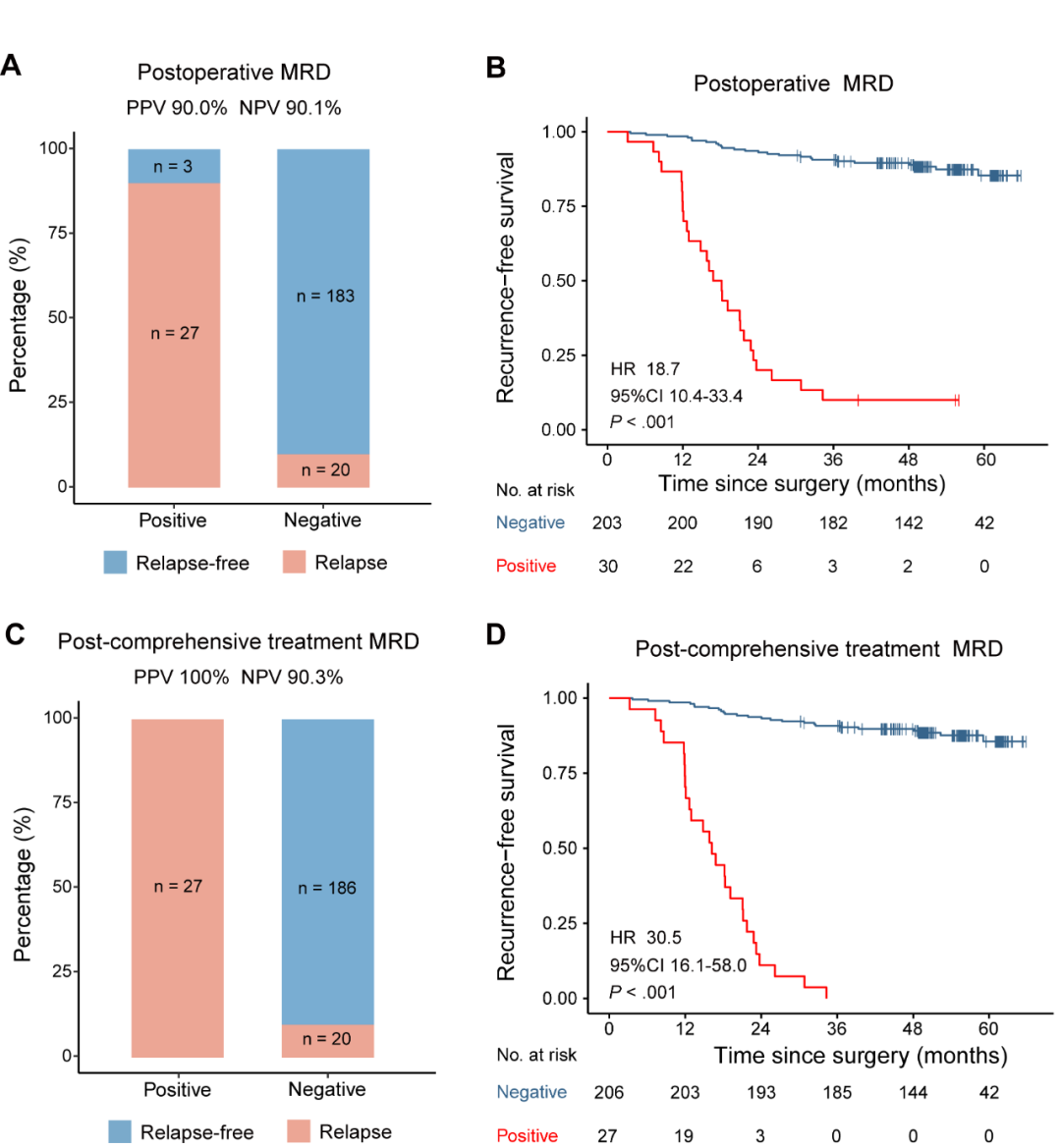
图2. 术后和综合治疗后MRD监测疾病复发的效能
为了明确ctDNA检测是否有助于辅助治疗方案的决策,研究团队根据患者原发肿瘤组织是否携带可靶向突变,评估了不同基因型亚组中辅助治疗前ctDNA状态与不同治疗方案下疗效的相关性。在67例无可靶向突变的患者中,辅助化疗(ACT)未能显著延长辅助治疗前ctDNA阳性人群的无复发生存期(RFS)(中位RFS:17.7个月 vs 12.1个月;HR=0.2,P=0.093)。无论是否接受ACT,辅助治疗前ctDNA阴性患者的RFS也相似(HR=0.9,P=0.933)。在166例原发肿瘤组织携带可靶向突变的患者中,14例为辅助治疗前ctDNA阳性,其中4例接受TKI治疗,5例接受ACT,5例未接受辅助治疗。TKI治疗组仅有1例(25%)复发,而其他两组复发率均为100%。与未治疗组相比,TKI治疗显著改善RFS(HR=0.01,P=0.005),但ACT未能改善该亚组患者的RFS(HR=0.6,P=0.491)(图3)。这些结果表明辅助治疗前ctDNA状态与肿瘤突变联合分析可预测不同辅助治疗方案的疗效。
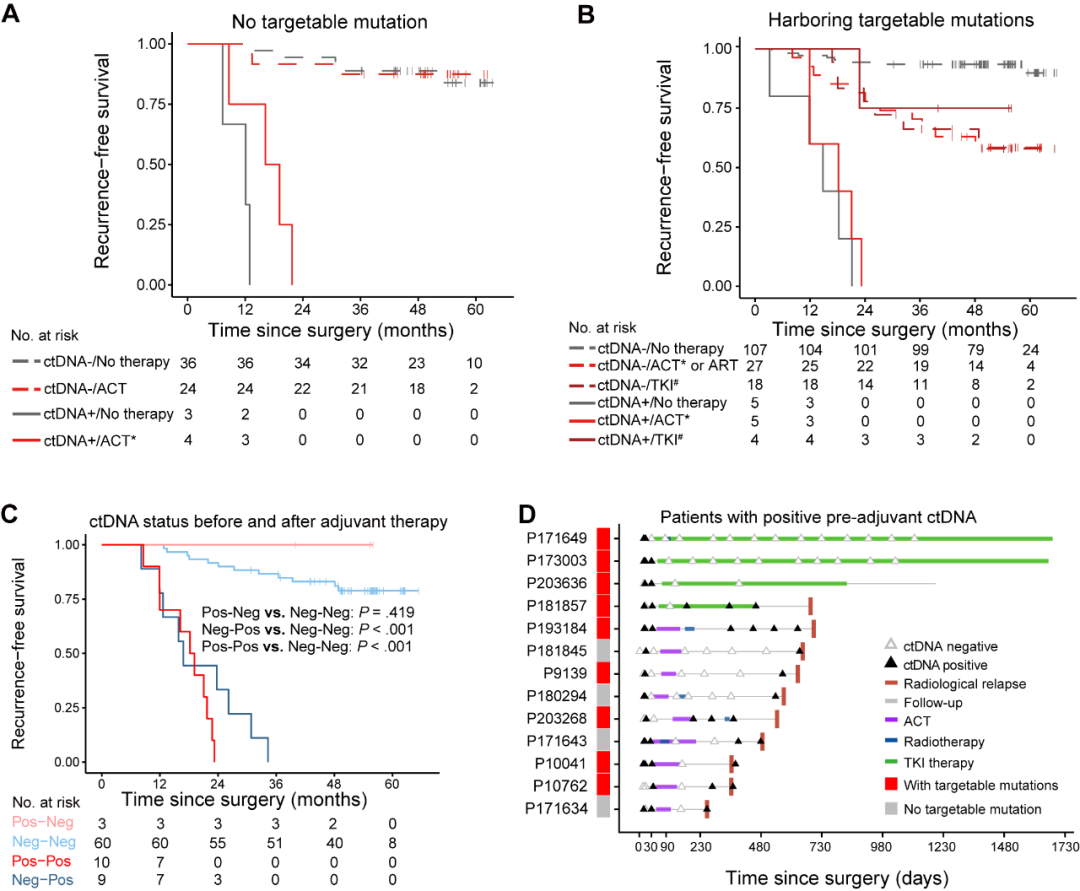
图3. ctDNA分析指导辅助治疗选择及评估疗效
研究团队进一步评估了ctDNA状态的动态变化能否用于及时评估辅助治疗反应。结果显示,辅助治疗前后ctDNA状态变化可分为四种模式:持续阴性、阴性转阳性、阳性转阴性和持续阳性。持续阴性或阳性转阴性模式患者的RFS结果良好且相近(两组均未达到中位RFS,P=0.419);而持续阳性或阴性转阳性模式患者的RFS显著差于持续阴性组(P<0.001);并且辅助TKI治疗在清除ctDNA和降低复发风险方面优于辅助化疗(图3)。这些结果表明,ctDNA清除反应辅助治疗方案的有效性,围辅助治疗期ctDNA监测可及时反应辅助治疗反应。
本研究中有34例复发患者采集了复发后血浆样本,其中18例复发后ctDNA呈阴性,16例呈阳性。复发后ctDNA阴性与复发后总生存期(OS)较好显著相关(HR=0.4,95% CI=0.1~0.9,P=0.029)。复发后ctDNA阴性患者的中位OS为40.9个月,而阳性患者为19.4个月。在复发后ctDNA阴性患者中,大多数为脑转移或局部复发(83.3%,15/18),而复发后ctDNA阳性患者多为骨转移或多器官复发(75.0%,12/16),这些转移器官的差异可能解释了为何复发后ctDNA阴性患者在疾病复发后仍能获得较好的生存期(图4)。综上,复发后ctDNA状态可预测复发患者的治疗结局。
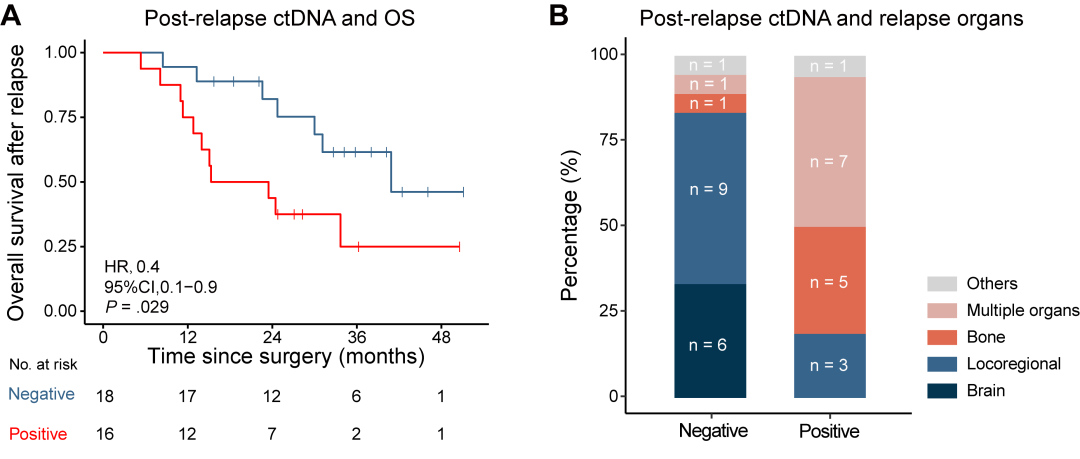
图4. 复发后ctDNA状态的临床意义
结论:本研究证实了ctDNA检测在NSCLC患者手术后复发监测、辅助治疗决策、疗效评估及复发后生存预测中的重要临床价值。未来需通过随机对照试验(RCT)验证ctDNA指导肺癌患者全程管理策略能否真正为患者带来生存获益。
参考文献:
1. Bray F, Laversanne M, Sung H, et al. Global cancer statistics 2022: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. 2024;74(3):229-263. doi:10.3322/caac.21834.
2. Xia L, Mei J, Kang R, et al. Perioperative ctDNA-Based Molecular Residual Disease Detection for Non-Small Cell Lung Cancer: A Prospective Multicenter Cohort Study (LUNGCA-1). Clin Cancer Res. 2022;28(15):3308-3317. doi:10.1158/1078-0432.CCR-21-3044.
3. Xia L, Pu Q, Kang R, et al. Dynamic ctDNA informs whole-course postoperative precise management of NSCLC (LUNGCA study), JNCI: Journal of the National Cancer Institute, 2025;, djaf061, https://doi.org/10.1093/jnci/djaf061.

本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言












#肺癌# #循环肿瘤DNA#
13