真实世界:NGS panel检测不仅改变了胶质母细胞瘤患者的诊断,还让超90%的患者有机会参加临床试验
2025-03-21 苏州绘真医学 苏州绘真医学 发表于陕西省
NGS的使用为诊断提供了有用的信息,尤其是在年轻患者中,并且随着更多治疗靶点和治疗方法的出现,它可能对临床决策具有重要价值。目前,它对推动科学进步至关重要。
高级别胶质瘤,尤其是胶质母细胞瘤,尽管近年来取得了一些进展,并且进行了最大限度的手术切除,但其预后仍然极为不佳。最近,多种基因组变异被确定为诊断标志物、预后因素以及分子治疗的靶点。本回顾性研究旨在评估下一代测序(NGS)作为一种评估胶质母细胞瘤患者肿瘤基因变异的工具所产生的临床影响。研究纳入了年龄<65岁且在2010年至2021年间因胶质母细胞瘤接受手术治疗的成年患者,这些患者明确诊断为胶质母细胞瘤,IDH基因未发生突变,根据诊断时的现行WHO分类标准为4级,并且根据现有信息符合2021年WHO分类标准。
共纳入32名患者,中位年龄为47.7岁,中位总生存期为25个月。通过NGS鉴定基因变异导致2例患者的诊断发生了改变。除一名患者外,在所有患者中均检测到了至少一种基因变异(每位患者中位数为三种),最常见的是EGFR扩增。在93.7%的患者中,发现了使他们有潜在资格参加临床试验的生物标志物。尽管观察到没有CDK4突变的患者有更好生存的趋势(p = 0.088),但就基因变异而言,未观察到生存差异。
NGS的使用为诊断提供了有用的信息,尤其是在年轻患者中,并且随着更多治疗靶点和治疗方法的出现,它可能对临床决策具有重要价值。目前,它对推动科学进步至关重要。
研究背景
高级别胶质瘤(HGG)仍然是一类中枢神经系统(CNS)肿瘤,尽管近年来取得了一些进展并且进行了最大限度的手术切除,但其生存率仍然极低。分子层面的进展使得在2021年WHO CNS分类标准中,高级别胶质瘤的分类更加准确:对于胶质母细胞瘤(GB)的诊断,特征性的组织学表现(低分化星形胶质细胞,伴有细胞核异型性、显著的微血管增生和/或坏死),再结合IDH野生型基因型就足以确诊。在没有胶质母细胞瘤组织学表型的情况下,携带EGFR扩增、TERT启动子突变,或者7号染色体获得和10号染色体缺失(这些基因组学发现与不良的临床结局和预后相关)的IDH野生型肿瘤,也可以诊断为胶质母细胞瘤。然而,要实现精确诊断,有时在时间和所需技术方面会存在问题。传统的基因突变、基因内缺失和基因融合检测方法耗时较长,例如对DNA或cDNA进行Sanger测序或焦磷酸测序、荧光原位杂交、多重连接探针扩增技术等等。
另一方面,高级别胶质瘤对现有治疗方法具有耐药性,这带来了治疗上的难题。当关注胶质母细胞瘤患者时,即使采用相同的治疗方案,患者的治疗结局也差异很大。最近,多个研究团队描绘出了胶质瘤的基因组图谱,揭示了一个复杂的基因组景观,其中存在着众多的分子变异,有些分子变异可作为生物治疗的可识别靶点。NGS不仅能够完善甚至可以独立地对具有特征性基因变异的脑肿瘤做出综合诊断。此外,由于其高测序覆盖度,它能够高精度、高灵敏度地评估大量的基因组靶点,并且已被证明能够在五个工作日内完成整个工作流程。然而,目前在胶质母细胞瘤中发现的大多数基因组变异(如EGFR扩增、EGFRvIII突变、TERT启动子突变)都缺乏有效的治疗药物。在儿童神经肿瘤学领域情况则有所不同,在临床常规中已经推荐使用NGS,因为BRAF抑制剂可以单独或与MEK抑制剂联合用于治疗BRAF突变的高级别胶质瘤。此外,在一小部分儿童和成人胶质瘤中发现了NTRK融合,这使得人们将注意力集中在了泛肿瘤NTRK抑制剂上。
最后,需要注意的是,尽管最大限度的安全手术切除是目前胶质母细胞瘤患者生存的最重要预后因素,但仍有一小部分患者(那些在初始同步辅助治疗前或治疗期间病情进展的患者)在生存方面并不能从手术切除中获得良好的收益。鉴于胶质母细胞瘤本身就会带来神经系统疾病负荷,而且有时手术也会产生影响,因此应该考虑患者的生活质量和手术的影响,尤其是对于这组患者。因此,评估这些患者肿瘤的不同特征,可能会促使开发出更有效且耐受性更好的胶质母细胞瘤治疗策略。
由于NGS技术越来越普及,如今在欧洲的神经肿瘤初级保健中心的临床常规中也经常使用,不过由于到目前为止它很少能改变治疗方案,所以在成年人群中,它尚未被确立为脑肿瘤的诊断工具。NGS缺乏关于其临床影响的高级别证据,但由于它可能检测到可靶向的突变,提供有关潜在可干预基因变异的信息,因此在研究和临床实践中受到越来越多的关注,尤其是在年轻的胶质母细胞瘤患者中使用时。
随着最近在神经肿瘤学中基因标志物被确认为预后因素和治疗靶点,NGS的可及性不断提高且具有诸多优势(目前尚未正式推荐用于成年患者的临床常规),以及前面提到的诊断和治疗方面的问题,本研究的目的是评估NGS对胶质母细胞瘤患者的实际临床影响。
研究结果
患者特征:
本研究共纳入32例患者进行分析,并使用包含161个关键癌症驱动基因的检测panel(可检测单核苷酸变异、扩增、基因融合和插入缺失)对他们的肿瘤样本进行了分析。人口统计学信息和相关临床病理特征见表1。患者的中位年龄为47.7岁,大多数患者为男性(68.8%)。头痛(50%)和癫痫发作(37.5%)是最常见的首发症状。65.6%的患者基线功能状态为ECOG体能状态评分0分,其余患者为ECOG 1分。所有患者用于NGS的样本均取自原发肿瘤。13例(40.6%)患者在疾病进展时接受了手术。平均总生存期为32个月(SD 3.61)。中位总生存期为25个月[95%CI(18, 39)]。平均无进展生存期为18.6个月(SD 2.62)。中位无进展生存期为13个月[95%CI(10, 23)]。在数据分析时,30例患者已死亡;2例患者存活,随访时间和生存时间分别为55个月和67个月。肿瘤体积测量数据见表2。

表1
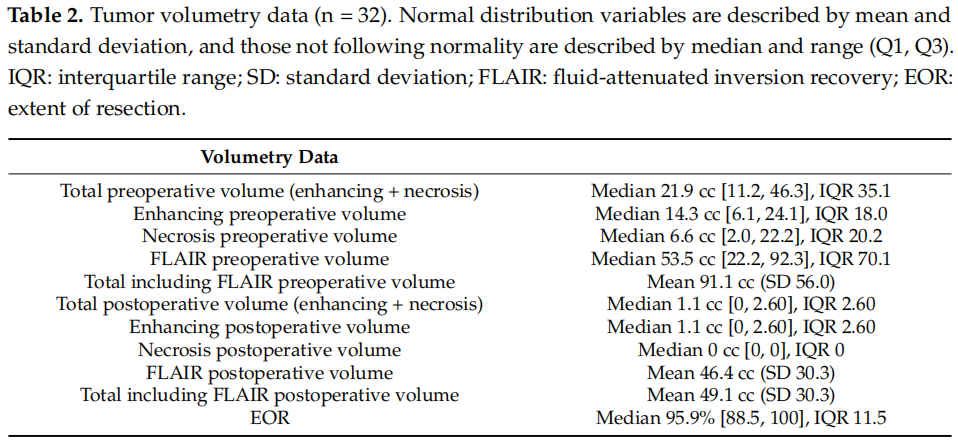
表2
生存预测因素:
在本患者队列中,术前肿瘤体积(p = 0.25)和切除范围(EOR,p = 0.32)方面均未观察到生存差异。年龄也对生存没有影响(p = 0.736)。术后对比增强的肿瘤体积显示,术后体积较小的患者有更长生存期的趋势(p = 0.0551)。观察到MGMT启动子甲基化的患者有更好生存的趋势,尽管未达到显著性标准(p = 0.0516,HR= 0.778 [95%CI= (0.365, 1.659)])。
完成计划的辅助替莫唑胺化疗的患者存在生存差异(p = 0.014),HR为0.3808 [95%CI= (0.1754, 0.8269)],如图1所示。与未完成计划辅助化疗的患者相比,完成化疗的患者死亡风险降低了61.92%。
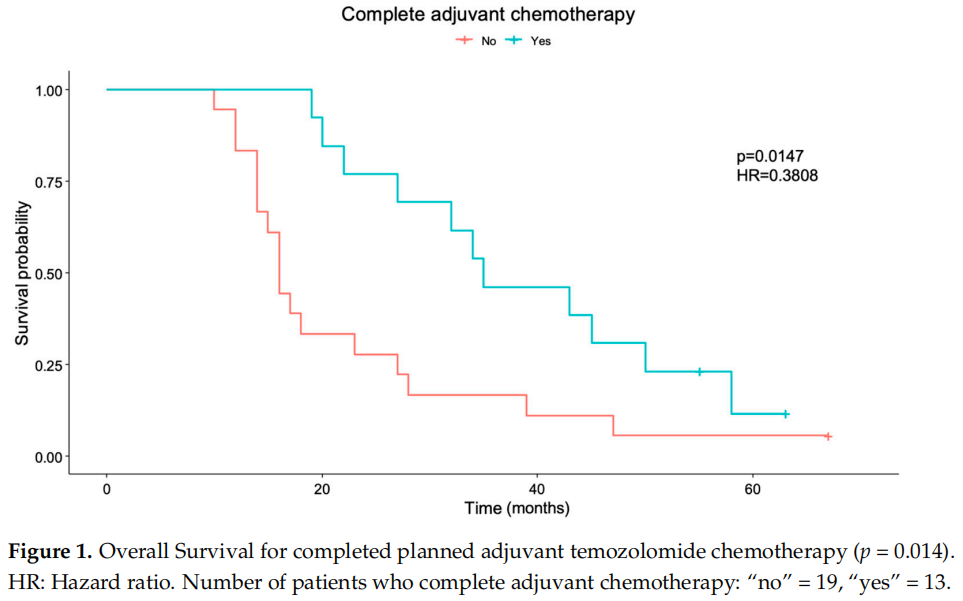
图1
与诊断时功能状态较差(ECOG评分>0)的患者相比,初始ECOG评分为0的患者也存在生存差异(p = 0.015 [HR = 2.992,95%CI = (1.234, 7.255)]),如图2所示。

图2
NGS质量控制和变异分析:
检测到的变异列于表3。使用了仪器设定的默认质量控制(QC)参数,包括所有两两差异的中位绝对值(MAPD)在0到0.4之间,以及检测到七个内部RNA对照靶点中的至少五个。对外显子区域或剪接位点区域(位于5'端或3'端前3个核苷酸内的变异)内的变异进行注释,这些变异被分类为单核苷酸变异(SNV)或插入缺失。此外,覆盖度标准和Phred质量得分基于当前临床环境中使用的临界值。另一方面,由于Ion Torrent平台在同聚物区域(TERT启动子)存在已知的局限性,在读取长度超过5个碱基的同聚核苷酸时准确性较低,研究者对该区域进行了测序,以提高所得结果的可信度。此外,研究者根据“1000 Genomes”和“GnomAD/ExAc”数据库推断可能的胚系变异。被分类为良性或可能良性胚系变异且经过ClinVar专家小组审查的变异,从已鉴定的变异中排除。
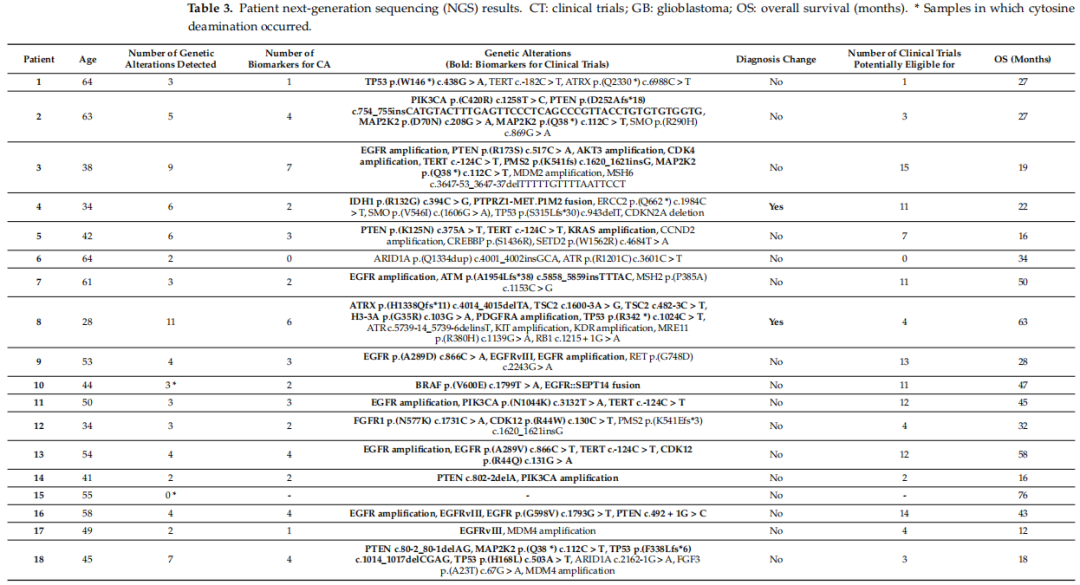

表3
基因变异:
如今,通过NGS鉴定的突变将导致2例患者(占患者总数的6.25%)的诊断发生改变:第一例是一名34岁的患者,为IDH突变的4级星形细胞瘤,IDH突变为p.R132G(此前通过针对R132H的免疫组织化学方法未检测到);第二例是一名28岁的患者,患有H3G34突变的弥漫性半球胶质瘤,伴有ATRX(α-地中海贫血/智力低下,X连锁)和H3G34突变。
除了一名患者外,所有患者均检测到至少一种基因变异(GA),最常见的是EGFR扩增(13例患者)和TERT变异(13例患者),其次是9例患者存在PTEN变异。每位患者鉴定出的基因变异中位数为三种。此外,在32例患者中的30例(93.7%)中,发现了使他们有潜在资格参加临床试验的生物标志物。这些生物标志物列于表3,其分布如图3所示。
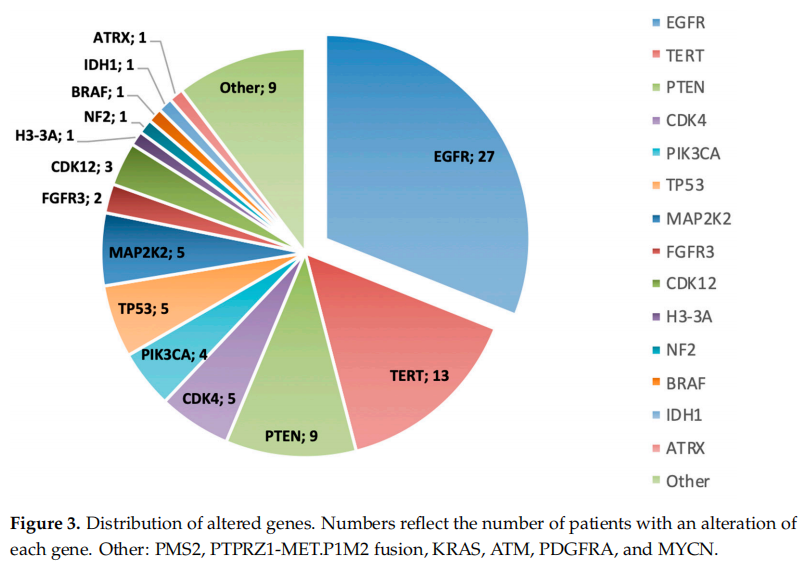
图3
在本患者队列中,EGFR扩增(p = 0.582)或EGFRvIII(p = 0.148)、TERT突变(p = 0.970)、PIK3CA突变(p = 0.419)或TP53(p = 0.713)方面均未观察到生存差异。观察到没有CDK4突变的患者有更好生存的趋势,尽管未达到显著性标准(p = 0.088)(图4)。
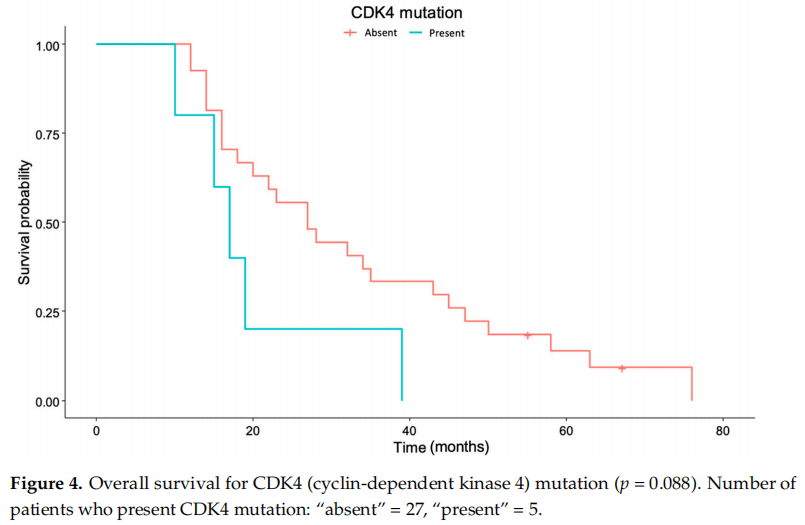
图4
对治疗决策的影响:
由于本研究是对NGS进行回顾性评估,在本队列中评估其对实际治疗决策的影响并不可行。然而,值得注意的是,在32例患者中的30例(93.7%)中,发现了使他们有潜在资格参加临床试验的生物标志物。另一方面,即使NGS检测出两例最初诊断不准确的病例,鉴于这两例患者的WHO分级仍为4级未变,他们最初可能仍会接受与Stupp方案相同的治疗。无论如何,正如在“患者2”中观察到的那样,NGS检测到IDH1 p.(R132G) c.394C > G突变是很重要的,因为这是一个例子,表明NGS能够检测出无法通过免疫组织化学方法评估的IDH突变。目前,对于携带IDH突变的低级别胶质瘤患者已有靶向治疗药物可用(沃拉西地尼,vorasidenib)。
讨 论
当关注那些接受相同治疗方案的IDH-wt胶质母细胞瘤患者时,会观察到截然不同的生存结局。到目前为止,即使对于最近定义的WHO中枢神经系统4级弥漫性胶质瘤中除胶质母细胞瘤之外的亚型(这些亚型在年轻患者中更为常见,例如H3G34突变的弥漫性半球胶质瘤或IDH突变的4级星形细胞瘤),其治疗策略对所有这些亚型而言仍然相似。在胶质瘤中,众所周知,MGMT启动子甲基化状态既具有预后意义,又能预测替莫唑胺的治疗效果,所以在胶质母细胞瘤的临床常规治疗决策中,主要基于这一因素。
除此之外,在过去十年里,针对高级别胶质瘤的多项临床试验均未取得成功,但在其他恶性肿瘤中,靶向治疗却取得了成效。在多种类型的恶性肿瘤中(如黑色素瘤中的BRAF突变或非小细胞肺癌中的EGFR突变),预测性生物标志物的检测及其应用已显示出对匹配的靶向治疗在临床改善和生存获益方面的作用。这就是NGS技术越来越受到关注的原因。
在讨论治疗选择和研究之前,现实情况是,尽管目前尚未建立针对脑肿瘤诊断的特定检测panel,但NGS正日益成为众多神经肿瘤中心诊断常规的一部分。在一项瑞士全国范围内关于NGS在胶质母细胞瘤患者临床治疗中应用情况的调查中,研究者发现,在8个神经肿瘤中心中,有4个中心使用OCA检测panel(另一个中心使用TS500检测组合;2个中心使用定制检测panel;最后一个中心不使用NGS)。在这些中心,年龄较小(小于60岁)、身体状况良好以及不适合标准治疗(或已用尽标准治疗方案)是应用NGS最相关的标准。
这些标准与本中心使用的标准相似,尤其是年龄较小这一标准,这也是本研究只纳入年龄小于65岁患者的原因之一。第二个原因是,在本研究中年龄对生存没有影响,因此不会成为其他变量的混杂因素,肿瘤体积也是如此,正如先前的研究结果所表明的那样。
在本研究中,患者确诊时的肿瘤多为中等到较大体积,切除范围较高(中位数为95.9% [88.8–100]),术后增强残留非常少。由于体积测量结果高度一致,因此在这些数据方面未发现生存差异。此外,正如预期的那样,术后对比增强的肿瘤体积显示,术后体积较小的患者有更长生存期的趋势(p = 0.0551)。确实观察到完成计划辅助化疗的患者存在生存差异。共有59.4%的患者未完成计划的辅助化疗,主要是因为临床或影像学上的疾病进展(除了3名患者——占未完成化疗患者的15.8%——因替莫唑胺的副作用而被迫停止辅助化疗)。尽管完成或未完成化疗的患者在PFS方面没有差异,但大多数患者未完成计划的辅助化疗是因为他们在治疗期间病情进展,这使得他们无法继续接受拟定的治疗。最后,初始体能状态较差的患者也存在生存差异。与初始时完全健康、能够不受限制地完成患病前所有活动的患者相比,初始ECOG体能状态评分>0的患者死亡风险几乎增加了三倍(HR = 2.992)。值得注意的是,尽管本研究未达到统计学显著性,但也观察到没有CDK4突变的患者有更好生存的趋势,这与先前的文献报道一致。
Sahm等人开发了一种定制的NGS基因检测panel(针对脑肿瘤中130个反复发生变异的基因的内含子和启动子区域),并在150个样本(79例回顾性病例和71例前瞻性病例)中使用。与已确立的单一生物标志物检测方法相比,他们发现一致性达到98%,但在TERT启动子突变(NGS未检测出来)和通过Sanger测序未检测到的ATRX突变方面存在差异。他们指出,尽管一个包含少于10个基因(IDH1/2、H3F3A、1p/19q、ATRX、TP53、EGFR、NF1、BRAF和PTEN)的检测panel可以解决大多数弥漫性胶质瘤样本的诊断问题,但涵盖更多的基因和结构变异事件可以评估更多种类的肿瘤实体,并在不显著增加时间或成本的情况下识别潜在靶点。在这两项研究中,NGS在肿瘤细胞含量低的样本中都很有效,并且NGS提供的信息已确定了实验治疗的潜在靶点:在他们的研究系列中,79%的胶质母细胞瘤样本确定了潜在靶点,在本研究中这一比例为93.7%。
关于诊断,先前的研究已根据基因表达谱确定了胶质母细胞瘤的不同亚型——经典型、前神经元型、间充质型和神经型。EGFR、NF1以及PDGFRA/IDH1的基因变异和表达分别定义了经典型、间充质型和前神经元型亚型。无论如何,最近的进展强调了DNA甲基化谱在增强胶质母细胞瘤亚型分型中的重要作用,正如最近发表的cIMPACT-NOW Update 9所强调的那样,甲基化谱是比基因表达更稳定和临床相关的标志物。
除了诊断价值外,NGS不仅可以检测小分子抑制剂和生物制剂的可作用靶点,还可以揭示肿瘤特异性免疫靶点。癌症基因组图谱研究网络(TCGA)在500例原发性胶质瘤样本中,多达90%的样本检测到了治疗靶点。尽管研究者无法评估对治疗决策的影响,但如前所述,在大多数患者中也检测到了试验性治疗靶点。其他研究也证明了NGS检测panel在检测可干预靶点甚至导致治疗方案改变方面的实用性。
例如,在一项对557例IDH-wt胶质母细胞瘤患者的回顾性研究中,23%的患者将NGS结果用于临床决策,主要作为复发性胶质母细胞瘤患者参加临床试验的先决条件。这些患者中只有8%需要特定突变才能纳入研究,并且在临床试验中未观察到患者的生存获益。
另一方面,Blumenthal等人对43例患者(34例胶质母细胞瘤、8例间变性星形细胞瘤、1例间变性少突胶质细胞瘤)进行了分析,对治疗决策的影响比例为30%。他们每位患者的GA中位数为4.5(范围为1–23),与本研究结果(中位数为4,范围为0–11)相当。在他们的研究系列中,使用的靶向药物治疗包括依维莫司、厄洛替尼、阿法替尼、哌柏西利、曲美替尼和BGJ398,但没有一位患者对相应的生物治疗有反应(靶向各种基因组发现,包括EGFR变异、mTOR激活、细胞周期靶点和FGFR1突变)。
此外,不仅在胶质母细胞瘤中,在其他实体瘤中也观察到了类似的模式。在一项前瞻性研究中,纳入了超过4500例实体瘤患者进行NGS panel检测(OCTANE研究),肿瘤学家将47.7%的患者的检测结果归类为可干预,其中15.7%的患者的NGS结果导致了药物治疗的改变:60%的患者参加了临床试验,21%的患者接受了已获批的药物治疗,13%的患者避免了无效治疗,6%的患者接受了超说明书用药治疗。尽管NGS提供了有价值的信息,但在这项研究中,接受匹配治疗的患者与未接受匹配治疗的患者之间在总生存期方面没有影响(p = 0.55,中位生存期未达到)。
到目前为止,证据似乎表明,在胶质母细胞瘤中,NGS的使用为诊断提供了有用的信息,尤其是在年轻患者中,但它似乎并没有转化为患者总生存期的改变,即使对其中一些患者来说,NGS数据导致了治疗方案的改变,甚至使他们有机会参加临床试验。
然而,我们坚信这并不意味着对年轻患者进行NGS检测是没有价值的。研究是在这个领域取得进展的唯一途径,只要不损害治疗标准或患者的生活质量,患者就能从NGS所揭示的所有信息中受益。随着针对某些肿瘤实体的分子指导治疗方法的出现或正在研究中,高通量分析已成为确定适合特定治疗方案的患者(主要是儿童和年轻成年人)的必要手段。
基于多组学研究,VEGF(贝伐珠单抗)或EGFR的突变或扩增、NTRK融合(恩曲替尼或拉罗替尼)、CDK4/6基因扩增(哌柏西利)以及BRAF V600E突变等已被确定为胶质母细胞瘤的潜在治疗靶点。此外,有报道称,使用BRAF/MEK抑制剂(达拉非尼联合曲美替尼)成功治疗了携带BRAF V600E突变的胶质瘤,在高级别胶质瘤中的客观缓解率为33% 。中位缓解持续时间为31.2个月,中位无进展生存期为5.5个月,中位总生存期为17.6个月。在本研究中,NGS在一名年轻患者中检测到了BRAF V600E突变,该患者在诊断为胶质母细胞瘤时年龄为44岁。
EGFR扩增是原发性胶质母细胞瘤中最常见的基因变异。在本队列中,32例患者中有13例(占病例的40%)存在EGFR扩增。虽然EGFR通路抑制剂有望靶向胶质母细胞瘤的癌基因成瘾性,但目前尝试使用抗体或小分子靶向EGFR尚未被证明在临床上取得成功。最近的研究表明,通过靶向共扩增基因来克服胶质母细胞瘤对EGFR抑制剂的耐药性,以提高EGFR酪氨酸激酶抑制剂的治疗效果。SEC61G就是这样一个例子,它被发现与EGFR共扩增,并且在胶质母细胞瘤中高表达。Zeng等人发表的结果表明,敲除SEC61G可促进CD8+ T细胞的浸润和细胞溶解活性,抑制小鼠胶质母细胞瘤的发生。因此,对于EGFR扩增的胶质母细胞瘤患者,联合治疗是一种可能的选择,因为这类患者占所有胶质母细胞瘤患者的40%-60%。
另一方面,研究还表明,鉴于EGFR通路参与了代谢重编程(这对肿瘤生长和免疫逃逸机制至关重要),可以靶向EGFR通路。最近的一项研究表明,靶向EGFR/AKT和甲羟戊酸途径可增强替莫唑胺在胶质母细胞瘤细胞和动物模型中的抗肿瘤作用。
EGFRvIII(本研究系列中有8例患者,占25%),即表皮生长因子受体III类变体,是野生型酪氨酸激酶的一种组成型激活突变体,在相当一部分恶性胶质瘤和其他人类癌症中存在,但在正常组织中完全不存在。在谈到胶质瘤免疫治疗时,EGFRvIII很重要。EGFRvIII适合作为疫苗接种的靶点,因为它是在弥漫性胶质瘤中IDH1基因(R132H)发生的点突变。
值得注意是,一项非常新的1期临床研究证实,EGFR是胶质母细胞瘤中合适的免疫治疗靶点。胶质母细胞瘤患者脑室内CARv3-TEAM-E T细胞治疗(INCIPIENT)研究评估了其在复发性或新诊断的胶质母细胞瘤患者中的安全性,并显示在单次脑室内输注双靶向CARv3-TEAM-E T细胞后的几天内,3名参与者出现了快速且显著的影像学反应。
频率较低的基因变异,如CDK4/6、TERT、PTEN和PIK3CA等,也成为了众多正在进行的研究(包括临床试验)的对象。
最后,需要强调的是,在可能发现罕见但重要基因变异的特定病例中,NGS至关重要。NTRK融合就是这样一个例子,在胶质瘤中非常罕见(0.55–2%),且在年轻患者中更为常见,而免疫组织化学无法用于筛查NTRK融合。此外,NGS可以为某些病例提供额外价值,在这些病例中,发现某些基因(例如与神经纤维瘤病相关的NF1、李-佛美尼综合征相关的p53、考登综合征相关的PTEN和结节性硬化症相关的TSC等)中的特定等位基因频率(至少50%),可能不仅是对患者进行基因检测的原因,也是对其亲属进行基因检测的原因。
值得一提的是,并非所有的医疗中心都能随时进行NGS检测,因为NGS检测的直接成本比已实施的单一检测方法更高。然而,许多神经肿瘤转诊中心由于已将该技术应用于其他恶性肿瘤(如肺癌或结肠癌),所以能够使用NGS技术,并且每天都在使用。
本研究的主要局限性在于其回顾性的性质,这使得无法看到对治疗决策的实际影响。关于NGS,其局限性之一是需要未过度固定且适合分子生物学技术的样本材料。样本必须包含最低比例(20%)的肿瘤细胞才能进行分析。另一方面,通过NGS检测基因融合在设计用于获取扩增子的探针以及生物信息学处理方面都存在挑战。虽然使用RNA进行NGS检测已被认为是一种解决方案,但它仍未达到消除假阴性可能性所需的灵敏度。NGS的另一个局限性是难以确定所分析基因的拷贝数变异。尽管存在基于NGS生成产物的生物信息学算法,但其准确性仍不及比较基因组杂交(CGH)芯片或荧光原位杂交(FISH)等技术。至于临床试验,应该记住,并非所有国家都能随时开展临床试验,在某些情况下,患者会拒绝参加临床试验,甚至由于病情恶化,患者无法接受进一步的治疗。此外,到目前为止,在大多数复发性胶质母细胞瘤的研究中,研究设计中并未纳入分子标准。
展望未来,正如欧洲神经肿瘤协会(EANO)指南中所述,从长远来看,使用NGS panel检测或甲基化芯片进行先进的分子诊断可能具有成本效益,因为它们允许在一次检测中评估诊断(WHO分类)所需的多个个体分子参数。此外,它们缩短了周转时间,并揭示了通过逐步单一检测方法无法获得的信息。
而且,正如之前所讨论的,这些高通量分析将提供支持神经肿瘤学,特别是高级别胶质瘤治疗方面进一步科学发展的知识。需要注意的是,关注胶质母细胞瘤患者的基因组驱动试验将非常重要。
对于疑似患有高级别胶质瘤的年轻患者来说,NGS是一种有价值的诊断工具,因为它能够在一次检测中同时评估多个分子参数,并且在某些情况下,即使在没有明确的组织病理学肿瘤分类的情况下也能做出诊断。这项技术可以在有限的肿瘤样本上进行,这在涉及功能区切除或活检的病例中特别有利。它的应用甚至可能无需重复活检。尽管在中枢神经系统肿瘤的分子检测临床应用方面仍存在一些未解决的问题,但随着新的治疗靶点和治疗方法不断涌现,NGS在常规神经病理学诊断中可能会变得越来越重要。目前,它不仅在诊断方面发挥着关键作用,还在识别生物标志物方面至关重要,这些生物标志物使患者有机会参与临床试验,并为科学进步做出贡献。
参考文献:
Vivancos Sánchez, C.; Esteban Rodríguez, M.I.; Peláez García, A.; Taravilla-Loma, M.; Rodríguez-Domínguez, V.; Rodríguez-Antolín, C.; Rosas-Alonso, R.; Losantos-García, I.; Isla Guerrero, A.; Gandía-González, M.L. Clinical Impact of a Next-Generation Sequencing Approach for Glioblastoma Patients. Cancers 2025, 17, 744. https://doi.org/10.3390/cancers17050744


本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言
















#胶质母细胞瘤# #NGS panel#
6