Adv Sci:重庆医科大学何朝晖等团队合作研究开发了神经递质模拟纳米囊泡促进胶质母细胞瘤术后干细胞特异性治疗预防肿瘤复发
2024-12-29 iNature iNature 发表于上海
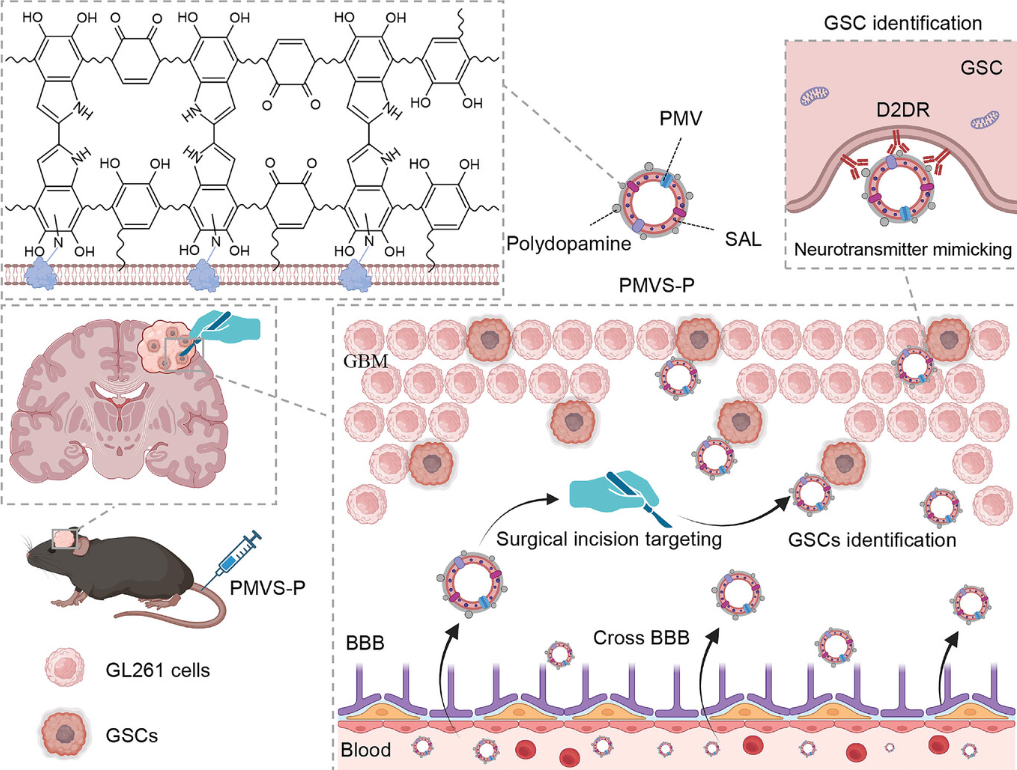
该研究以血小板膜源性囊泡(PMV)为基础,以抗GSCs药物盐霉素(SAL)为负载,以聚多巴胺(PDA)为表面,合成了一种模拟神经递质的纳米囊泡(PMVS-P)。
尽管实施了积极的多模式治疗方法,但胶质母细胞瘤(GBM)患者的生存质量仍然不理想,这与手术切除后肿瘤复发密切相关。胶质母细胞瘤干细胞(GSCs)在狭窄切口边缘的自我更新和强大的致瘤能力是驱动肿瘤继发的重要因素。目前,治疗术后残留GSCs的挑战主要是由于缺乏切口材料和GSCs靶向。 2024年12月25日,重庆医科大学何朝晖,中国科学院朱凌、杨延莲共同通讯在Advanced Science 在线发表题为“Neurotransmitter-Mimicking Nanovesicles Facilitate Postoperative Glioblastoma Stem Cell-Specific Treatment for Preventing Tumor Recurrence”的研究论文。该研究以血小板膜源性囊泡(PMV)为基础,以抗GSCs药物盐霉素(SAL)为负载,以聚多巴胺(PDA)为表面,合成了一种模拟神经递质的纳米囊泡(PMVS-P)。 PMVS-P具有手术切口靶向能力,特异性识别中枢神经递质受体D2多巴胺受体(D2DR)高表达的GSCs,从而抑制GBM复发。这种模拟神经递质的纳米囊泡引发了GSCs特异性的肿瘤杀灭治疗,在预防肿瘤复发方面具有广泛的应用。

胶质母细胞瘤(GBM)是恶性程度最高的脑肿瘤,生存期短,复发率高。目前GBM的标准治疗是手术切除加辅助放疗。然而,很大比例的GBM在切除腔的狭窄边缘复发,直接导致预后差和治疗效果不满意。胶质母细胞瘤干细胞(GSCs)是一种肿瘤起始细胞,具有很强的致瘤性和自我更新能力,存在于术后残留的肿瘤组织中,驱动GBM复发。因此,术后残留GSCs的清除是抑制GBM复发的关键因素。研究表明,GSCs存在于手术切口边缘,介导手术切口GBM的复发。因此,切口靶向是纳米材料对抗GBM复发的有效策略。血小板是一类对切口有反应的血细胞,因为它含有丰富的膜蛋白,如糖蛋白Ib (GPIb)、糖蛋白Ia-IIa (GPIa-IIa)和整合素,它们与切口暴露的胶原IV结合,促进止血和营养作用。具有高丰度血小板膜蛋白的血小板膜囊泡(PMVs)也可以表现出切口靶向能力。此外,由于它们具有疏水磷脂双分子层和亲水性空腔,它们还可以作为药物的装载和递送载体。生物源PMVs的高生物相容性和低免疫原性也保护纳米囊泡不被免疫系统清除,从而减少PMVs在切口部位的免疫排斥反应。因此,PMV是一种很有前景的靶向GBM手术切口残余肿瘤组织的纳米材料。
除了手术切口靶向外,促进GSCs的药物识别也是抑制GBM复发的关键因素。生理性D2多巴胺受体(D2DR)主要表达于中枢神经系统,与多巴胺神经递质结合产生神经兴奋。然而,研究发现,由于维持了GSCs的去分化表型,D2DR在GBM中的高表达促进了不良预后,这表明D2DR是癌症干细胞治疗的靶点。因此,神经递质多巴胺修饰纳米材料提高了GSC的识别。近年来,研究人员发现,多巴胺功能化的纳米材料可以通过识别合成的多多巴胺(PDA)的儿茶酚和胺基与D2DR结合,介导D2DR富集细胞的内吞作用。因此,多巴胺功能化的纳米囊泡可能具有通过D2DR介导的鉴定靶向GSC的潜力。
神经递质模拟纳米囊泡抑制GSC和预防GBM复发的示意图(图源自Advanced Science )
研究将抗GSCs药物盐霉素(SAL)装载到PMV的磷脂双分子层中,并通过原位聚合将PDA武装在其表面,合成了模拟神经递质的纳米囊泡PMVS-P。PMV促进GBM手术切口部位残留肿瘤组织中的药物聚集。PDA壳通过D2DR介导的结合靶向GSCs,在SAL存在下产生GSCs的细胞毒性,从而抑制GBM复发。研究提供了一种有效靶向GSCs治疗术后残留病变的策略,为抑制GBM复发提供了新的治疗思路。研究阐明了PDA靶向肿瘤干细胞的机制。由于PDA经常被用作药物递送的直接载体或纳米材料的涂层,研究结果也为广泛应用于癌症干细胞治疗的基于PDA的纳米材料提供了新的生物学功能。
参考消息:
https://onlinelibrary.wiley.com/doi/10.1002/advs.202409713
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言
















#胶质母细胞瘤# #神经递质模拟纳米囊泡#
9