王共强:基底节区病变的非运动症状 | 机制与临床
13小时前 神经科学论坛 神经科学论坛 发表于陕西省
基底节区病变不仅引发运动障碍,还与多种非运动症状相关,其机制复杂,涉及多系统异常。非运动症状异质性高,常早于运动症状出现,对疾病早期诊断和治疗有重要意义,未来需深入研究其调控网络。
论坛导读:基底节区是大脑深部的重要神经核团,传统上被认为主要参与运动调控。然而,近年研究表明,基底节区病变不仅导致运动障碍(如帕金森病、肌张力障碍),还与多种非运动症状密切相关,包括认知功能障碍、情绪障碍、自主神经功能异常等。
基底节区病变的非运动症状本质上是多尺度网络失调的表现,临床实践中需突破传统的运动障碍框架,采用"全脑网络-分子靶点-行为表型"的三维诊疗模式。基底节区病变的非运动症状常早于典型运动症状出现,早期识别这些"前驱症状"对疾病修饰治疗时机选择具有重要价值。建议建立多学科协作团队(神经科、精神科、康复科),采用PRO(患者报告结局)与临床评估相结合的模式进行全程管理。
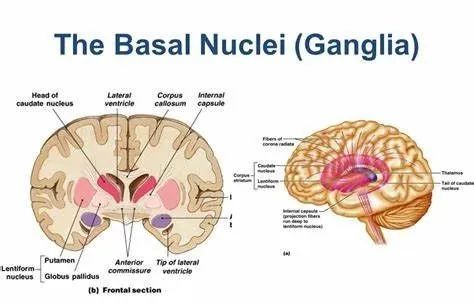
一、解剖与功能基础
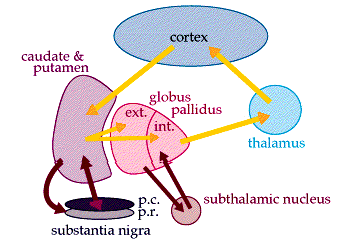
基底神经节区由尾状核、豆状核(壳核和苍白球)、屏状核、丘脑底核及黑质等灰质团块组成,是锥体外系的核心结构。其功能不仅涉及运动的起始与调控,还与认知、情绪、感觉整合及自主神经调节密切相关。例如,黑质多巴胺能神经元退化可导致帕金森病的运动症状,而基底节与其他脑区(如前额叶皮质、边缘系统)的异常连接则可能引发非运动症状。
二、病理生理机制
基底节区非运动症状的产生涉及多系统、多环节的复杂调控异常,核心机制包括:
1. 神经递质系统失衡
多巴胺能系统:黑质-纹状体通路多巴胺(DA)减少不仅导致运动障碍,还会影响前额叶-基底节环路,引发执行功能下降(如帕金森病)。中脑边缘系统DA异常与情感淡漠、快感缺失相关。
5-羟色胺(5-HT)系统:基底节与中缝核的5-HT能投射受损可诱发抑郁、焦虑(常见于帕金森病及脑卒中后抑郁)。
乙酰胆碱(ACh)系统:基底前脑胆碱能神经元退化导致记忆障碍,与路易体痴呆的视幻觉密切相关。
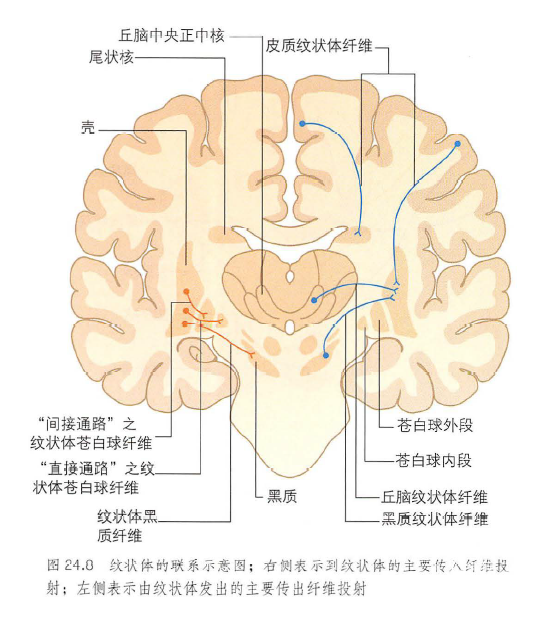
2. 神经网络连接异常
皮质-基底节-丘脑环路:前额叶-基底节环路功能抑制引发执行功能障碍(如计划能力下降、思维迟缓)。边缘系统-基底节环路失调导致情绪波动(如亨廷顿病的易激惹)。背外侧前额叶通过尾状核调控执行功能,内侧前额叶通过壳核参与情绪调节。腹侧纹状体(伏隔核)与杏仁核、前扣带回形成奖赏-动机环路,病变可导致快感缺失、决策障碍。
默认模式网络(DMN)异常:基底节区病变可破坏DMN整合,表现为静息状态下过度活跃,与帕金森病痴呆的注意力缺陷相关。
3. 蛋白异常沉积与神经元变性
α-突触核蛋白聚集:路易小体在基底节及边缘系统沉积可诱发嗅觉丧失、RBD(快速眼动期睡眠行为障碍)等前驱症状。
铁代谢异常:苍白球铁沉积(见于帕金森叠加综合征)可能通过氧化应激加重自主神经功能障碍。
4. 自主神经中枢调控紊乱
下丘脑-脑干-基底节通路调控失调导致心血管反射异常(如体位性低血压)、胃肠动力障碍(如便秘)。壳核后部病变影响压力反射弧(直立性低血压发生率>40%)。迷走神经背核-基底节连接异常导致便秘(早于运动症状出现)。
三、临床表现
基底节区病变的非运动症状具有高度异质性,可早于运动症状数年出现:
1. 认知功能障碍
执行功能损害:患者难以完成多步骤任务(如做饭),表现为“冻结”现象(如帕金森病)。如皮质基底节变性患者中,80%存在计划与决策能力下降。
记忆障碍:工作记忆受损(如心算困难),晚期出现情景记忆丧失(PDD患者中发生率60%-80%)。背侧纹状体萎缩与N-back任务错误率增加相关。
视空间缺陷:无法判断物体距离或方向,常导致跌倒风险增加(帕金森病患者中占40%)。壳核病变影响空间导航网络(如进行性核上性麻痹)。
2. 情绪与精神症状
抑郁与焦虑:帕金森病患者抑郁发生率约35%,表现为持续性悲伤、兴趣丧失,部分与DA能药物波动相关。黑质-纹状体通路异常不仅影响运动,还通过中脑边缘通路(mesolimbic pathway)导致动机缺失(如帕金森病快感缺失)。
特殊表现:基底节区卒中后可能出现“病理性哭笑”(假性延髓情绪)。淡漠综合征因为前扣带回-腹侧纹状体连接中断(特异性高于抑郁症),淡漠发生率可达60%(vs阿尔茨海默病30%)。多巴胺替代治疗会诱发病理性赌博/性欲亢进(腹侧纹状体多巴胺受体超敏)。
精神病性症状:视幻觉(如看到不存在的人影)在路易体痴呆中发生率高达80%,夜间加重。多巴胺能药物在改善运动症状同时可能加重幻觉。丘脑底核高频振荡异常与视幻觉相关。
3. 自主神经功能异常
心血管系统:体位性低血压(收缩压下降≥20mmHg),导致头晕甚至晕厥(多系统萎缩患者中占75%)。
胃肠系统:胃轻瘫表现为早饱、恶心;便秘因结肠传输时间延长。胃排空延迟(帕金森病便秘发生率80%)
体温调节:出汗异常(Wilson病特征性体征)
泌尿系统:逼尿肌过度活动引起尿急、夜尿增多(帕金森病患者中50%出现)。
4. 感觉与睡眠障碍
嗅觉减退:90%帕金森病患者存在嗅觉丧失,常早于运动症状5-10年出现,与嗅球α-突触核蛋白沉积相关。
疼痛综合征:类型包括肌肉骨骼痛(60%)、神经根性痛(20%),与基底节对痛觉调制功能丧失有关。
睡眠障碍:RBD(快速眼动期肌张力未抑制)表现为梦境演绎(如喊叫、踢打),60%-80%最终进展为α-突触核蛋白病。40%帕金森病患者REM睡眠行为障碍早于运动症状10年以上。
5. 其他非运动症状
疲劳:主观性疲劳(与运动无关)在帕金森病患者中占50%,可能与炎症因子(如IL-6)水平升高相关。
语言障碍:基底节区卒中可导致言语启动困难(如纯词哑),亨廷顿病则表现为语速不自主增快。
四、病理机制与临床表型
| 病变部位 | 典型非运动症状 | 关键机制 |
|---|---|---|
|
尾状核头部 |
执行功能下降、强迫思维 |
前额叶-尾状核环路中断 |
|
壳核前部 |
焦虑、快感缺失 |
边缘系统-纹状体5-HT转运体密度降低 |
|
苍白球内侧部 |
情感淡漠、自主神经失调 |
GABA能投射至丘脑板内核异常 |
|
丘脑底核 |
冲动攻击行为、睡眠觉醒周期紊乱 |
丘脑皮质振荡同步性破坏 |
五、临床意义与诊断线索
非运动症状常早于运动症状出现(如帕金森病前驱期嗅觉障碍),易被误诊为其他系统疾病。此外,症状异质性高(如疼痛类型多样),需结合影像学(MRI、DAT-SPECT)及生物标志物(α-突触核蛋白)综合分析。
1. 早期预警价值
前驱期标志:RBD、嗅觉丧失、便秘可预测帕金森病风险(特异性>80%)。MDS-PD诊断标准允许在运动症状前启动疾病修饰治疗。
鉴别诊断:自主神经衰竭突出提示多系统萎缩,而视幻觉频发倾向路易体痴呆。
2. 治疗靶点启示
多巴胺激动剂(如罗匹尼罗)可改善情感淡漠,但可能加重幻觉。针对苍白球内侧部(GPi)可改善强迫症状,丘脑底核(STN)高频刺激需警惕决策功能恶化。
靶向胆碱能系统(如加兰他敏)对视空间障碍有效。rTMS干预背外侧前额叶10Hz刺激提升执行功能。5-HT1A受体部分激动剂(如坦度螺酮)治疗焦虑伴认知损害。去甲肾上腺素再摄取抑制剂(如阿托莫西汀)改善注意缺陷。
六、总 结
基底节区病变的非运动症状机制复杂,涉及神经递质失衡、环路破坏及蛋白病理,临床表现涵盖认知、情感、自主神经等多领域。早期识别这些症状不仅有助于疾病诊断分层,还可为个体化治疗提供依据(如针对胆碱能缺陷使用特定药物)。未来研究需进一步阐明基底节非运动功能的具体调控网络,以开发更精准的干预策略。

本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言











#非运动症状# #基底节区病变#
3