好文推荐 | 帕金森病、原发性震颤和神经元核内包涵体病的震颤特点
20小时前 中风与神经疾病杂志 中风与神经疾病杂志 发表于陕西省
本研究进一步探讨PD、ET以及NIID震颤的表面肌电特点,为临床上三组疾病的鉴别提供客观的电生理指标。
摘要
目的 探讨帕金森病(PD)、原发性震颤(ET)和神经元核内包涵体病(NIID)的震颤特点。方法 采集73例震颤患者(包括PD组30例、ET组23例、NIID组20例)的双上肢表面肌电图,采用功率谱分析探讨频率特点。通过单因素方差分析和卡方检验比较三组患者表面肌电图的各项电生理参数。结果 ET的震颤频率高于PD(F=41.86,P<0.01),PD的震颤频率高于NIID静止状态(F=41.86,P=0.002)和NIID姿势状态(F=41.86,P=0.011)。PD交替收缩模式所占的比例高于NIID静止状态(χ2=5.70,P=0.017)和姿势状态(χ2=7.24,P=0.007),同时高于ET(χ2=9.67,P=0.002)。PD谐波共振所占的比例同样高于NIID静止状态(χ2=4.64,P=0.031)和姿势状态(χ2=7.73,P=0.005)以及ET(χ2=6.52,P=0.011)。结论 三组比较ET的震颤频率最高,NIID的震颤频率最低,PD交替收缩模式和谐波共振所占的比例高于ET和NIID。
震颤是椎体外系疾病的主要症状之一,帕金森病(Parkinson disease,PD)以静止性震颤为主,呈双侧肢体不对称性,原发性震颤(essential tremor,ET)以姿势性和意向性震颤为主,呈双侧肢体对称性。神经元核内包涵体病(neuronal intranuclear inclusion disease,NIID)是一种罕见的慢性神经系统变性疾病,其疾病的特征是中枢和外周神经系统以及内脏器官中存在神经元核内包涵体。近年来,随着越来越多的NIID的报道,临床医生发现NIID可以有明显的震颤表现,也有文献报道震颤可能是 NIID 的早期临床表现之一,随着病程的进展,其临床症状逐渐增多,这类合并震颤的NIID患者被称为震颤型NIID,震颤型NIID往往隐匿起病,缓慢进展,病史可达10余年,表现为突出的姿势性震颤和意向性震颤,伴有家族史,部分患者在饮酒后震颤减轻,临床上特别容易误诊为ET。同时震颤型NIID,也可以表现为明显的静止性震颤,呈不对称性,在合并僵直和运动迟缓症状的同时,特别容易与PD相互混淆,为临床上鉴别诊断带来挑战。
既往关于NIID的研究发现其临床主要表现为认知障碍、发作性脑病、自主神经功能障碍、周围神经损伤、帕金森综合征、震颤、共济失调、肌肉无力等,但是具体针对震颤型NIID的研究较少,本研究专门针对容易误诊的震颤型NIID进行研究,总结其临床特点和震颤规律,为后期临床诊断提供帮助。
震颤分析作为一种可重复性检查,通过采集患者的表面肌电,为临床上震颤提供客观的电生理指标,目前临床上关于NIID表面肌电的研究较少,既往研究发现NIID以姿势性震颤常见,优势频率为4~6 Hz,以同步节律为主,无谐波频谱。本研究进一步探讨PD、ET以及NIID震颤的表面肌电特点,为临床上三组疾病的鉴别提供客观的电生理指标。
1 资料与方法
1.1 研究对象
收集首都医科大学宣武医院神经内科帕金森及运动障碍病诊疗中心2021年10月—2024年12月收治的73例患者。PD诊断依据中华医学会神经病学分会帕金森病及运动障碍学组2016年制定的“中国帕金森病的诊断标准”,入组单纯静止性震颤的典型PD,出现姿势性或者意向性震颤的患者不入组。ET诊断依据中华医学会神经病学分会帕金森病及运动障碍学组2020年制定的“中国原发性震颤的诊断和治疗指南”及最新的国际震颤分类共识,入组单纯姿势性和意向性震颤的典型ET,合并静止性震颤或者肌张力障碍的ET叠加综合征患者不入组。NIID的诊断符合如下标准:(1)以认知障碍、帕金森综合征、自主神经症状、周围神经损伤、卒中样发作、脑炎发作等为主要临床表现;(2)头部核磁弥散加权成像显示皮髓交界区高信号;(3)基因检测在NOTCH2NLC基因5’-非翻译区的GGC重复序列数>60;(4)皮肤活检显示,HE染色在脂肪细胞、成纤维细胞、汗腺细胞显示嗜酸性核内包涵体,免疫组织化学染色显示抗p62阳性,所有入组的NIID患者均伴有震颤症状。本研究的排除标准:(1)实验前24 h内使用影响震颤药物;(2)试验前2 h服用含咖啡因等影响震颤饮料;(3)认知功能障碍或精神疾病不能配合进行检查;严重心肺功能疾病无法配合检查。
1.2 数据采集
数据采集使用美国Nicolet EDX十导肌电图仪(Natus Neurology Incorporated, Middleton, WI USA),4对肌电图表面电极采集双上肢表面肌电信号,低频滤波:2.0 Hz,高频滤波:1 000.0 Hz;2个压阻加速计采集双上肢震颤的物理信号,低频滤波:0.5 Hz,高频滤波:30.0 Hz。所有通道采样频率均设置为1 000.0 Hz。双上肢的桡侧腕伸肌和桡侧腕屈肌的肌腹作为记录电极的位置,相应的肌腱作为参考电极的位置,双手手背第3掌骨远端作为加速器电极固定的位置。静止和姿势状态下分别采集表面肌电,每种状态记录时间为30 s。
1.3 电生理信号分析
应用Spike 2软件导入表面肌电数据,观察原始肌电信号特点,并进行初步分析。应用MATLAB进行功率谱分析:采用Welch方法,选择Hanning窗,窗宽设置为2 s,50%重叠,分辨率设置0.5 Hz,振荡活动的阈值界定为0~100 Hz平均功率谱标准差的5倍,大于该阈值认为该肌电有振荡活动;小于该阈值,则认为无振荡活动。最后通过Origin 7.0进行图形绘制和处理。本研究的数据分析应用Spike 2(Cambridge Electronic Design,UK)、MATLAB (MathWorks,Natick,MA,USA)和Origin 7.0(OriginLab,USA)软件。
1.4 统计学方法
采用SPSS 27.0软件,最终结果采用(x±s)表示。通过单因素方差分析比较计量资料,通过卡方检验比较计数资料。P<0.05为差异有统计学意义。
2 结 果
2.1 一般资料
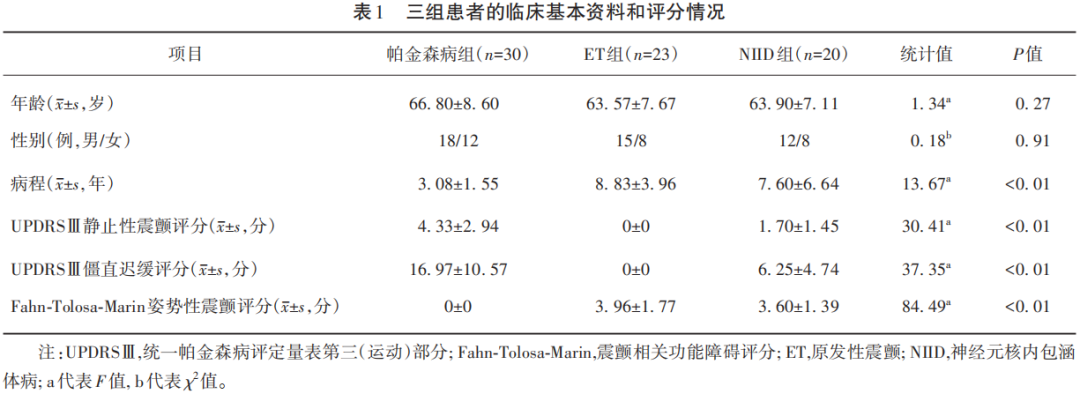
最终入组PD 30例,ET 23例,NIID 20例,三组患者的年龄和性别差异无统计学意义(P>0.05),NIID和ET组的病程大于PD组(P<0.01)。符合入组标准患者行电生理检查前分别评估Fahn-Tolosa-Marin震颤评分和UPDRSⅢ评分,三组患者的详细临床基本资料和评分情况见表1。
2.2 震颤分布
PD在静止状态下出现震颤,双侧肢体的震颤分布呈不对称性;ET在姿势状态下出现震颤,双侧肢体的震颤分布呈对称性;NIID在静止和姿势状态下均出现明显的震颤,双侧肢体的震颤呈现相对对称分布,介于PD的不对称和ET的对称之间。图1展示三组震颤的原始数据,PD震颤左右明显不对称,ET震颤左右对称,NIID介于二者之间。PD合并下肢震颤的比例为90%(27/30),ET合并下肢震颤的比例为0%(0/23),而NIID合并下肢震颤的比例为20%(4/20),比较发现PD合并下肢震颤的比例高于NIID(χ2=24.96,P<0.01),NIID高于ET(χ2=5.07,P=0.02)。PD合并头部震颤的比例为0%(0/30),ET合并头部震颤的比例为52%(12/23),而NIID合并头部震颤的比例为40%(8/20),比较发现ET(χ2=20.23,P<0.01)和NIID(χ2=14.29,P<0.01)合并头部震颤的比例高于PD,而ET和NIID比较差异无统计学意义(χ2=0.64,P=0.43)。

2.3 震颤频率
本研究通过功率谱分析计算PD、ET、NIID的震颤频率,发现PD在静止状态下出现震颤,震颤频率为(4.81±0.61) Hz;ET在姿势状态下出现震颤,震颤频率为(6.07±0.68) Hz;NIID在静止和姿势状态下均有明显的震颤,静止状态下的震颤频率为(4.20±0.47) Hz;姿势状态下的震颤频率为(4.37±0.52) Hz。三组震颤频率比较发现,ET的震颤频率高于PD (F=41.86,P<0.01),PD的震颤频率高于NIID静止状态(F=41.86,P=0.002)和NIID姿势状态(F=41.86,P=0.011),而NIID在静止状态和在NIID姿势状态下的震颤频率比较差异无统计学意义(F=41.86,P=0.411)。
2.4 震颤幅度
本研究对三组疾病的震颤幅度进行比较,PD的震颤幅度为(1 057.40±354.52) µV,ET的震颤幅度为(1 200.91±360.69) µV,NIID在静止和状态下的震颤幅度分别为(1 161.29±402.63) µV和(1 247.25±390.73) µV。进一步比较发现三组的震颤幅度没有统计学差异(F=1.21,P=0.31),提示临床上不能通过震颤幅度来鉴别三组疾病。
2.5 收缩模式
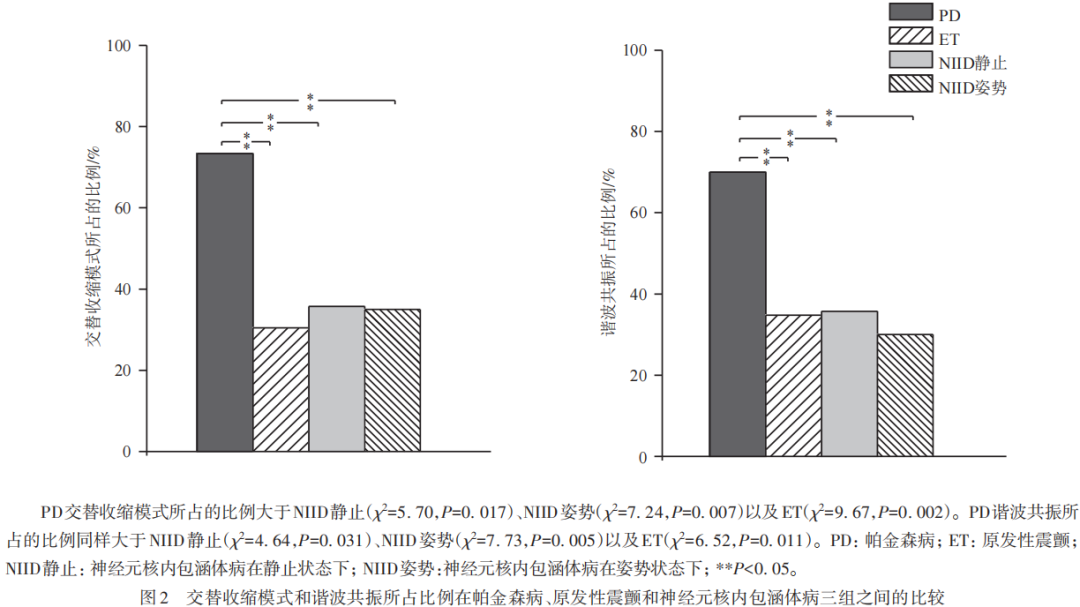
本研究总结了三组患者收缩模式所占的比例,发现PD交替收缩模式所占的比例为73.33%(22/30),在三组疾病中是最高的;ET交替收缩模式所占的比例偏低,为30.43%(7/23);NIID静止和姿势状态下交替收缩模式所占的比例分别为35.71%(5/14)和35%(7/20),二者相差不大。比较发现,PD交替收缩模式所占的比例高于NIID静止状态(χ2=5.70,P=0.017)和姿势状态(χ2=7.24,P=0.007),同时高于ET(χ2=9.67,P=0.002),而ET交替收缩所占的比例与NIID静止状态(χ2=0.11,P=0.74)和姿势状态(χ2=0.10,P=0.75)比较差异无统计学意义(见图2)。
2.6 谐波共振
关于三组疾病谐波共振的研究发现,PD谐波共振所占的比例高达70%(21/30),ET所占的比例为34.78%(8/23),NIID静止状态下谐波共振所占的比例为35.71%(5/14),NIID姿势状态下所占的比例为30%(6/20)。比较发现,PD谐波共振所占的比例高于NIID静止状态(χ2=4.64,P=0.031)、姿势状态(χ2=7.73,P=0.005)以及ET(χ2=6.52,P=0.011)。NIID静止状态(χ2=0.003,P=0.954)和姿势状态(χ2=0.111,P=0.739)所占的比例与ET比较无差异(见图2)。提示谐波共振所占的比例越高,越支持PD的诊断。
3 讨 论
本研究发现PD、ET、NIID震颤具有自己独特的特点,从震颤分布的角度,NIID双侧肢体的震颤呈相对对称分布,介于PD的不对称和ET的对称之间;从震颤频率的角度看,呈现ET>PD>NIID的特点;PD交替收缩模式所占的比例和谐波共振所占的比例高于ET和NIID。
从病理生理的角度,PD的生理机制与黑质-基底节-丘脑-皮质环路相关,因此PD的震颤合并该环路皮质抑制所带来的僵直迟缓症状。ET的病理征生理机制与小脑环路密切相关,因此ET往往合并与小脑密切相关的意向性震颤。文献报道在NIID小脑齿状核中发现了嗜酸性核内包涵体,提示小脑齿状核参与了NIID的震颤,也有学者认为NIID震颤可能与齿状核-丘脑束受累相关,O’Sullivan等报道了NIID尸检时观察到黑质中广泛的透明核内包涵体和神经元耗竭,提示黑质系统也参与了NIID的病理生理过程。
NIID震颤呈现双侧肢体相对对称分布,在临床上表现为没有帕金森偏侧,没有原发性震颤对称,推测NIID的震颤既有基底节环路带来的不对称性震颤成分,同时又合并小脑环路及周围神经损伤带来的对称性震颤成分参与。
既往研究发现部分NIID以震颤起病,本研究发现NIID的震颤频率位于3.6~6 Hz之间,与既往研究结果一致,本研究比较发现NIID的震颤频率低于PD和ET,NIID与PD和ET相比,更容易伴随周围神经损伤,因此推测可能与周围神经损伤有关。从常见的震颤相关疾病来看,PD的震颤频率是偏低的,本研究发现NIID的震颤频率比PD频率更低,提示在临床上碰到低震颤频率疾病时,除了常见的红核震颤,还要想到鉴别NIID。而震颤幅度在三组间比较发现差异无统计学意义,提示临床上不能通过震颤幅度来做三组疾病的鉴别。
本研究发现,交替收缩模式所占的比例在PD中最高,提示交替收缩模式所占的比例越高,越倾向于是PD。王颖等采集16例伴震颤的NIID,未发现谐波共振现象,本研究发现NIID患者可以合并谐波共振,但是谐波共振发生率小于PD,该研究结果不一致可能与患者的选择不同有关,本研究选取的研究对象均以震颤为主要表现,认知障碍和肌病表现不突出,另外NOTCH2NLC基因5’端非翻译区GGC重复扩增次数不同,也可能导致谐波共振出现的比例不一致。
NIID因病史长,伴随家族史,姿势性和意向性震颤突出,临床上特别容易误诊为ET,本研究发现,NIID与ET相比其累及的范围更广泛,容易伴随认知功能下降、双侧针尖样小瞳孔、尿潴留、肾功能损伤等,因嗜酸性核内包涵体不仅存在于神经元以及星型胶质细胞内,也存在于几乎所有的体细胞相关,而ET往往只有震颤,不伴随以上症状。本研究还发现NIID的震颤与ET相比,震颤分布相对不对称。本研究通过震颤分析采集双上肢表面肌电,发现NIID的震颤频率低于ET,因此可以通过震颤分析检测震颤频率来协助临床鉴别。NIID也可以表现为突出的静止震颤,临床上容易跟PD相混淆,研究发现,虽然NIID头部MRI并不是都表现为典型的皮髓交界区“绸带征”,但该病头部MRI容易出现脑萎缩、脑白质变性、脑积水等异常,而PD的头部MRI往往是正常的。NIID容易在发病早期伴随认知障碍,而PD往往在疾病中晚期才出现明显的认知功能下降,从震颤分布的角度讲,NIID的静止性震颤比PD对称,震颤频率低于PD,因此可以通过震颤分析检测震颤频率和对称性来协助临床鉴别诊断。
本研究从临床和电生理的角度为PD、ET和NIID的鉴别提供了思路。同时本研究发现,NIID患者头部MRI并不是都表现为典型的影像学“绸带征”,如果临床上遇到不典型震颤,既合并类似PD的静止性震颤,同时合并类似ET的姿势性震颤时,临床医生要想到鉴别NIID,可行震颤分析,通过表面肌电特点来帮助鉴别诊断。本研究的局限性是样本量偏少,可进一步加大样本量,来帮助临床进行PD、ET和NIID的鉴别。
参考文献
[1]BhatiaKP,BainP,BajajN,etal.Consensusstatementontheclassificationoftremors.FromthetaskforceontremoroftheInternationalParkinsonandMovementDisorderSociety[J].MovDisord,2018,33(1):75-87.
[2]TaiH,WangA,ZhangY,etal.Clinicalfeaturesandclassificationofneuronalintranuclearinclusiondisease[J].NeurolGenet,2023,9(2):e200057.
[3]JagotaP,LimSY,PalPK,etal.Geneticmovementdisorderscommonlyseeninasians[J].MovDisordClinPract,2023,10(6):878-895.
[4]TianY,HouX,CaoW,etal.DiagnosticvalueofnerveconductionstudyinNOTCH2NLC-relatedneuronalintranuclearinclusiondisease[J].JPeripherNervSyst,2023,28(4):629-641.
[5]SoneJ,MoriK,InagakiT,etal.Clinicopathologicalfeaturesofadult-onsetneuronalintranuclearinclusiondisease[J].Brain,2016,139(Pt12):3170-3186.
[6]YangD,CenZ,WangL,etal.Neuronalintranuclearinclusiondiseasetremor-dominantsubtype:amimickerofessentialtremor[J].EurJNeurol,2022,29(2):450-458.
[7]ChenH,LuL,WangB,etal.EssentialtremorastheearlysymptomofNOTCH2NLCgene-relatedrepeatexpansiondisorder[J].Brain,2020,143(7):e56.
[8]KitagawaN,SoneJ,SobueG,etal.Neuronalintranuclearinclusiondiseasepresentingwithrestingtremor[J].CaseRepNeurol,2014,6(2):176-180.
[9]LaiSC,JungSM,Grattan-SmithP,etal.Neuronalintranuclearinclusiondisease:twocasesofdopa-responsivejuvenileParkinsonismwithdrug-induceddyskinesia[J].MovDisord,2010,25(9):1274-1279.
[10]O’SullivanJD,HanagasiHA,DanielSE,etal.NeuronalintranuclearinclusiondiseaseandjuvenileParkinsonism[J].MovDisord,2000,15(5):990-995.
[11]ChenH,LuL,WangB,etal.Re-definingtheclinicopathologicalspectrumofneuronalintranuclearinclusiondisease[J].AnnClinTranslNeurol,2020,7(10):1930-1941.
[12]TianY,ZhouL,GaoJ,etal.ClinicalfeaturesofNOTCH2NLC-relatedneuronalintranuclearinclusiondisease[J].JNeurolNeurosurgPsychiatry,2022,93(12):1289-1298.
[13]LiuY,LiH,LiuX,etal.Clinicalandmechanismadvancesofneuronalintranuclearinclusiondisease[J].FrontAgingNeurosci,2022,14:934725.
[14]王颖,潘华,翦凡,等.伴震颤的神经元核内包涵体病患者临床及电生理特点分析[J].中华神经科杂志,2023,56(12):1381-1388.
[15]中华医学会神经病学分会帕金森病及运动障碍学组,中国医师协会神经内科医师分会帕金森病及运动障碍专业.中国帕金森病的诊断标准(2016版)[J].中华神经科杂志,2016,49(4):268-271.
[16]中华医学会神经病学分会帕金森病及运动障碍学组,中国医师协会神经内科医师分会帕金森病及运动障碍学组.中国原发性震颤的诊断和治疗指南(2020)[J].中华神经科杂志,2020,53(12):987-995.
[17]NgASL,XuZ,ChenZ,etal.NOTCH2NLC-linkedneuronalintranuclearinclusionbodydiseaseandfragileX-associatedtremor/ataxiasyndrome[J].Brain,2020,143(8):e69.
[18]YauWY,VandrovcovaJ,SullivanR,etal.LowprevalenceofNOTCH2NLCGGCrepeatexpansioninwhitepatientswithmovementdisorders[J].MovDisord,2021,36(1):251-255.
[19]QuirogaRQ.Spikesorting[J].CurrBiol,2012,22(2):R45-R46.
[20]MoranA,BergmanH,IsraelZ,etal.Subthalamicnucleusfunctionalorganizationrevealedbyparkinsonianneuronaloscillationsandsynchrony[J].Brain,2008,131(Pt12):3395-3409.
[21]DuvalC,DaneaultJF,HutchisonWD,etal.AbrainnetworkmodelexplainingtremorinParkinson’sdisease[J].NeurobiolDis,2016,85:49-59.
[22]LaiHJ,DengCR,WangRW,etal.Thegenesisandfunctionalconsequencesofcortico-subthalamicbetaaugmentationandexcessivesubthalamicburstdischargesafterdopaminergicdeprivation[J].ExpNeurol,2022,356:114153.
[23]SharifiS,BuijinkAWG,LuftF,etal.Differencesinolivo-cerebellarcircuitandcerebellarnetworkconnectivityinessentialtremor:arestingstatefMRIstudy[J].Cerebellum,2023,22(6):1123-1136.
[24]FilipP,BurdováK,ValentaZ,etal.TremorassociatedwithsimilarstructuralnetworksinParkinson’sdiseaseandessentialtremor[J].ParkinsonismRelatDisord,2022,95:28-34.
[25]Munoz-GarciaD,LudwinSK.Adult-onsetneuronalintranuclearhyalineinclusiondisease[J].Neurology,1986,36(6):785-790.
[26]SugiyamaA,KojimaK,HiranoS,etal.Unilateralwing-beatingtremorinneuronalintranuclearinclusiondisease[J].CaseRepNeurol,2023,15(1):126-130.
[27]潘昕,杨晶晶,宋金辉,等.以震颤起病的成年散发型神经元核内包涵体病1例及文献复习[J].中风与神经疾病杂志,2024,41(9):835-838.
[28]刘文宇,杜晓伟,曹春艳,等.家族性神经元核内包涵体病的部分家系分析和文献复习[J].中风与神经疾病杂志,2023,40(2):151-153.
[29]薛晓帆,吴志悦,黄安琪,等.中国人群帕金森病轻度认知障碍综合认知域评估量表的筛选及诊断效度分析[J].中风与神经疾病杂志,2024,41(5):402-407.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言

















#帕金森病# #原发性震颤#
9
帕金森病原发性震颤神经元核包涵体震颤
1