论著|抗精神病药物所致体质量增加患者灰质体积变化的神经影像-转录分析
2025-01-07 中国神经精神疾病杂志 中国神经精神疾病杂志 发表于陕西省
本研究拟利用AHBA,应用神经影像-转录关联分析方法,探讨AIWG患者脑灰质体积改变相关基因表达及生物学通路,同时以体质量稳定的患者为对照,为揭示抗精神病药物诱导体质量增加的神经机制提供新依据。
摘 要
目的 探索抗精神病药物所致体质量增加的患者脑灰质体积变化及神经机制。
方法收集2019年10月至2021年12月上海市精神卫生中心收治的首发未用药精神分裂症患者129例,根据抗精神病药物治疗8周后体质量变化分为体质量增加组(weight gain, WG)(体质量较基线增加≥7%)和体质量稳定组(weight stable, WS)(体质量较基线变化<3%)。在治疗前后评估患者体质量并采集大脑MRI结构像。应用艾伦人脑图谱进行灰质体积改变与基因表达水平的空间相关分析,并进行基因注释分析。
结果纳入33例体质量增加患者和27例体质量稳定患者。与基线比较,WG组治疗后右侧海马、左侧基底节、右侧顶下小叶等脑区灰质体积减小,双侧丘脑灰质体积增加(P<0.05);WS组治疗后双侧眶回、双侧额下回和双侧海马等脑区灰质体积较基线减小(P<0.05),未发现灰质体积增加的脑区。神经影像-转录分析显示354个与WG组灰质体积改变相关的基因,这些基因特异性富集在库欣综合征、神经炎症和谷氨酸信号等通路,特异性表达在表达孤咖啡肽前体的神经元。
结论抗精神病药物所致体质量增加患者丘脑灰质体积增加,且与库欣综合征、表达孤咖啡肽前体的神经元等有关,这为抗精神病药所致体质量增加神经机制提供了新的线索。
关键词
精神分裂症;抗精神病药物;体质量增加;灰质体积;丘脑;艾伦人脑图谱;基因表达
抗精神病药物所致体质量增加(antipsychotic-induced weight gain,AIWG)是一个亟待解决的重要临床问题,目前其病理机制未明。影像学研究提示超重和肥胖患者存在特征性大脑结构改变[1-2],精神分裂症合并肥胖会引起更显著的大脑结构改变[3]。目前尚未有研究探讨抗精神病药物所致体质量增加的神经影像学机制。艾伦人脑图谱(Allen human brain atlas,AHBA)是整合了大脑基因表达的多模态人脑图集[4],用于研究药物干预对大脑结构及功能改变潜在的分子机制[5-6]。本研究拟利用AHBA,应用神经影像-转录关联分析方法,探讨AIWG患者脑灰质体积改变相关基因表达及生物学通路,同时以体质量稳定的患者为对照,为揭示抗精神病药物诱导体质量增加的神经机制提供新依据。
1 对象与方法
1.1 研究对象 本研究基于中国首发精神分裂症的多中心序贯治疗临床试验[7],纳入2019年10月至2021年12月上海市精神卫生中心住院的首发精神分裂症患者。入组标准:①符合《精神障碍诊断与统计手册第5版》(Diagnostic and Statistical Manual of Mental Disorders, 5th Edition, DSM-5)精神分裂症的诊断标准;②年龄16~45岁;③首次发作,总病程<3年;④从未服用或连续服用抗精神病药物<2周,累计用药时间<6周;⑤阳性与阴性症状量表(positive and negative syndrome scale, PANSS)总分>70分,且P1妄想、P2概念紊乱、P3幻觉行为、P5夸大和P6猜疑/被害条目中至少1项评分≥4分;⑥临床总体印象严重程度量表(clinical global impression-severity scale,CGI-S)评分≥4分;⑦在该临床试验[7]中经8周治疗后有效(PANSS减分率≥40%),且体质量较基线增加≥7%或变化<3%。排除标准:①患有任何严重或不稳定的躯体疾病;②有精神活性物质依赖;③精神发育迟滞;④妊娠、计划妊娠或哺乳期女性;⑤不合作或存在风险的患者。本研究方案通过上海市精神卫生中心伦理委员会批准,所有患者自愿签署知情同意书。
该临床试验[7]中所有患者将随机接受抗精神病药物(奥氮平、利培酮、奋乃静、氨磺必利或阿立哌唑)单一治疗8周,治疗有效患者(PANSS减分率≥40%)纳入本研究分析。根据治疗8周后患者体质量变化进行分组,体质量较基线增加≥7%定义为体质量增加组(weight gain, WG)[8],体质量较基线变化<3%定义为体质量稳定组(weight stable, WS)。本研究129例患者接受抗精神病药物治疗,其中82例患者治疗有效,本研究最终纳入WG组33例,WS组28例患者。
1.2 灰质体积采集及计算 在基线和抗精神病药物治疗第8周,应用3.0 T西门子超导型磁共振仪进行影像数据采集,扫描序列为T1加权3D梯度回波成像序列。扫描参数:层厚1 mm,重复时间2530 ms,回波时间3.65 ms,视野256 mm×256 mm,体素1 mm×1 mm×1 mm。采用SPM 12软件包和CAT 12工具箱计算灰质体积。具体过程:空间标准化,偏置场校正,组织分割,图像归一化,对标准化灰质体积图像进行8 mm半高全宽高斯核平滑,获得基于体素的灰质体积。
1.3 统计学方法 使用SPSS 20.0进行一般资料分析,两组年龄、受教育年限、基线体质量指数(body mass index,BMI)和PANSS评分的比较采用独立样本t检验,性别的比较采用χ2检验。应用配对t检验比较灰质体积治疗前后的改变。检验水准α=0.05,双侧检验。
1.4 神经影像-转录分析 AHBA(http://human.brain-map.org)基因表达数据预处理[4, 9]:使用Re-annotator数据包更新探针到基因重注释;去除未超过50%背景噪声的探针;选择与RNA-seq数据高度相关的探针;将芯片样本映射到Brainnetom图谱;对AHBA数据集中每个捐献者脑基因表达量值进行sigmoid归一化处理;基于差异稳定性行基因集过滤。对AHBA预处理后的100027个基因表达数据和治疗前后左半球123个脑区灰质体积变化进行神经影像-转录关联分析。使用软件SIMCA 14.1(Umetrics,Sweden)进行偏最小二乘法回归分析[5, 10-11],自变量为基因表达水平,因变量为治疗前后的灰质体积变化统计量t值,并对其进行置换检验[11]。选择变量投影重要性(variable importance in projection, VIP)评分>1.5筛选灰质体积改变相关基因。使用Metascape数据库(http://metascape.org)进行生物过程富集分析。应用细胞类型特异性表达分析在线数据库(http://genetics.wustl.edu/jdlab/csea-tool-2/)进行细胞类型表达分析[12]。
2 结果
2.1 基本信息 与WS组比较,WG组患者女性比例更高(χ2=4.848,P=0.028),基线BMI水平更低(t=-3.667,P<0.001),两组在年龄、受教育年限和PANSS总分差异无统计学意义(P>0.05)。见表1。
表1 纳入研究对象的基线特征Tab.1 Characteristics of the patients at baseline
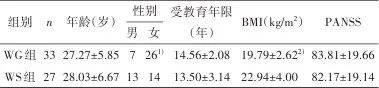
注:WG,体质量增加;WS,体质量稳定;BMI,体质量指数;PANSS,阳性与阴性症状量表。1)与WS组比较,经χ2检验,P<0.05;2)与WS组比较,经独立样本t检验,P<0.05。
2.2 灰质体积变化 与基线比较,WG组治疗后右侧海马、左侧基底节、右侧顶下小叶等脑区灰质体积减小(P<0.05),双侧丘脑灰质体积增加(P<0.05)。WS组治疗后双侧眶回、双侧额下回、双侧海马等脑区灰质体积低于治疗前(P<0.05),未发现灰质体积增加的脑区。见图1。
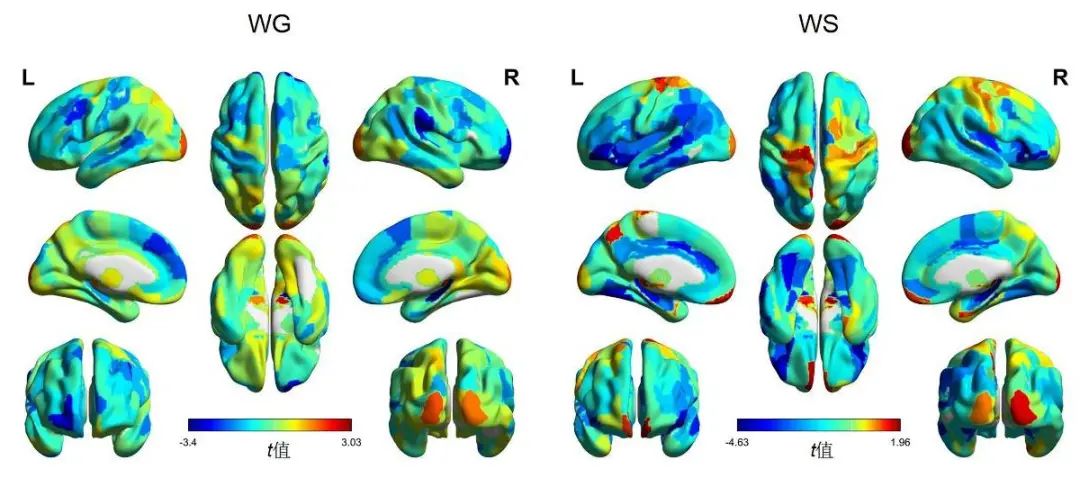
图1 WG组和WS组治疗前后灰质体积变化 注:WG,体质量增加组;WS,体质量稳定组。色柱图代表治疗前后灰质体积比较t值。Fig.1 Gray matter volume changes before and after treatment in the WG group and the WS group
2.3 富集分析 神经影像-转录分析结果显示,354个和294个基因分别与WG组和WS组灰质体积改变相关。富集分析显示:WG组基因特异性富集在库欣综合征、神经炎症和谷氨酸信号等通路;WS组基因特异性富集在阴离子运输调控通路。见图2。细胞类型特异性表达分析如图3和表2所示:WG组灰质体积改变相关基因特异性表达在表达孤咖啡肽前体(Pnoc+)和皮质丘脑(Ntsr+)神经元,且前者特异性表达更加稳定;WS组灰质体积改变相关基因在免疫细胞(Immu)和皮质脑桥(Glt25d2)神经元中特异性表达。
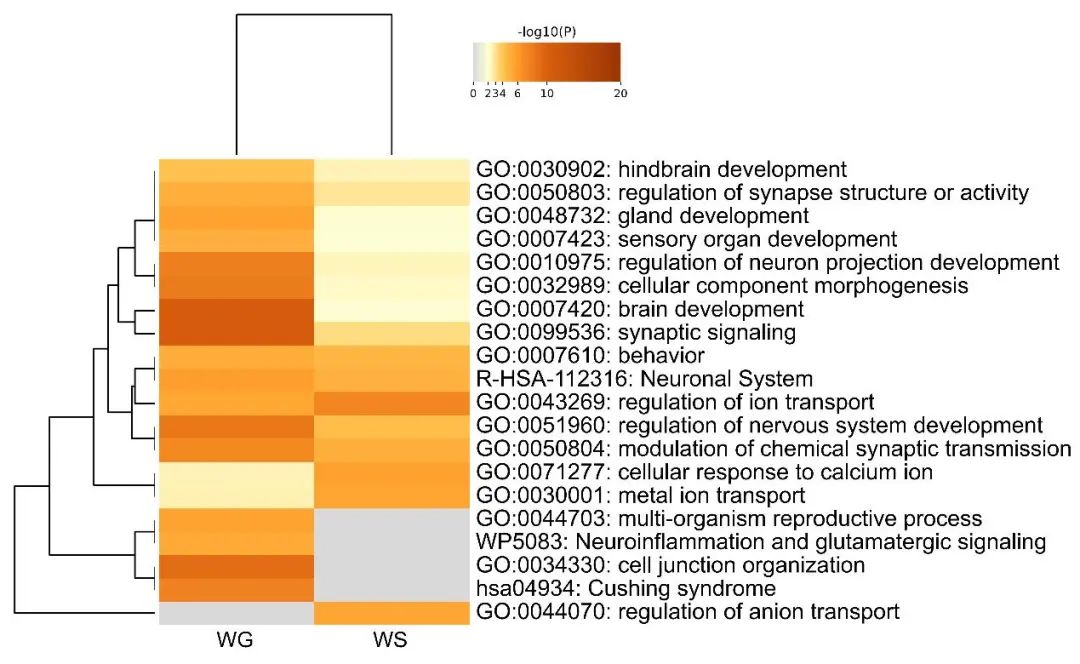
图2 WG组及WS组灰质体积改变相关基因代表性的生物学过程 注:WG,体质量增加组;WS,体质量稳定组。热图颜色从棕色到灰色分别表示P值从低到高。Fig.2 Heatmaps of GO enriched terms for biological processes of the genes associated with GMV changes in the WG group and the WS group
表2 灰质体积变化相关基因细胞类型特异性表达分析Tab 2 Cell type-specific expression of the genes associated with GMV changes
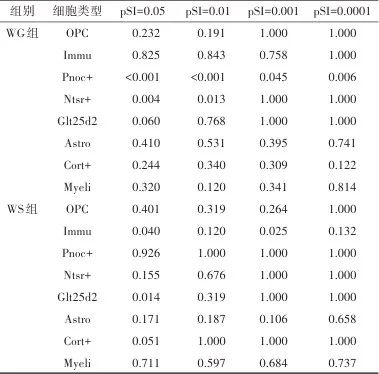
注:WG,体质量增加组;WS,体质量稳定组;OPC,少突胶质细胞;Immu,免疫细胞;Pnoc+,表达孤咖啡肽前体的神经元;Ntsr+,皮质丘脑神经元;Glt25d2,皮质脑桥神经元;Astro,星形胶质细胞;Cort+,表达皮质抑素的中间神经元;Myeli,髓鞘少突胶质细胞;pSI,特异性指数概率。
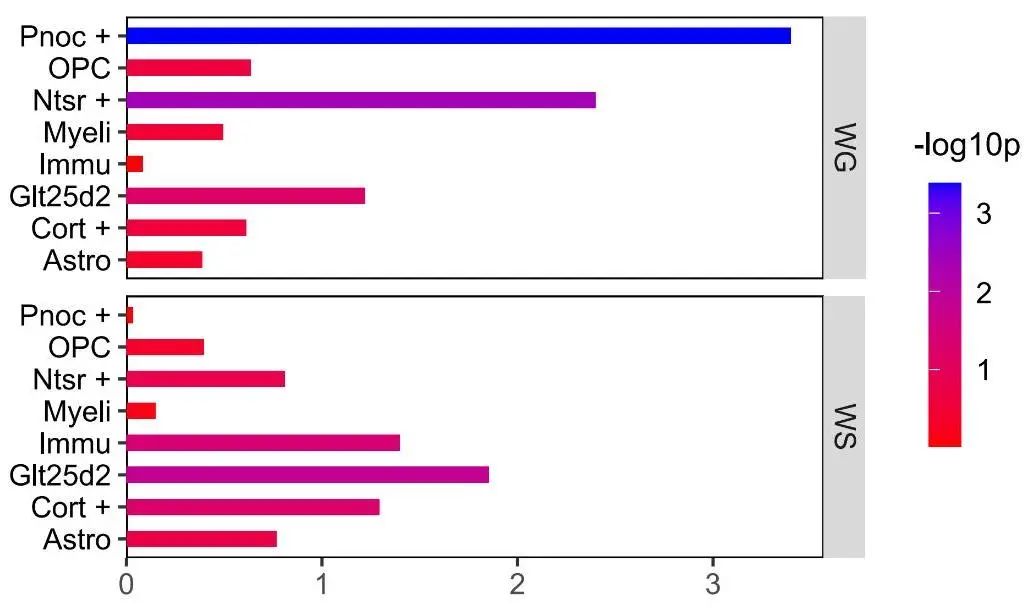
图3 WG组及WS组灰质体积变化相关基因细胞类型特异性表达分析(pSI=0.05) 注:WG,体质量增加组;WS,体质量稳定组;Pnoc+,表达孤咖啡肽前体的神经元;OPC,少突胶质细胞;Ntsr+,皮质丘脑神经元;Immu,免疫细胞;Glt25d2,皮质脑桥神经元;Cort+,表达皮质抑素的中间神经元;Astro,星形胶质细胞;Myeli,髓鞘少突胶质细胞;pSI,特异性指数概率。Fig.3 Cell type-specific expression of the genes associated with GMV changes in the WG group and the WS group (pSI=0.05)
3 讨论
本研究通过对首发未用药的精神分裂症患者进行随机对照临床试验,纵向追踪AIWG患者大脑灰质体积变化,同时以体质量稳定患者为同期对照,探索AIWG的神经影像学机制。
本研究发现,经过8周抗精神病药物单一治疗,WG组多处脑区灰质体积减小,这与既往研究报道[13-15]一致。而WG患者存在特征性丘脑灰质体积增加。目前丘脑灰质体积与肥胖的关系研究报道尚不一致。横断面研究表明肥胖患者丘脑灰质体积明显缩小[16-17],也有研究报道下丘脑体积与BMI呈正相关[18]。一项大型研究纳入690名男性和738名女性健康被试者,发现女性的BMI水平与丘脑体积存在正相关关系,而在男性中未发现此相关关系[19],提示丘脑灰质体积与BMI的关系可能存在性别差异。临床研究表明长期接受抗精神病药物治疗,女性精神分裂症患者的肥胖率远高于男性[20]。目前AIWG和丘脑的相关研究较少,需进一步探索AIWG的性别差异。
本研究结果表明AIWG与库欣综合征、神经炎症和谷氨酸信号通路有关。库欣综合征是一系列高皮质醇引发的代谢性疾病,典型临床表现为向心性肥胖、满月脸、多血质、水牛背、高血压和糖脂代谢异常等[21]。AIWG不仅与库欣综合征临床表现类似,还可能与皮质醇代谢有关。有研究表明抗精神病药物治疗12个月,皮质醇水平变化与代谢综合征的发生相关[22]。另一项研究纳入1791例接受奥氮平或氯氮平治疗的严重精神障碍患者,发现男性患者血清皮质醇浓度和甘油三酯水平相关[23]。meta分析研究表明代谢综合征患者血清皮质醇、唾液皮质醇、尿液皮质醇、头发皮质醇的浓度均显著升高[24]。另外,肥胖会导致全身低度慢性炎症状态[25]。来自动物和人体研究均表明AIWG与炎症反应相关[26]。奥氮平喂养的雌性小鼠体质量明显增加,且血浆白细胞介素(白介素-8和白介素-1β)水平明显升高[27]。与健康对照相比较,肥胖症患者血清谷氨酸水平升高,并与多形拟杆菌浓度呈负相关,而对高脂饮食喂养的小鼠移植多形拟杆菌后,小鼠体质量增加速度减慢,血清谷氨酸含量也明显减少[28]。波谱磁共振研究显示,首发未用药的精神分裂症患者丘脑谷氨酸浓度高于健康对照组[29],而稳定期精神分裂症患者脑内谷氨酸浓度降低[30]或保持不变[31],提示抗精神病药物治疗可能降低脑内谷氨酸浓度。结合本研究结果推测,AIWG可能与抗精神病药物影响脑内谷氨酸浓度和HPA轴分泌有关[32]。
本研究还发现AIWG与Pnoc+神经元表达有关。AIWG患者常伴有食物渴求增加和暴食行为[33-34]。研究报道进食美味的食物可激活杏仁核的Pnoc+神经元,并进一步促进对美食的进食行为[35]。高脂饮食喂养可激活小鼠下丘脑弓状核的Pnoc+神经元,并抑制与厌食相关神经元,从而导致摄食行为的增多[36]。以上结果提示,Pnoc+神经元与AIWG病理机制有关,但仍需要基础研究进一步验证。
本研究存在不足之处:首先,样本量相对较小,研究对象接受5种抗精神病药物单一治疗,无法探讨不同种类药物引起体质量增加的机制;其次,由于AHBA右半球样本量小,本研究仅对左半球基因表达数据进行分析,因此抗精神病药所致体质量增加灰质体积变化的相关基因无法反映整个大脑的情况,一定程度上影响了研究结果。本研究为探索性研究,首次通过神经影像-转录关联方法建立了抗精神病药所致体质量增加灰质体积变化和分子生物学间的联系,为抗精神病药所致体质量增加神经机制提供了新的线索,未来仍需要针对特定抗精神病药物进行深入研究。
参考文献:
1. HAN Y P, TANG X, HAN M, et al. Relationship between obesity and structural brain abnormality: Accumulated evidence from observational studies[J]. Ageing Res Rev, 2021, 71: 101445.
2. LI L, YU H, ZHONG M, et al. Gray matter volume alterations in subjects with overweight and obesity: Evidence from a voxel-based meta-analysis[J]. Front Psychiatry, 2022, 13: 955741.
3. MCWHINNEY S R, BROSCH K, CALHOUN V D, et al. Obesity and brain structure in schizophrenia - ENIGMA study in 3021 individuals[J]. Mol Psychiatry, 2022, 27(9): 3731-3737.
4. HAWRYLYCZ M J, LEIN E S, GUILLOZET-BONGAARTS A L, et al. An anatomically comprehensive atlas of the adult human brain transcriptome[J]. Nature, 2012, 489(7416): 391-399.
5. MARTINS D, DIPASQUALE O, DAVIES K, et al. Transcriptomic and cellular decoding of functional brain connectivity changes reveal regional brain vulnerability to pro- and anti-inflammatory therapies[J]. Brain Behav Immun, 2022, 102: 312-323.
6. PRELLER K H, DUERLER P, BURT J B, et al. Psilocybin induces time-dependent changes in global functional connectivity[J]. Biol Psychiatry, 2020, 88(2): 197-207.
7. LI X, GUO X, FAN X, et al. Sequential multiple-assignment randomized trials to compare antipsychotic treatments (SMART-CAT) in first-episode schizophrenia patients: Rationale and trial design[J]. Schizophr Res, 2021, 230: 87-94.
8. CORRELL C U, NEWCOMER J W, SILVERMAN B, et al. Effects of olanzapine combined with samidorphan on weight gain in schizophrenia: A 24-week phase 3 study[J]. Am J Psychiatry, 2020, 177(12): 1168-1178.
9. GRUBISHA M J, SUN T, EISENMAN L, et al. A Kalirin missense mutation enhances dendritic RhoA signaling and leads to regression of cortical dendritic arbors across development[J]. Proc Natl Acad Sci U S A, 2021, 118(49): e2022546118.
10. LI J, SEIDLITZ J, SUCKLING J, et al. Cortical structural differences in major depressive disorder correlate with cell type-specific transcriptional signatures[J]. Nat Commun, 2021, 12(1): 1647.
11. ROMERO-GARCIA R, SEIDLITZ J, WHITAKER K J, et al. Schizotypy-related magnetization of cortex in healthy adolescence is colocated with expression of schizophrenia-related genes[J]. Biol Psychiatry, 2020, 88(3): 248-259.
12. XU X, LI Q, QIAN Y, et al. Genetic mechanisms underlying gray matter volume changes in patients with drug-naive first-episode schizophrenia[J]. Cereb Cortex, 2023, 33(5): 2328-2341.
13. GIRGIS R R, DIWADKAR V A, NUTCHE J J, et al. Risperidone in first-episode psychosis: A longitudinal, exploratory voxel-based morphometric study[J]. Schizophr Res, 2006, 82(1): 89-94.
14. 项琼, 王颖婵, 朱殿明, 等. 精神分裂症患者急性期药物治疗前后的脑灰质变化[J]. 上海交通大学学报(医学版), 2017, 37(2): 203-206.
15. ZHANG X, ZHANG Y, LIAO J, et al. Progressive grey matter volume changes in patients with schizophrenia over 6 weeks of antipsychotic treatment and their relationship to clinical improvement[J]. Neurosci Bull, 2018, 34(5): 816-826.
16. NOUWEN A, CHAMBERS A, CHECHLACZ M, et al. Microstructural abnormalities in white and gray matter in obese adolescents with and without type 2 diabetes[J]. Neuroimage Clin, 2017, 16: 43-51.
17. HIDESE S, OTA M, MATSUO J, et al. Association of body mass index and its classifications with gray matter volume in individuals with a wide range of body mass index group: A whole-brain magnetic resonance imaging study[J]. Front Hum Neurosci, 2022, 16: 926804.
18. LE T M, LIAO D L, IDE J, et al. The interrelationship of body mass index with gray matter volume and resting-state functional connectivity of the hypothalamus[J]. Int J Obes (Lond), 2020, 44(5): 1097-1107.
19. TAKI Y, KINOMURA S, SATO K, et al. Relationship between body mass index and gray matter volume in 1,428 healthy individuals[J]. Obesity (Silver Spring), 2008, 16(1): 119-124.
20. 许宏, 周勇杰, 曾玲芸, 等. 慢性精神分裂症患者代谢综合征发生率及代谢指标的性别差异研究[J]. 中国神经精神疾病杂志, 2021, 47(11): 656-660.
21. SAVAS M, MEHTA S, AGRAWAL N, et al. Approach to the patient: Diagnosis of cushing syndrome[J]. J Clin Endocrinol Metab, 2022, 107(11): 3162-3174.
22. VAN DEN HEUVEL L L, SMIT A M, STALDER T, et al. Hair cortisol levels in schizophrenia and metabolic syndrome[J]. Early Interv Psychiatry, 2022, 16(8): 902-911.
23. JOHANSEN I T, STEEN N E, HARAM M, et al. Sex differences in antipsychotic-related triglyceride levels are associated with metabolic hormone differences in patients with severe mental disorders[J]. Schizophr Res, 2022, 243: 55-63.
24. OSEI F, BLOCK A, WIPPERT P M. Association of primary allostatic load mediators and metabolic syndrome (MetS): A systematic review[J]. Front Endocrinol (Lausanne), 2022, 13: 946740.
25. BAPAT S P, WHITTY C, MOWERY C T, et al. Obesity alters pathology and treatment response in inflammatory disease[J]. Nature, 2022, 604(7905): 337-342.
26. 赵青, 李红娜, 陈大春. 脂联素在抗精神病药导致体质量增加中的作用研究进展[J]. 中国神经精神疾病杂志, 2020, 46(2): 117-120.
27. DAVEY K J, O’MAHONY S M, SCHELLEKENS H, et al. Gender-dependent consequences of chronic olanzapine in the rat: Effects on body weight, inflammatory, metabolic and microbiota parameters[J]. Psychopharmacology (Berl), 2012, 221(1): 155-169.
28. LIU R, HONG J, XU X, et al. Gut microbiome and serum metabolome alterations in obesity and after weight-loss intervention[J]. Nat Med, 2017, 23(7): 859-868.
29. BOJESEN K B, BROBERG B V, FAGERLUND B, et al. Associations between cognitive function and levels of glutamatergic metabolites and gamma-aminobutyric acid in antipsychotic-naive patients with schizophrenia or psychosis[J]. Biol Psychiatry, 2021, 89(3): 278-287.
30. KUMAR J, LIDDLE E B, FERNANDES C C, et al. Glutathione and glutamate in schizophrenia: A 7T MRS study[J]. Mol Psychiatry, 2020, 25(4): 873-882.
31. KRAGULJAC N V, REID M A, WHITE D M, et al. Regional decoupling of N-acetyl-aspartate and glutamate in schizophrenia[J]. Neuropsychopharmacology, 2012, 37(12): 2635-2642.
32. MURRAY S L, HOLTON K F. Effects of a diet low in excitotoxins on PTSD symptoms and related biomarkers[J]. Nutr Neurosci, 2022, 27(1): 1-11.
33. HUANG J, HEI G R, YANG Y, et al. Increased appetite plays a key role in olanzapine-induced weight gain in first-episode schizophrenia patients[J]. Front Pharmacol, 2020, 11: 739.
34. GARRIGA M, MALLORQUI A, SERRANO L, et al. Food craving and consumption evolution in patients starting treatment with clozapine[J]. Psychopharmacology (Berl), 2019, 236(11): 3317-3327.
35. HARDAWAY J A, HALLADAY L R, MAZZONE C M, et al. Central amygdala prepronociceptin-expressing neurons mediate palatable food consumption and reward[J]. Neuron, 2019, 102(5): 1088.
36. JAIS A, PAEGER L, SOTELO-HITSCHFELD T, et al. PNOC(ARC) neurons promote hyperphagia and obesity upon high-fat-diet feeding[J]. Neuron, 2020, 106(6): 1009-25 e10.
【引用格式】张素贞,蒯新平,高天昊,等. 抗精神病药物所致体质量增加患者灰质体积变化的神经影像-转录分析[J]. 中国神经精神疾病杂志,2024,50(9):540-545.
【Cite this article】HANG S Z,KUAI X P,GAO T H,et al.Molecular basis underlying gray matter volume changes in patients with AIWG: a transcriptome-neuroimaging study[J]. Chin J Nervous Mental Dis,2024,50(9):540-545.
DOI:10.3969/j.issn.1002-0152.2024.09.004
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言














#精神分裂症# #抗精神病药物#
8