病例分享 | 乳腺颗粒细胞瘤一例
2025-01-02 上海阿克曼病理 上海阿克曼病理 发表于陕西省
66 岁女性因 “右腋窝肿块 2 月” 入院,经乳腺超声、病理活检等检查,确诊为乳腺颗粒细胞瘤,文中阐述其临床、影像、病理特征,鉴别诊断及治疗预后,强调易误诊,手术切除多预后佳。
1病史:
女性,66岁,因“发现右腋窝肿块2月”入院。
2辅查:
乳腺超声:右侧乳尾部靠近右侧下见毛刺状小肿块影,邻近见迁曲血管影,两侧乳腺星多腺体型,腺体分布及退化欠均匀,见片状及结节样密度增高影,双乳未见恶性钙化及异常血管影,皮下脂肪层界限清晰。
影像考虑:右侧腋下近乳尾部肿块影( BIRADS分类:4类),需警惕乳Ca,建议活检。
3组织病理活检
3.1大体肉眼观:右乳肿块:灰黄组织,2.8×2.5×2cm,切面见一灰白肿块,直径1.2cm,质中至硬,与周围组织分界欠清,未见明显出血及坏死。
3.2镜下观(图1-图6):低倍镜下乳腺皮下,位于乳腺间质中见一边界欠清的结节,周围略呈放射状,累及周围脂肪,浸润性生长。中倍镜下,瘤细胞间为宽窄不等的纤维结缔组织分隔,呈巢状、片状或宽带状排列。高倍镜下,瘤细胞圆形或多边形,细胞核小、圆形,居中,染色质呈固缩状或空泡状,无异型性,也无核分裂象;胞质丰富,呈嗜伊红色细颗粒状,有时可见嗜伊红色小球。
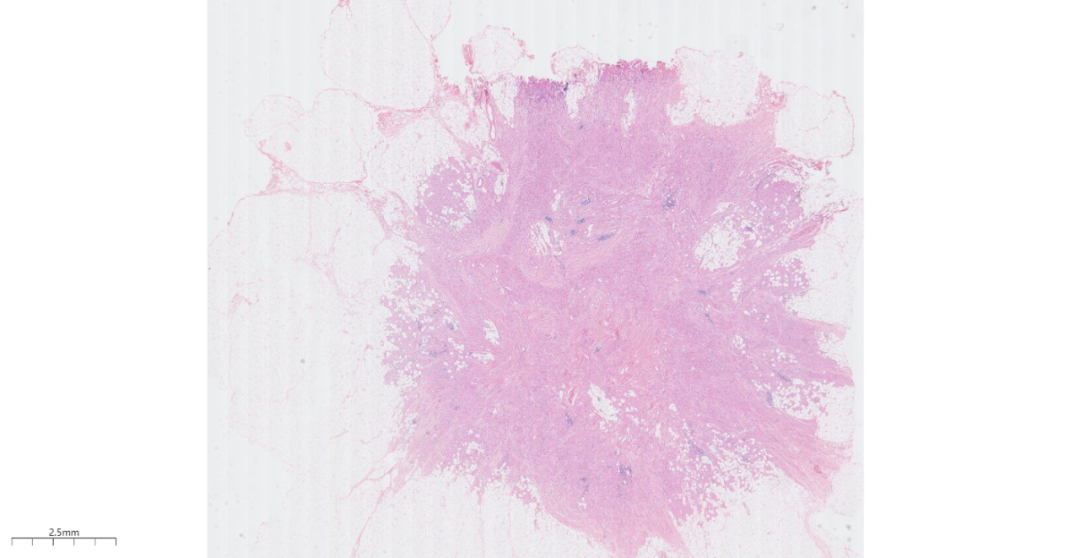
图1 低倍镜下乳腺皮下,位于乳腺间质中见一边界欠清的结节,周围略呈放射状.
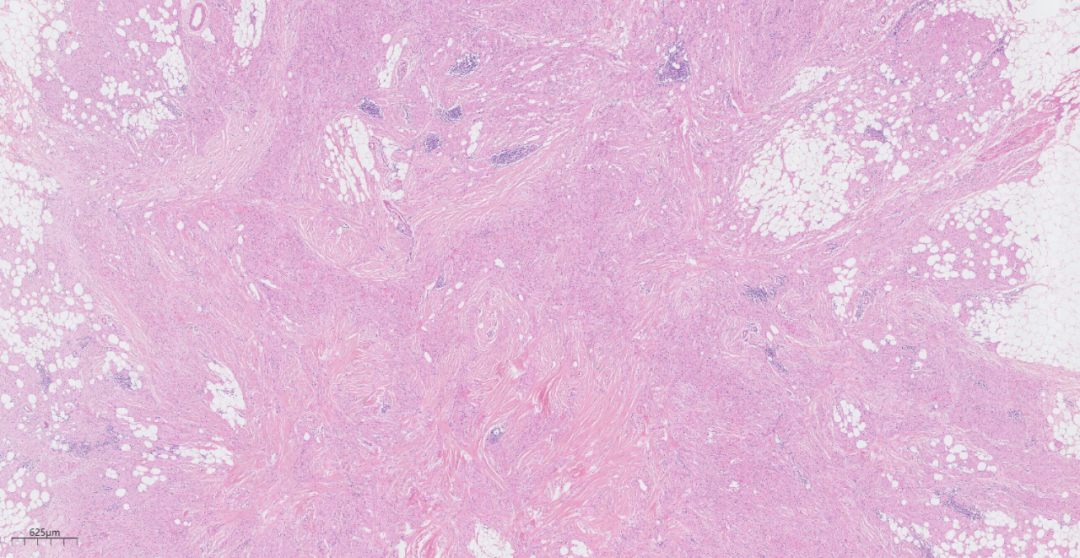
图2 中倍镜下,瘤细胞间为宽窄不等的纤维结缔组织分隔,呈巢状、片状或宽带状排列。
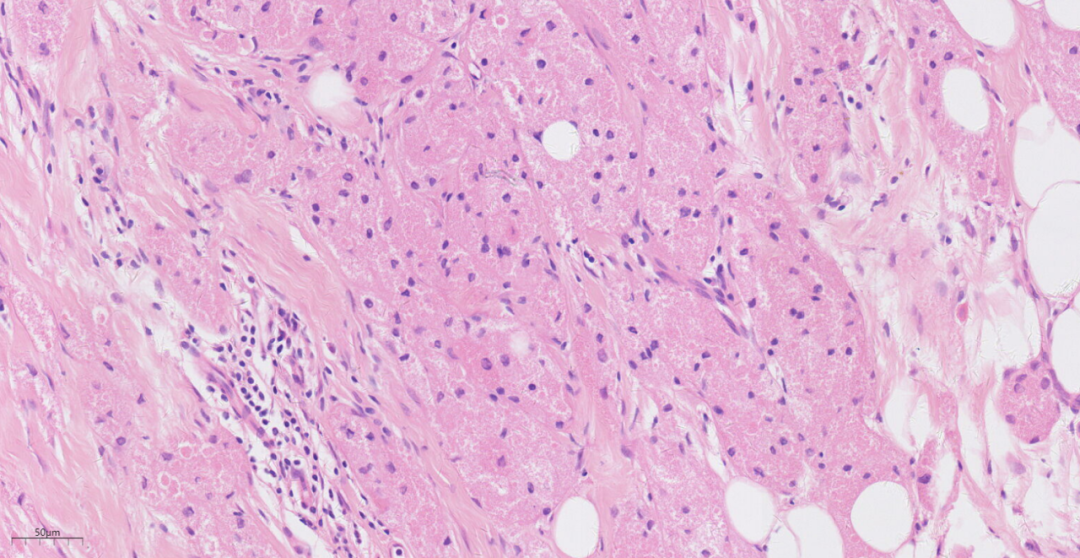
图3 瘤细胞圆形或多边形,细胞核小、圆形,居中,染色质呈固缩状或空泡状.
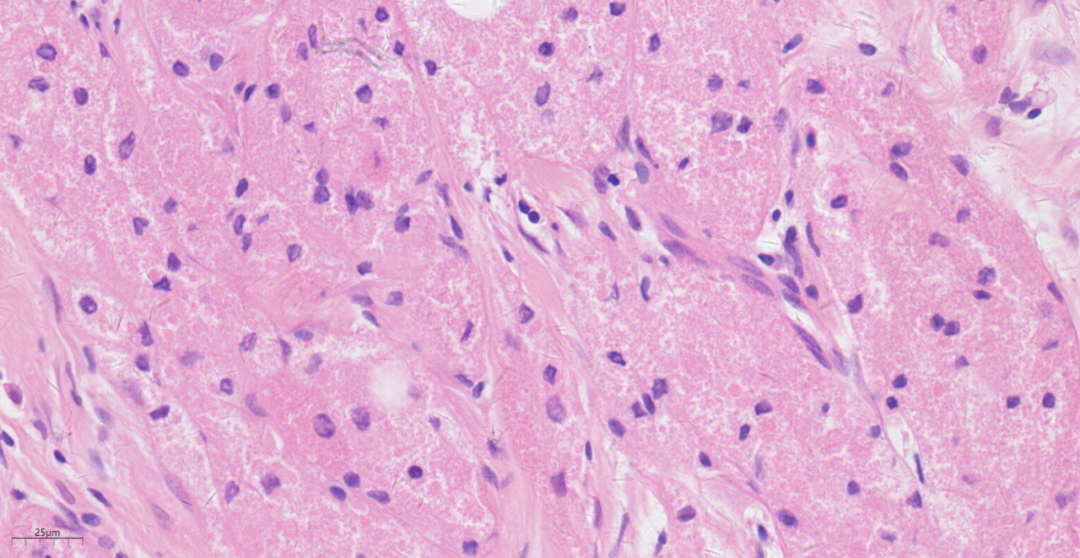
图4 高倍镜下,瘤细胞无异型性,也无核分裂象;胞质丰富,呈嗜伊红色细颗粒状。
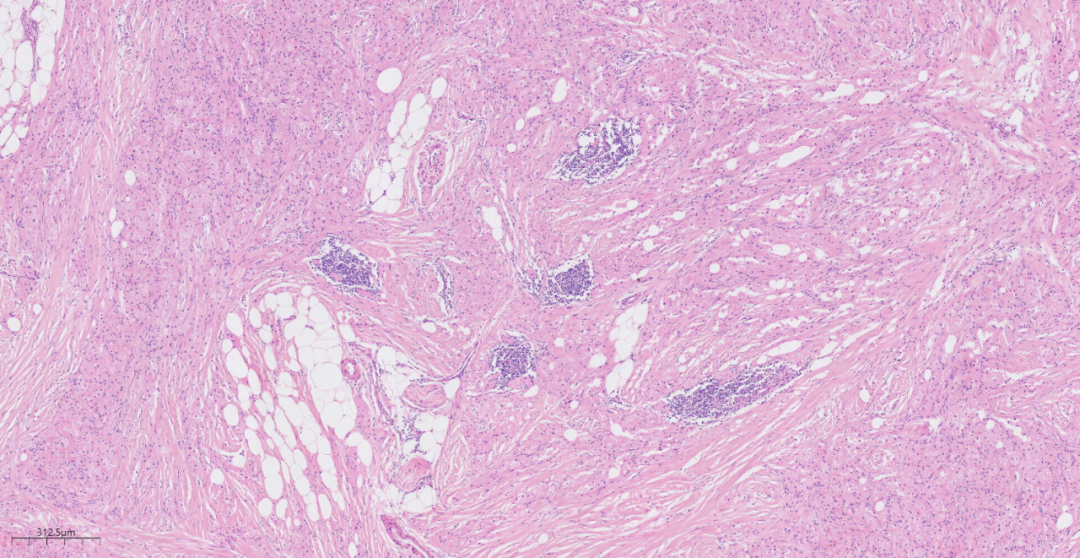
图5 间质可观察到散在或明显散在聚集成团的淋巴细胞浸润.

图6 肿瘤细胞向脂肪浸润性生长。
3.3免疫组化及特殊染色:免疫组化示肿瘤细胞S100(+++)(图7),CD68(PGM1)(+++)(图8),NSE(+++)(图9),Calretinin(+),CK(-),GFAP(-),Inhibin-a(-),NF(-),PAS(+)。
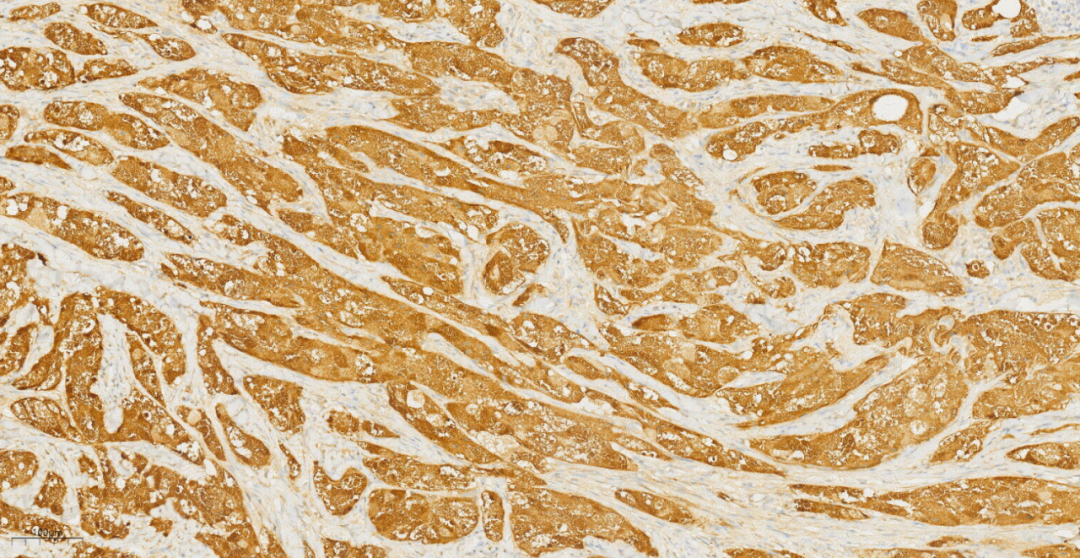
图7 免疫组化示肿瘤细胞S100(+++)。
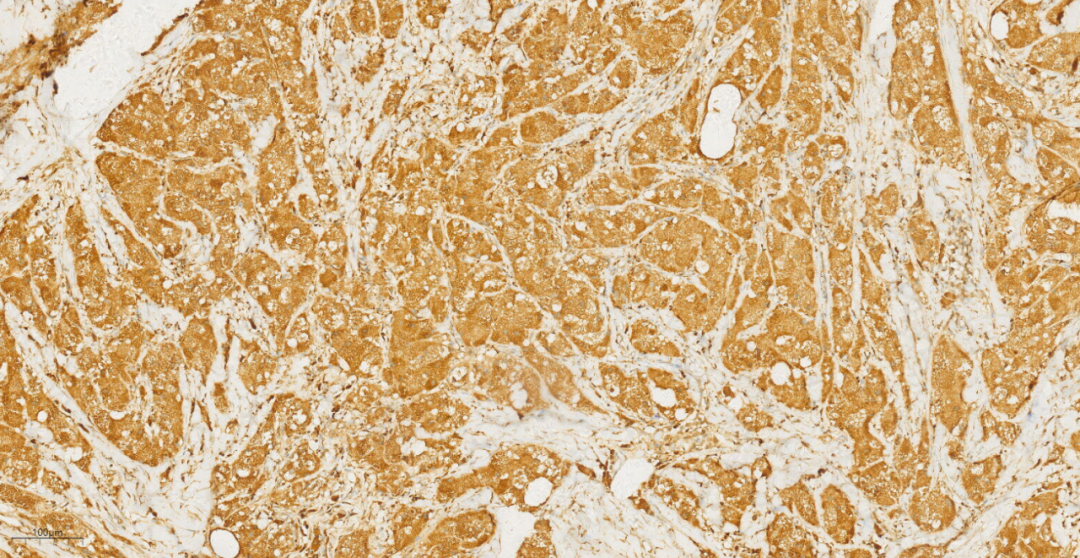
图8 免疫组化示肿瘤细胞CD68(PGM1)(+++)。
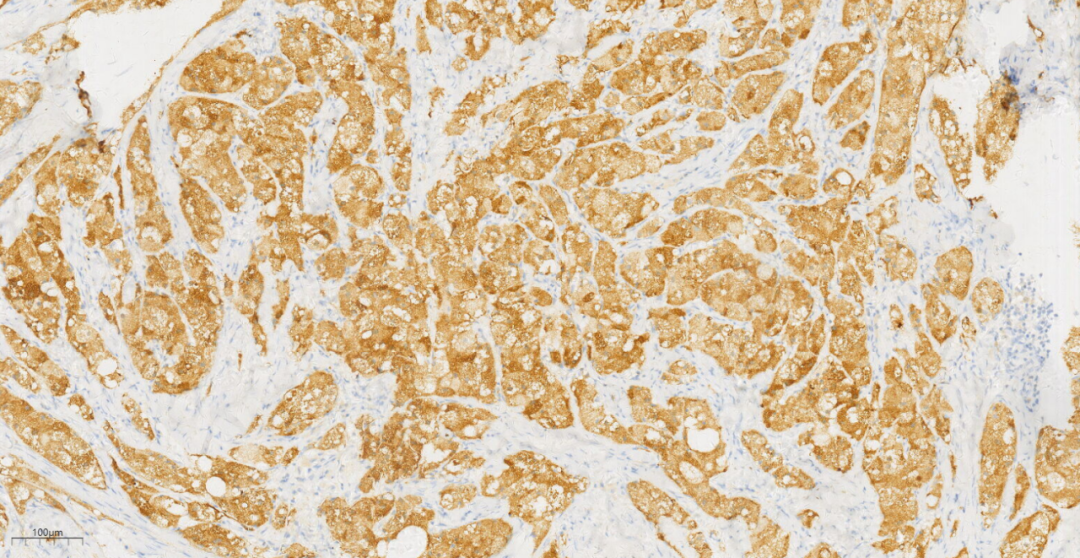
图9 免疫组化示肿瘤细胞NSE(+++)。
病理诊断:
(右侧)乳腺颗粒细胞瘤。
讨 论
01背景:
颗粒细胞瘤(granular cell tumor,GCT)是一种起源于外周神经的软组织肿瘤,绝大多数为良性。起初,Abrikossoff认为GCT是一种肌源性肿瘤,并于1926年首次将其描述为“颗粒细胞肌母细胞瘤”。随着免疫组织化学检测和电镜超微结构的观察,后来认为其起源于神经施万细胞。GCT发病部位广泛,以头颈部最多见,常位于皮肤及皮下,发生于乳腺的极其少见。乳腺GCT常常会模仿乳腺浸润性癌的生长方式,在影像学以及病理特征上非常容易误诊为原发性浸润性乳腺癌。
02乳腺颗粒细胞瘤的临床病理特征
2.1临床特点
乳腺GCT发病年龄广,19~77岁均可发生,常见于绝经前女性,发生率约占乳腺肿瘤的0.1%,儿童及男性的发病率相对更低。乳腺GCT常表现为一侧乳房单发、无痛性肿物,极少数病例可多发。肿瘤可发生于乳房的任何部位,包括所有4个象限、腋窝和乳头,乳腺GCT好发于内下象限及锁骨上神经分布的内上象限。大多数乳腺GCT是无痛的,部分患者伴有乳房疼痛、瘙痒、皮肤增厚、皱缩、凹陷以及反应性淋巴结病等。临床检査可扪及不规则质硬的结节,可引起皮肤下陷、乳头回缩或累及胸壁筋膜。
2.2影像学
乳腺X线摄影图像上,乳腺GCT可显示边缘不规则、毛刺、星状等假恶性征象,易误诊为浸润性乳腺癌,但均不会出现钙化;乳腺GCT也可表现为边缘清晰、类圆形的高密度肿块,易误诊为乳腺纤维腺瘤。
MRI图像上,乳腺GCT可表现为在T1WI呈低或中等信号,在T2WI图像上也能以稍高信号显示出来;增强MRI表现为不同程度的强化,可表现为缓慢强化,也可表现为快速强化和边缘强化。
2.3病理学特征
肉眼观:
GCT大体上,肿块呈灰白或灰褐色、质地均匀的结节,无明显包膜,边界清楚或不清,直径可达5 cm,一般无明显出血坏死及钙化。
镜下观:
形态学上,低倍镜下,乳腺GCT均没有明显包膜,肿瘤边界均不规则,分界不清,瘤组织侵及周围纤维及脂肪组织,呈浸润性生长,瘤组织呈巢簇状、片状、条索状排列,边界不清;肿瘤细胞被粗细不一的胶原纤维束分割,可分布于正常乳腺导管、腺泡及血管周围,间质可观察到散在或明显散在聚集成团的淋巴细胞及浆细胞浸润,高倍镜下,瘤细胞体积大,圆形或者多边形,胞质丰富,因胞质内大量溶酶体蓄积而呈嗜酸性颗粒状,细胞核小圆形、深染,位于胞质中央,核仁不明显,胞界不清,细胞较温和,核分裂少见,无肿瘤性坏死。肿瘤间质中可见少许色素沉积。部分病例可见瘤细胞包绕小神经或与周围神经束有移行。
免疫表型:乳腺GCT会特征性弥漫强阳性表达S-100,也常表达CD68、Vimentin、CEA、PGP9.5、NSE、TFE3和MITF,而myoglobin、lysozyme、HMB45、melan-A、GFAP、CK、ER、PR则为阴性,提示其神经源性。Ki-67增殖指数通常<20%。因此特殊染色PAS及D-PAS常阳性(由于颗粒细胞胞质内存在丰富的溶酶体可以耐淀粉酶消化),发生在其他脏器的部分GCT中S-100可以阴性表达,
细针穿刺细胞学检査时,颗粒状胞质和良性的细胞核提示GCT,但要除外乳腺癌,尤其是大汗腺癌以及组织细胞病变。由于GCT可与乳腺癌同时发生,因此在术中冷冻诊断时更要提高警惕。
分子遗传学:
乳腺GCT的分子遗传学研究极少。在72%的GCT中发现有ATP6AP1或ATP6AP2功能缺失性突变。
03鉴别诊断
乳腺GCT主要应与以下肿瘤相鉴别:
(1)恶性颗粒细胞瘤:肿瘤常位于深部软组织(如肌内或腹/盆腔)及近期生长迅速这两点有助于恶性的诊断,肿瘤直径常>5cm。肿瘤至少在局部区域显示以下三种形态:瘤细胞核增大,染色质呈空泡状并可见明显核仁;瘤细胞显示一定的多形性:核质比增大,瘤细胞呈梭形,可见核分裂象(>5个/50HPF),可见凝固性坏死。少数肿瘤内尚可见散在的多核瘤巨细胞。Fanburg-Smith 等在73例发生于软组织的恶性、非典型性和多中心性颗粒细胞瘤中检测了以下六个指标:肿瘤性坏死,梭形细胞,空泡状核及大核仁,核分裂象(>2个/10HPF,200倍),高核质比和多形性。结果显示,46例满足上述3个或3个以上的形态而诊断为恶性颗粒细胞瘤,21例满足1个或2个上述形态而诊断为非典型性颗粒细胞瘤,6例仅显示灶性多形性而诊断为良性颗粒细胞瘤。Fanburg-Smith等提出的标准比较适用,具有较高的可重复性。但是,仍有极少数病例,如按照上述标准不能诊断为恶性,但临床上却出现复发和转移。有学者认为仍必须参考肿瘤的大小直径是否>5 cm、肿瘤的位置(深浅)、细胞核多形性、核仁明显、核分裂象增多、伴有坏死、局部复发等参数,并紧密结合临床生物学行为。
(2)乳腺小叶癌(组织细胞亚型):癌组织呈簇状、串珠样或单一细胞散在分布,也可围绕残余的乳腺导管呈同心圆或者靶环样排列,浸润性生长,瘤细胞胞质中等到丰富嗜酸性颗粒状或淡染,细胞异型性较明显,背景中可见到小叶原位癌的成分,免疫组化GATA3、GCDFP-15、ER、PR、CK、EMA常阳性,不表达CD68、CD63、NSE。
(3)乳腺富脂质癌:>90%的肿瘤细胞胞质内富含脂质呈透明泡沫状,其恶性程度高,约70%可发生同侧腋窝淋巴结转移,脂肪染色阳性,CK阳性有助于鉴别。
(4)纤维组织细胞瘤:肿瘤位于真皮内,由增生的梭形至组织细胞样细胞组成,病变周围可见特征性的被包裹的胶原纤维,被覆表皮增生且常伴有基底细胞色素沉着,免疫组化FIA、CD163、CD68常阳性,S-100、CD34阴性。
(5)炎症反应性组织细胞增生:乳房穿刺后、放化疗后或者脂肪组织坏死等都可以引起反应性的组织细胞增生,表达CD68、CD163,不表达S-100。
(6)乳腺伴大汗腺分化的癌:癌细胞胞质丰富、空泡状或嗜酸性颗粒状,核仁明显,类似于大汗腺,细胞异型性显著,核分裂象多见,背景中常伴有大汗腺型导管原位癌,表达乳腺源性标记物GCDFP-15及AR,ER和PR常阴性,不表达CD68。
(7)乳腺嗜酸细胞癌:由70%以上嗜酸细胞构成,瘤细胞呈实性片状、岛状或者巢状,胞质丰富、嗜酸性,核分裂象少见,CK、GCDFP-15、HER2及线粒体染色常阳性。
(8)乳腺恶性黑色素瘤:瘤细胞可呈上皮样、梭形细胞、透明细胞或者横纹肌样,具有多种生长模式,核具有多形性、核深染、染色质粗糙,可见显著的嗜酸性大核仁及色素沉积,核分裂象多见,免疫组化不同程度表达HMB45、melan-A.MITF、S-100、SOX10等,不表达CK及CD68。
(9)腺泡状软组织肉瘤:多边形大细胞排列成假腺泡状,瘤巢周围为宽窄不一的纤维间隔及丰富的毛细血管网,瘤细胞胞质丰富、嗜酸性颗粒状,免疫组化TFE3核常阳性,不表达S-100、CD68。
(10)神经内分泌癌:瘤细胞呈器官样排列,可见丰富的毛细血管,胞质内可见嗜酸性颗粒,电镜下可见神经内分泌颗粒。Cg A和Syn阳性可与GCT鉴别。
04治疗及预后
乳腺GCT几乎均为良性,手术完整切除肿物后很少出现复发及转移,如局部切除不完整容易复发,但也有极少数恶性病例报道(提示恶性的特征包括:直径>5 cm、细胞核多形性、核仁明显、核分裂象增多、伴有坏死、局部复发),可有淋巴结转移,需行同侧腋窝淋巴结清扫,恶性和复发的乳腺GCT需广泛切除,出现局部或远处转移的乳腺GCT预后相对较差。
*本文(包括图片)均为作者投稿, 仅供行业交流学习用,不作为医疗诊断依据。
参考文献
[1] 张转敏,王映梅,胡沛臻,等.乳腺颗粒细胞瘤6例临床病理特征分析[J].诊断病理学杂志,2024,31(09):834-837.[2] 姜英,常晓燕,陈杰.乳腺颗粒细胞瘤7例临床病理分析[J].诊断病理学杂志,2016,23(09):647-649.[3] Meani F, Di Lascio S, Wandschneider W, et al. Granular cell tumor of the breast: a multidisciplinary challenge. Crit Rev Oncol Hematol. 2019 Dec;144:102828. doi: 10.1016/j.critrevonc.2019.102828
[4] Corso G, Di Nubila B, Ciccia A, et al, Lissidini G, Cairns L, Veronesi P, Galimberti V. Granular cell tumor of the breast: Molecular pathology and clinical management. Breast J. 2018 Sep;24(5):778-782. doi: 10.1111/tbj.13036
[5] 邓亚兰,刘莉.乳腺颗粒细胞瘤的影像学表现及临床病理学特征分析[J].肿瘤影像学,2023,32(05):411-416.DOI:10.19732/j.cnki.2096-6210.2023.05.002.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言

















#临床病理# #乳腺颗粒细胞瘤#
77