南开大学齐迹团队《自然·通讯》:乏氧激活和微环境重塑的纳米平台用于癌症多功能成像和增强的免疫治疗
2024-12-05 BioMed科技 BioMed科技 发表于陕西省
近日,南开大学齐迹团队报道了一种具有优异的肿瘤微环境响应性的诊疗一体化探针,开创性地整合多种成像模式和治疗模式于单一分子内,并实现了高效的肿瘤点亮成像及其引导的治疗。
三阴性乳腺癌(TNBC)因具有免疫“冷”微环境阻碍了当前免疫疗法的抗癌功效,其典型特征是T细胞浸润不足和免疫原性低。近年来,随着光免疫疗法和纳米技术的快速发展,越来越多的研究人员致力于其在影响免疫系统进行癌症治疗上。光疗,包括光动力疗法(PDT)和光热疗法(PTT)除了对肿瘤细胞的直接杀伤外,还能有效诱导肿瘤细胞的免疫原性死亡(ICD),具有强大的免疫激活能力。此外,成像因可以可视化药物递送,辅助肿瘤切除手术,大大提高了治疗的精准性和安全性。将实施灵敏、低组织散射和自发荧光的NIR-II荧光(FL)成像(1000-1700 nm)与高空间分辨率和穿透能力的光声(PA)成像相结合,可以提供疾病部位的多方面信息。尽管如此,目前大多数诊疗材料因缺乏病灶特异性,信号恒定,没有特异性激活,不能选择性区分正常和病理组织,使得诊疗功能不可控。因此,迫切需要设计能够响应TNBC病理特征的可激活探针,从而提高诊疗的灵敏度和准确性。
近日,南开大学齐迹团队报道了一种具有优异的肿瘤微环境响应性的诊疗一体化探针,开创性地整合多种成像模式和治疗模式于单一分子内,并实现了高效的肿瘤点亮成像及其引导的治疗。相关工作以“A hypoxia-activated and microenvironment-remodeling nanoplatform for multifunctional imaging and potentiated immunotherapy of cancer”为题发表在Nature Communications。南开大学博士生宋健文为第一作者,齐迹教授为独立通讯作者。

乏氧是许多恶性实体瘤的固有特征,源于肿瘤脉管系统异常导致的供氧不足与癌细胞快速增殖和消耗氧气之间的不平衡。因此,研究人员开发了一种多功能纳米平台,该平台集成了乏氧可激活的多模式分子成像和有效的光免疫疗法,用于癌症的灵敏诊断和有效治疗。作者巧妙设计并合成一种基于N-氧化物结构的分子探针BN-O,该探针可以从“A-A”变为“D-A”结构,从而能够通过强大的 NIR-II FL/PA 信号开启 NIR 响应。除了开启成像信号外,BN-O还表现出乏氧触发的I型PDT和PTT效应。亲水分子探针与血管破坏剂一起被包裹在酸降解的金属有机框架纳米载体中,并进一步用M1样巨噬细胞膜伪装以构建靶向治疗诊断纳米平台。具体来说,血管破坏剂可以重塑肿瘤微环境(TME),这不仅切断了肿瘤的营养和氧气供应,还加剧了TME的乏氧以放大随后激活的光疗。在TNBC荷瘤小鼠中,纳米探针通过开启明亮的NIR-II FL和PA信号成功地原位点亮乏氧肿瘤,为后续光免疫治疗提供重要指导。在乏氧TME中,纳米探针的PTT/PDT属性也得到显着增强,诱导强大的肿瘤特异性T细胞免疫反应,并通过ICD和cGAS-STING通路的协同激活减轻免疫耐药性。得益于TME重塑机制和多方面免疫刺激之间的级联扩增效应,该纳米体系不仅抑制了原发肿瘤的生长,还有效抑制了远端肿瘤的生长,同时还引发了针对肿瘤再次侵袭的保护性免疫记忆(图1)。
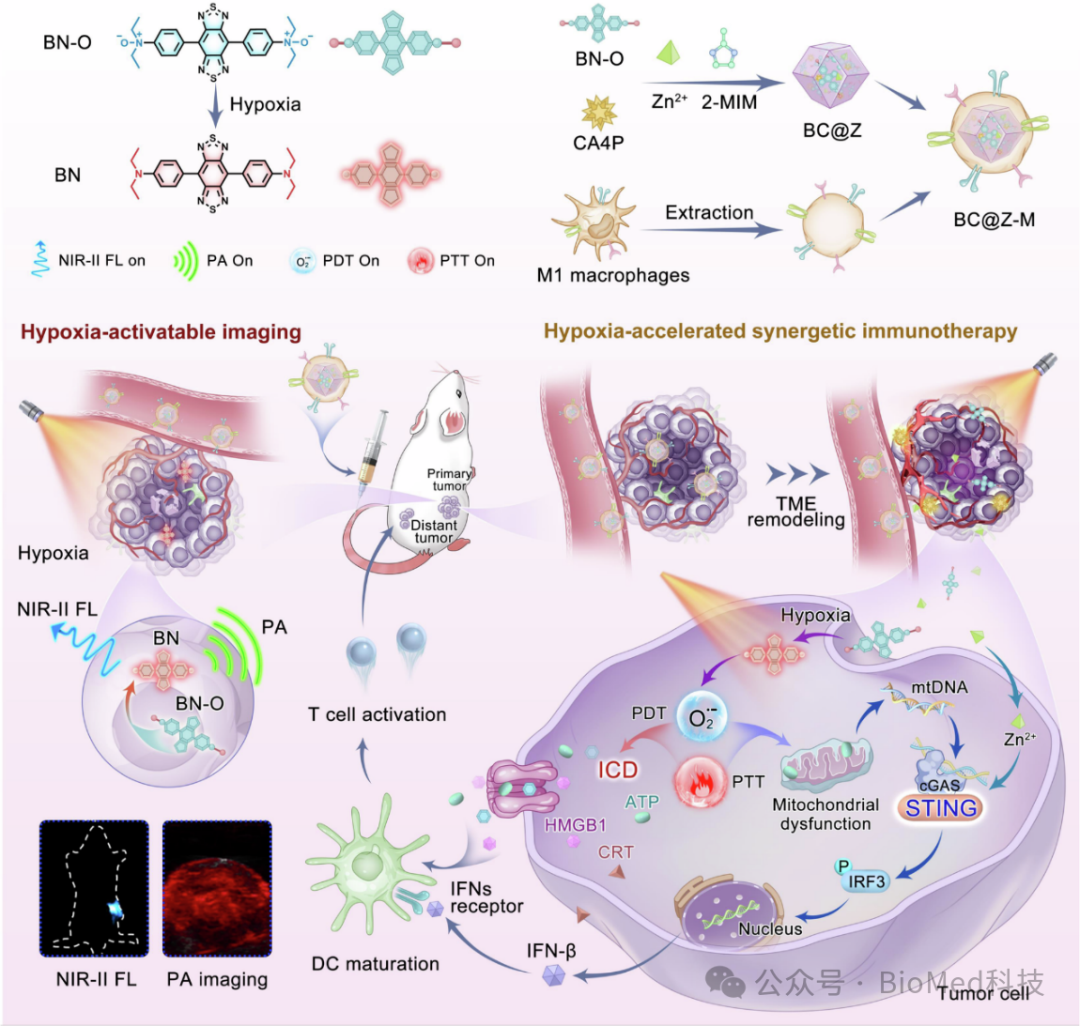
图1 用于开启NIR-II荧光和PA成像以及增强癌症免疫治疗的乏氧激活纳米平台的示意图
首先,研究人员通过巧妙设计并合成一种基于N-氧化物结构的分子探针BN-O,该探针可以在乏氧条件下从“A-A”变为“D-A”结构(图2a),BN-O与BN的吸收和发射峰具有明显的不同,相比于BN-O,BN分子的吸收更长,发射波长也处于长波长的NIR-II,有利于高质量的生物成像,其光学性能与密度泛函理论计算结果一致(图2b,c,d)。此外,与BN-O分子相比,BN具有高效的PDT和PTT性能(图2e,f,g,h),而且还具有明亮的光声性能(图2j,k,l)。从而有效的开启NIR-II FL/PA 信号响应。最后该分子展示出优异的光热和光声稳定性(图2i,m)。
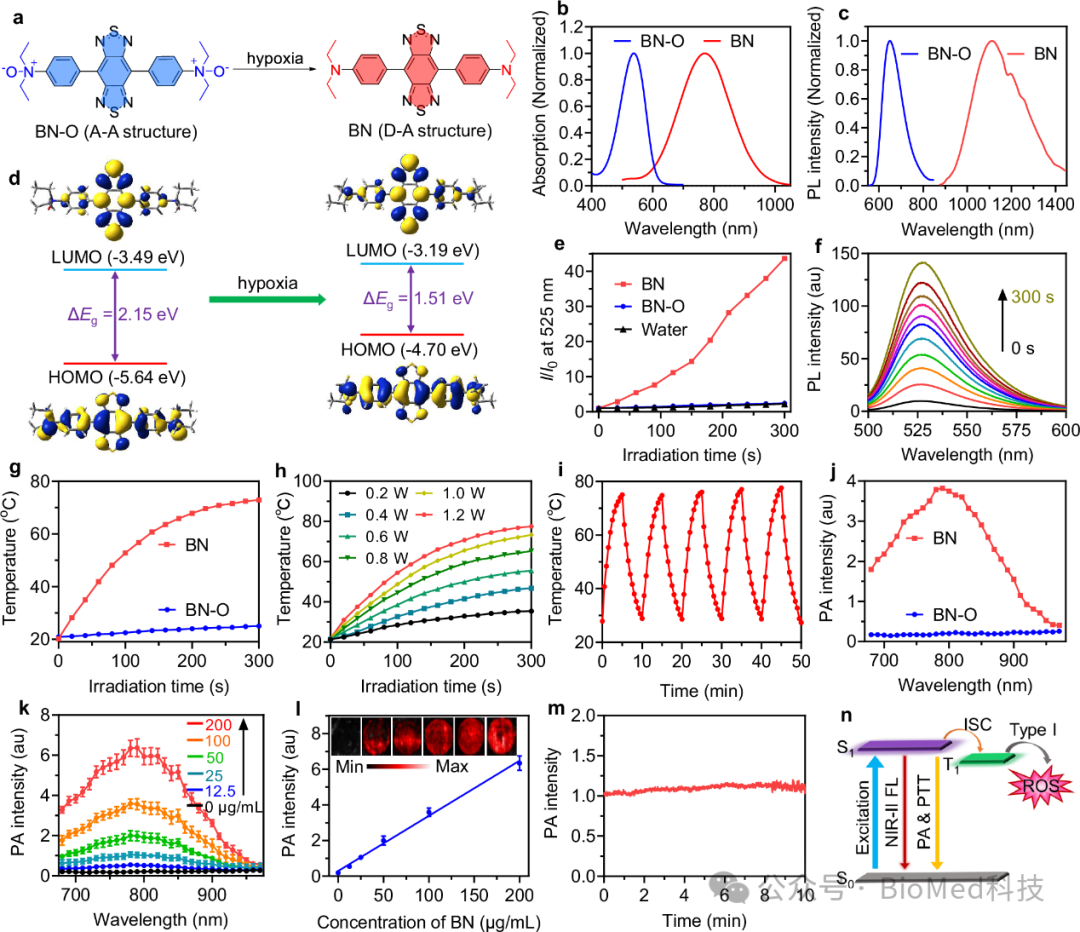
图2 BN-O和BN的结构和性能
随后,研究人员验证了BN-O乏氧转变性能,结果显示乏氧条件下BN-O随时间延长,吸收逐渐红移,可见光区发射逐渐减弱,在NIR-II明显增强,意味着BN-O向BN的转变,质谱测试结果显示反应体系中BN-O有效转变为BN(图3a,b,c,d)。除了开启成像信号外,BN-O还表现出乏氧触发的I型PDT和PTT效应。实验结果证明BN-O在乏氧条件下可以有效地开启PDT和PTT性能,结果显示,乏氧刺激后,在730nm激光器照射下的PDT和PTT性能分别增加了23倍和7.5倍,而且不受常见的干扰物质的影响,特异性的在乏氧条件下激活NIR-II FL和PA信号(图3e,f,g)。为了调节肿瘤血管的异质性,亲水分子探针与血管破坏剂(CA4P)一起被包裹在酸降解的金属有机框架纳米载体中,并进一步用M1样巨噬细胞膜包覆以构建靶向治疗诊断纳米平台-BC@Z-M,结果显示该纳米体系粒径~134nm,TEM和蛋白免疫印迹结果显示表面成功包覆了M1巨噬细胞膜,而且包覆的细胞膜良好的保留了靶向肿瘤相关蛋白α4β1 整合素(图3h,i,j)。与BN-O小分子响应性能一致,药物负载与膜包覆的纳米粒子可以在乏氧条件下有效开启NIR-II FL(图3l)。研究人员进一步探究了BC@Z-M酸降解和药物释放性能,结果显示,BC@Z-M在pH=6的PBS中孵育12小时后发生了明显降解,而且与pH=7.4孵育体系相比,酸性条件下BC@Z-M可以加速药物的释放(图3m,n)。
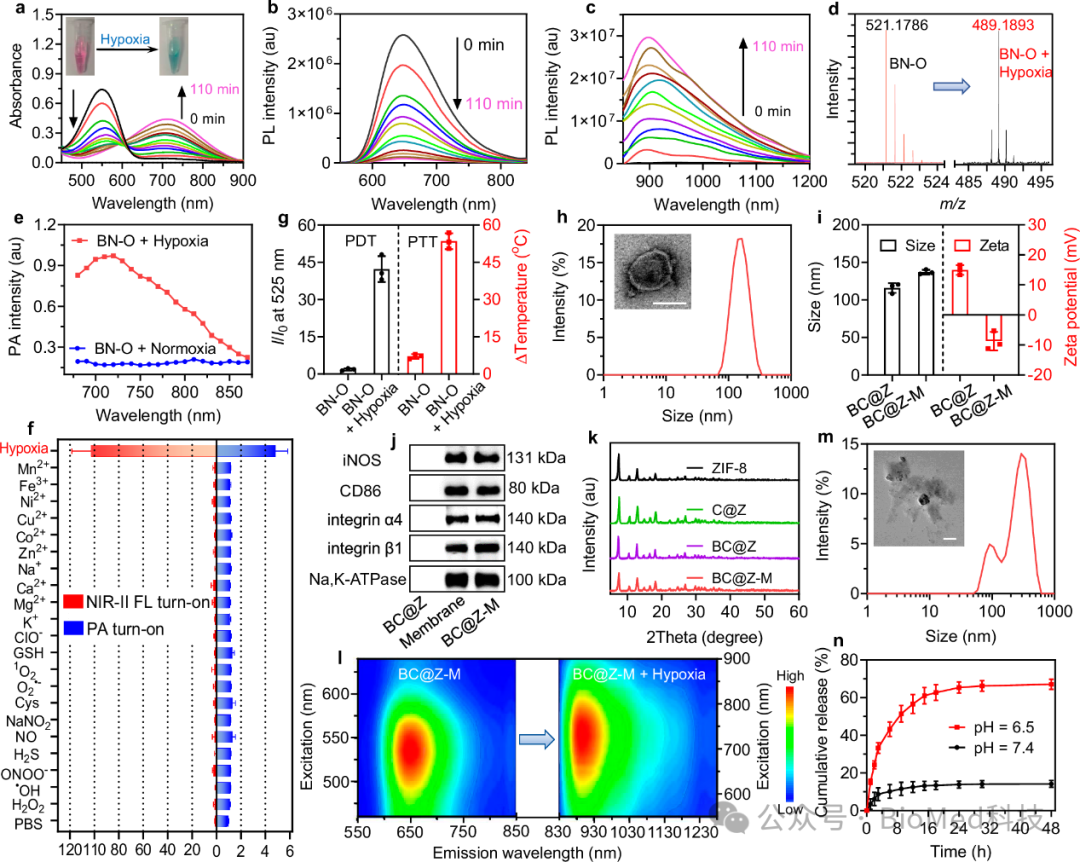
图3 分子和纳米体系的乏氧响应性能
体外细胞研究中,与BC@Z相比,BC@Z-M由于M1细胞膜的包覆,可以有效地增强肿瘤细胞膜的靶向,同时有望减少BC@Z-M从网状内皮系统的清除,增加在肿瘤部位的积聚(图4a,b,c)。随后,研究人员验证了纳米探针是否可以有效检测活细胞的乏氧,结果显示,纳米探针能够特异性的点亮乏氧环境中的肿瘤细胞,在3小时时间点表现出比常氧对照高14.8倍的比率荧光反应(图4d,e)。此外,研究人员还用活体成像系统对12孔板中培养的细胞进行了监测,发现乏氧刺激的细胞比率荧光比常氧条件下的高13.4倍(图4f,g)。然后,研究人员评估了BC@Z-M在各种条件下的抗肿瘤疗效。在常氧条件下,BC@Z-M表现出微弱的PDT效果和杀伤效果,相反,乏氧条件下,NIR照射诱导了大量活性氧的产生,有效地杀伤了肿瘤细胞(图4h,i,j)。证明了BC@Z-M在光照射下有效的乏氧激活肿瘤细胞杀伤潜力。
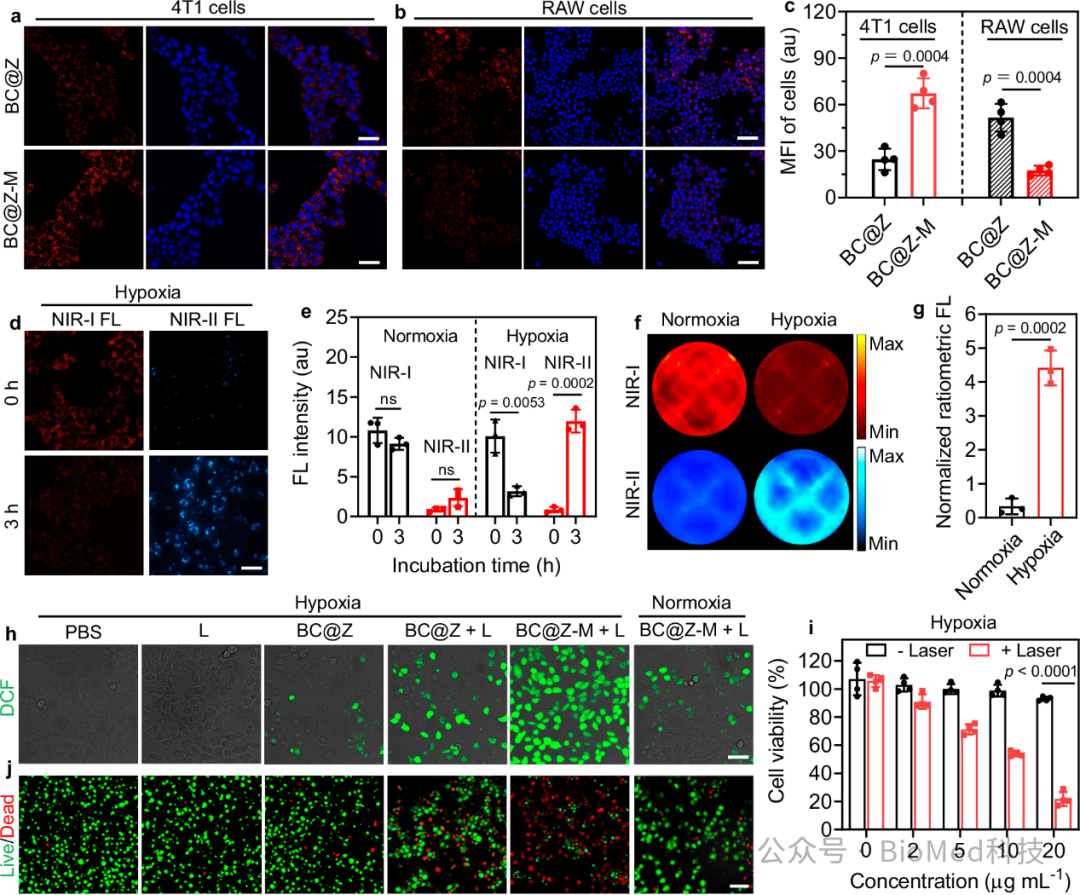
图4 体外细胞研究
除了直接杀伤肿瘤细胞外,研究人员还进一步探索了BC@Z-M通过激活ICD和STING通路增强抗肿瘤免疫反应的潜力。免疫荧光染色显示,在BC@Z-M加光照射处理后,肿瘤细胞上的钙网蛋白外翻显着升高,促进了HMGB1的细胞核易位,与其他组相比,用BC@Z-M加光照处理的肿瘤细胞的上清液也表现出最高浓度的 ATP(图5a,b,c)。这些发现共同表明,在乏氧条件下暴露于NIR激光时,BC@Z-M在肿瘤细胞中能够有效诱导ICD效应。随后作者还验证了BC@Z-M纳米体系具有线粒体和核DNA损伤的潜力,并通过蛋白免疫印迹分析了STING通过相关蛋白的表达,结果显示BC@Z-M可以有效激活STING通路(图5d, e,f,g)。作为启动抗肿瘤免疫反应的关键步骤,在确认ICD诱导和STING通路激活后,研究人员探究了不同材料预处理的肿瘤细胞激活骨髓来源树突状细胞(BMDC)的能力,流式结果显示BC@Z-M外加激光照射处理的肿瘤细胞与BMDC共孵育后,可以显著增加BMDC成熟标志物CD80和CD86的表达,表明BMDC的成熟(图5k,l,m,n)。
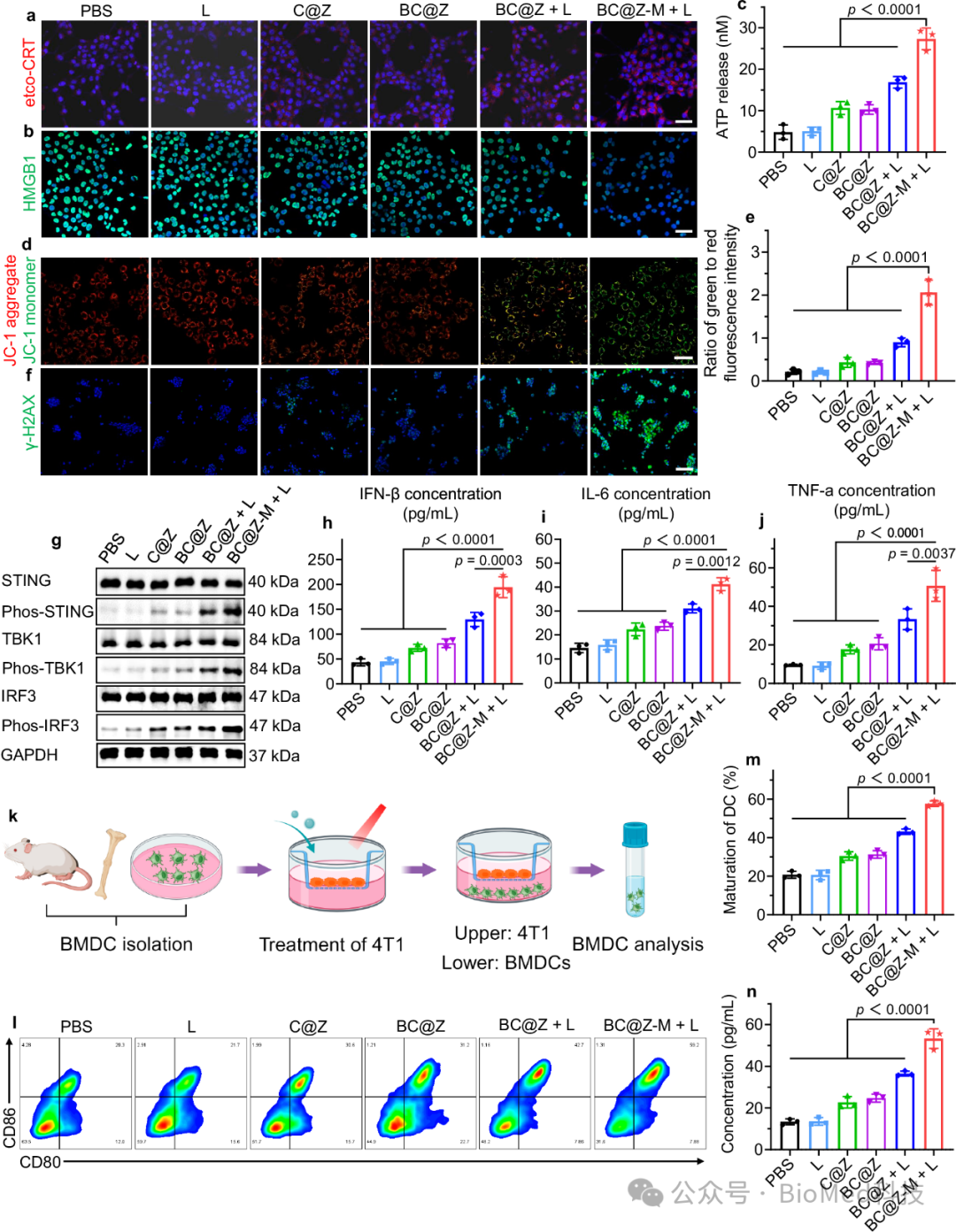
图5 体外细胞免疫反应
在分子优异的乏氧响应开启NIR-II FL和PA特性的鼓舞下,研究人员在TNBC荷瘤小鼠上进行了微环境响应成像验证。通过原位注射响应纳米探针到肿瘤中,作为对照,在肿瘤对侧皮下注射同等剂量的纳米探针,实时监测两侧区域的荧光变化。可以明显观测到响应性纳米探针可以有效地在肿瘤区域开启NIR-II FL信号,且比率荧光变化强度远高于健康对照部位(图6a,b)。进一步的组织切片也验证了肿瘤区域高度的乏氧与开启的NIR-II FL信号(图6c)。而且与不包巨噬细胞膜的实验组相比,M1巨噬细胞膜包覆有效提高了纳米探针在肿瘤部位的富集,具有更优异的NIR-II FL和PA信号(图6d,e,f,g,h,i)。这些发现证明了BC@Z-M在乏氧肿瘤中的NIR-II FL和PA成像方面的巨大潜力,可以用于精确地描绘肿瘤。
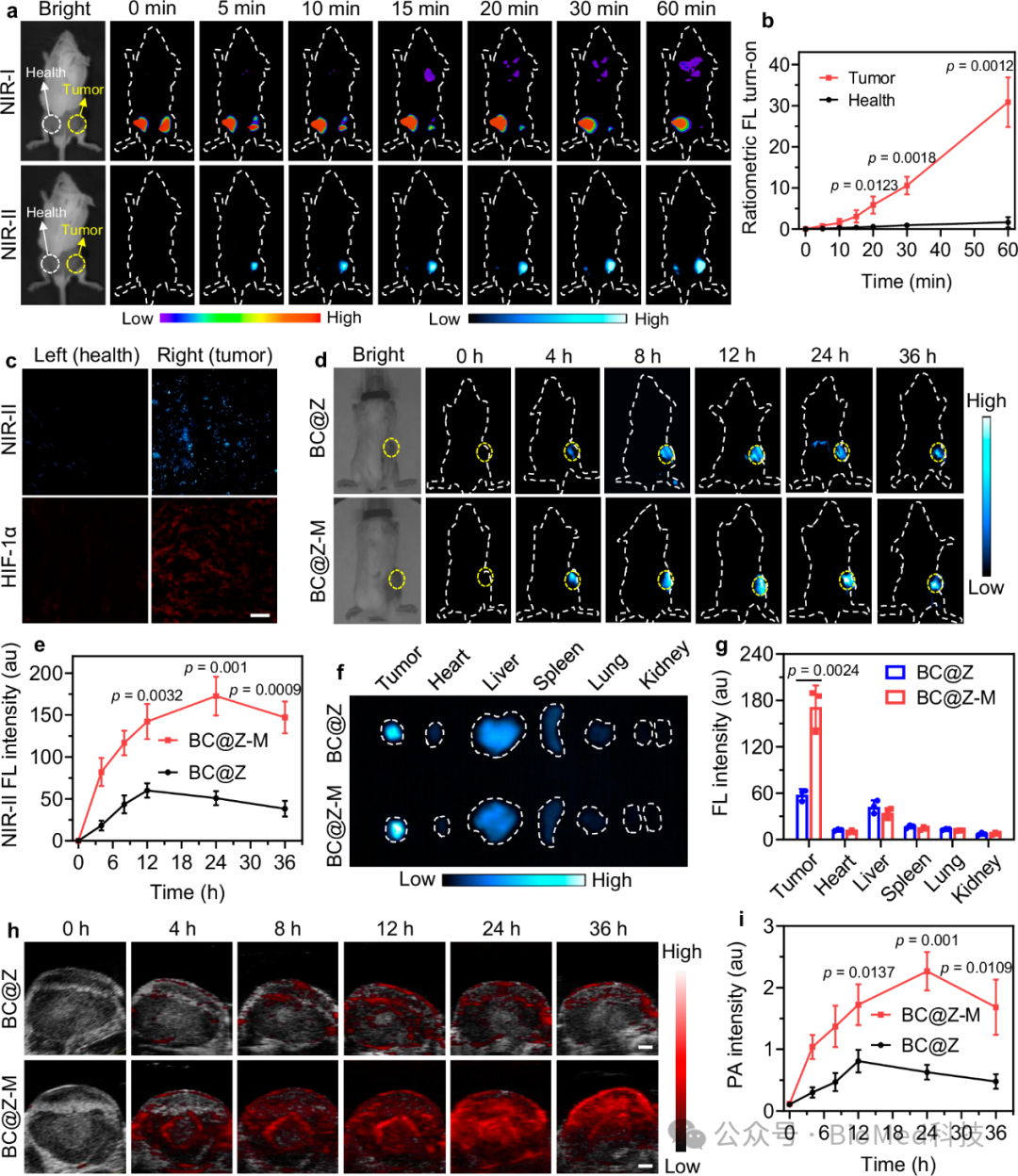
图6 乏氧肿瘤的体内NIR-II FL和PA成像
随后,研究人员评估了BC@Z-M在荷瘤小鼠体内抗肿瘤治疗效果。在荷瘤小鼠层面验证了该纳米体系可以有效触发抗肿瘤免疫,明显遏制肿瘤生长,并有效抑制了肿瘤全身的转移和扩散,显著提高了小鼠的存活率(图7)。
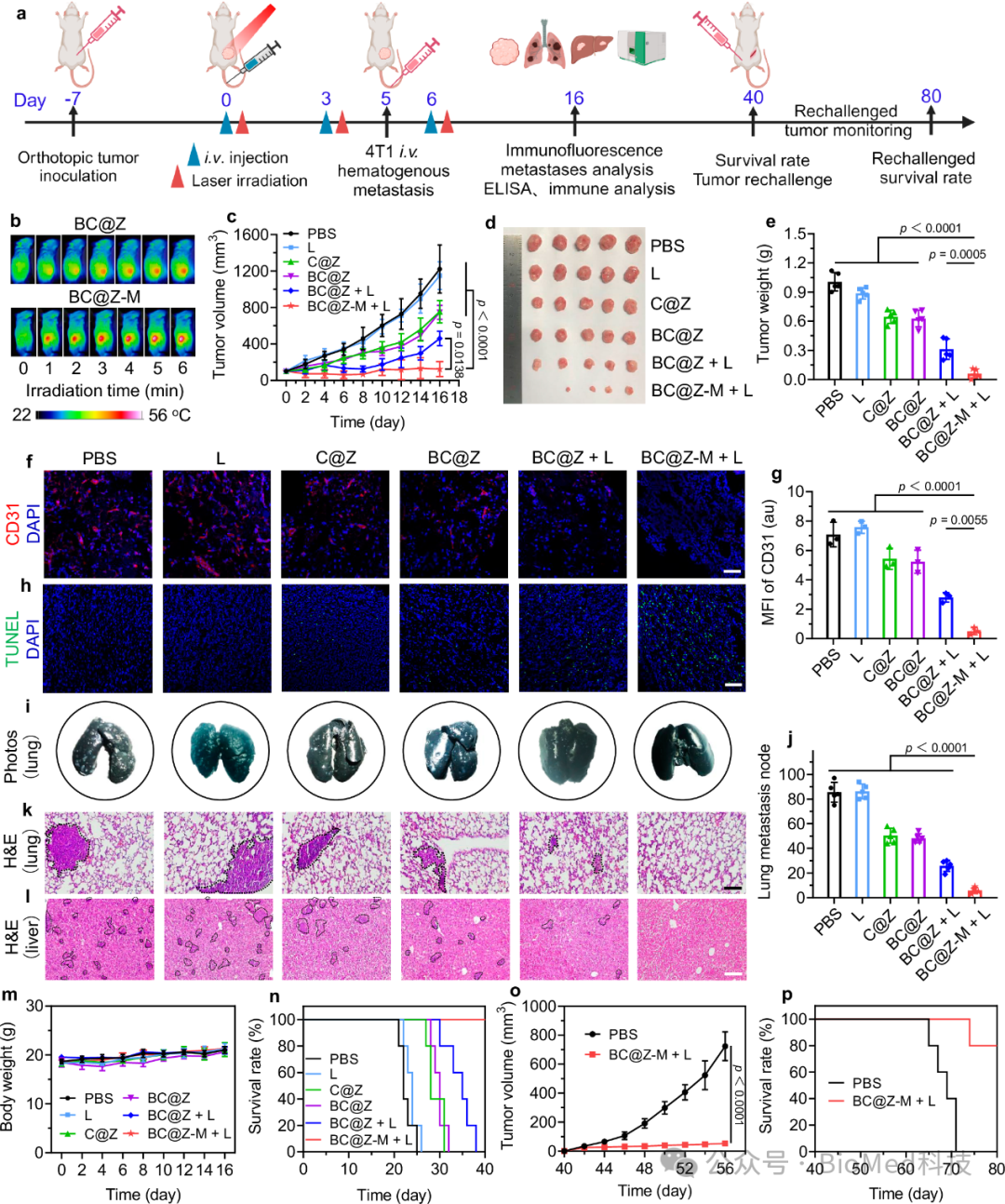
图7 纳米探针的体内治疗效果评估
该研究报道了一种可以通过乏氧响应原位高效激活的体系来促进肿瘤的精准诊疗。在TNBC荷瘤小鼠中,纳米探针通过开启明亮的NIR-II FL和PA信号成功地原位点亮乏氧肿瘤,为后续光免疫治疗提供重要指导。在乏氧环境中,纳米探针的PTT/PDT属性也得到显着增强,诱导强烈的肿瘤特异性 T 细胞免疫反应,并通过ICD和cGAS-STING通路的协同激活减轻免疫耐药性。得益于 TME 重塑机制和多方面免疫刺激之间的级联扩增效应,该纳米制剂不仅抑制了原发肿瘤的生长,还有效抑制了远端肿瘤的生长,同时还引发了针对肿瘤再次侵袭的保护性免疫记忆。这项工作为精确的图像引导肿瘤免疫治疗的高性能和可激活的治疗诊断方案的发展提供了新的视角。尽管该纳米体系显示了低毒性和抑制肿瘤生长的有效性,但是其临床安全性及有效性还不清楚,因此距离临床转化还有漫长路程。
原文链接:
https://doi.org/10.1038/s41467-024-53906-x
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言


















BN-O在乏氧条件下可以有效地开启PDT和PTT性能
11
#乳腺癌# #肿瘤微环境#
22