早期乳腺癌术后MRD监测早期识别复发,阳性预测值100%
刚刚 苏州绘真医学 苏州绘真医学 发表于陕西省
本研究表明,在复发患者中,PCM 检测到 ctDNA 阳性比临床复发提前很多,表现出与无复发生存期的强相关性,可用于识别复发风险高的患者,进行早期干预。
分子残留病(MRD)检测可以识别复发风险高的乳腺癌患者,在复发的早期阶段及早开始治疗或许能改善患者预后。Invitae 个性化癌症监测™(PCM)是一种新开发的下一代测序方法,利用最多 50 个患者特异性、肿瘤知情 DNA 变异,检测循环肿瘤 DNA(ctDNA)。本研究评估了 PCM 在临床复发前检测 MRD 的能力。研究队列包括 61 例接受新辅助化疗的高危乳腺癌女性患者。在新辅助治疗之前和期间、手术后和监测期间收集血浆样本。在每个时间点使用 PCM 检测 ctDNA。在复发患者中,监测期间血浆 ctDNA 检测的灵敏度为 76.9%(10/13)。特异性和阳性预测值均为 100%,所有监测阶段 ctDNA 阳性患者(10/61,16%)随后复发。监测期间 ctDNA 阳性与未来复发风险高相关(HR 37.2,95% CI 10.5–131.9,p < 0.0001),检测到 ctDNA 阳性比临床复发中位提前 11.7 个月。本研究表明,在复发患者中,PCM 检测到 ctDNA 阳性比临床复发提前很多,表现出与无复发生存期的强相关性,可用于识别复发风险高的患者,进行早期干预。
研究背景
在过去三十年中,尽管乳腺癌的治疗取得了进展,但复发风险仍然存在,约 15% 的患者会复发。对于最常见的癌症亚型——激素受体阳性/HER2 阴性患者,复发风险(包括远处转移)在诊断后 5 至 ≥ 20 年保持稳定,超过一半的远处转移发生在诊断后 >5 年。目前,无临床症状的治疗后管理指南包括每 12 个月进行一次乳腺 X 线检查,无需常规实验室或影像学检查来监测复发。由于局部和区域复发与发生远处转移的风险较高和生存率较低相关,使用新策略在早期监测和识别复发对于改善复发性乳腺癌患者的预后至关重要。
根治性治疗后残留的癌细胞(分子残留病,MRD)是局部和远处复发的来源。MRD 检测有助于识别复发风险高的患者,从而在疾病过程的早期阶段开始治疗,改善结局。MRD 无法通过影像学或临床检查识别;开发了分子技术,通过在血液样本中检测肿瘤细胞特有的突变来识别循环肿瘤 DNA(ctDNA)的存在。由于在早期乳腺癌患者中,ctDNA 可能仅占血浆游离 DNA(cfDNA)总浓度的 <0.01-0.1%,因此需要具有高灵敏度和特异性的检测方法来准确检测和区分低水平的 ctDNA 与全身正常细胞脱落的大多数 cfDNA。
下一代测序(NGS)技术,例如使用唯一分子标识符和多重 PCR,促使患者特异性检测,能够以高灵敏度检测 ctDNA。例如,追踪 ~ 500 个患者特异性 DNA 变异在 ctDNA 检测中方面表现出比数字 PCR(dPCR)更高的灵敏度,在最近诊断的转移性乳腺癌患者中的灵敏度为 81%。然而,这种方法被证明具有挑战性,因为研究中大多数乳腺癌患者的变异(中位数 57)远少于基准检测中使用的变异。相比之下,一项研究使用的检测包括 1-7 个变异,MRD 检测的灵敏度为 31%。两项研究利用了覆盖 16-51 个变异的测序panel,灵敏度为 86-89%,分子复发比临床复发提前 9-12 个月。
多项研究评估了在早期乳腺癌患者中,监测阶段 MRD 检测的能力,灵敏度为 79-93%,中位提前期为 7.9-11 个月。这些研究使用了多种方法,包括数字 PCR 和 NGS 方法。Invitae 个性化癌症监测™(PCM)是一种泛癌、肿瘤知情、长期监测检测,使用实体瘤患者外周血 18-50 个体细胞变异的患者特异性panel(PSP)提供个性化 ctDNA 检测。最近,研究表明,该检测方法可有效监测早期非小细胞肺癌(NSCLC)患者的残留或复发性疾病。在本研究中,我们评估了 PCM 在早期乳腺癌患者中检测 MRD 的能力。
研究方法
在这项原理验证研究中,回顾了 2012 年 11 月至 2016 年 9 月期间参加 ChemoNEAR 样本采集研究(研究伦理委员会参考编号 11/EE/0063)的早期乳腺癌患者血浆样本的 ctDNA 水平。61 例 WES 数据足以生成 PSP 的患者在监测阶段收集了多份血浆样本,可用于研究目的。所有患者均为原发性乳腺癌,无远处转移性疾病的迹象。激素受体(HR)和 HER2 状态根据诊断时的穿刺活检确定,肿瘤分为 HR 阳性/HER2 阴性(HR+)、HER2 阳性/无论 HR 状态(HER2+)、三阴性(TNBC)或未知。所有患者都接受了新辅助化疗(NAC)± 辅助治疗。
患者在治疗前、治疗中和治疗后收集了血样用于 ctDNA 分析。血浆样本采集时间包括 NAC 开始前(“基线”样本),第二个 NAC 周期期间,手术后 ≤8 周(“标志性”样本),以及前两年每三个月一次,之后每六个月一次(监测样本)。对来自肿瘤和胚系 DNA 的 NGS 文库进行测序。在肿瘤检出的变异中除去胚系样本检出的变异,包括潜能未定的克隆性造血(CHIP)变异。
研究结果
患者特征
本研究纳入了 61 例女性患者,临床特征见表 1。肿瘤类型包括 HR+(34%)、HER2+(33%)、TNBC(26%)和未知(6%)。2 例患者仅发生脑转移(患者 20,000,004,708 和 20,000,005,606)。所有患者均接受标准新辅助治疗。值得注意的是,患者 20,000,005,606 基线时归类为 HR+ /HER2-,在 NAC 完成后,手术样本为 HR+ /HER2+。1 例患者(20,000,006,307)的手术日期缺失。19 例患者达到病理完全缓解(pCR),包括 2 例后来发生远处转移的患者。总体而言,在中位随访 55(范围 21-77)个月时,13/61(21%)的患者复发。所有患者在监测阶段都提供了至少 2 份血浆样本(范围 2-12,中位数 8)。
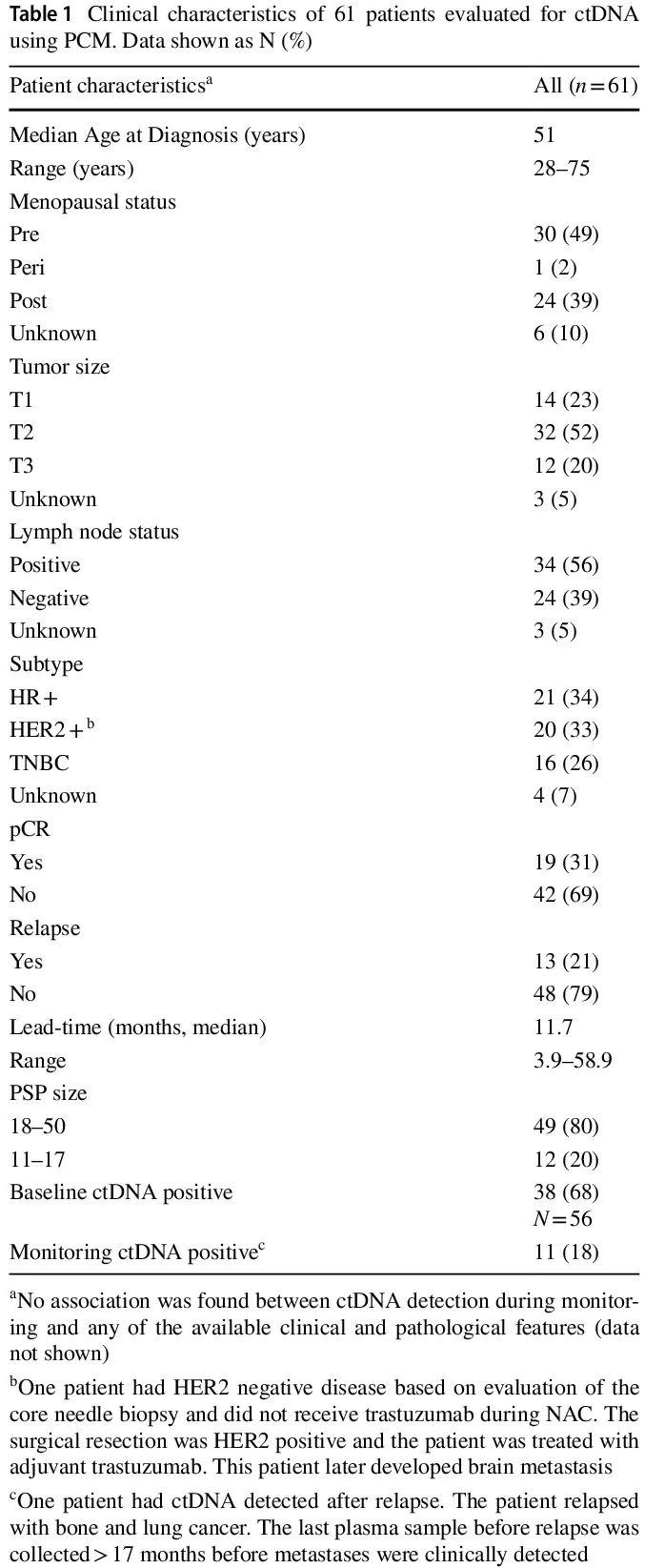
表1
PCM特征
PCM 检测包含的变异的中位数为 33(范围 11-50)。12 例患者全外显子组测序检测到的体细胞变异数目较少,导致 PSP 具有 11-17 个变异,小于 18-50 个变异的标准 PCM PSP 大小。每种亚型都有需要创建 11-17 个变异 PSP 的肿瘤(HR+ 5/21,24%;HER2+ 6/20,30%;TNBC 1/16,6%)。
基线ctDNA
56/61例(92%)患者有基线血浆样本;其中,36 例在第二个 NAC 周期时采集了额外的血浆样本。基线时,38/56 例患者(67.8%)ctDNA 阳性;5 例不确定,13 例阴性(图 1)。TNBC 患者(14/15,93.3%)基线时 ctDNA 阳性率最高,其次是 HR+(11/18,61.1%)和 HER2+(10/19,52.6%)肿瘤。基线时 ctDNA 阳性与较大的肿瘤相关;未发现 ctDNA 与任何其他临床或病理特征显著相关。基线(ctDNA 阳性14/38(36.8%)vs. ctDNA 阴性 3/13(23.1%),p 值 = 0.18)和第二个 NAC 周期(4/13(30.8%)vs. 6/22(27.3%),p = 0.41)时检出和未检出 ctDNA 的患者的 pCR 率相似。2 例达到 pCR 但后来复发的患者在基线时都检测到 ctDNA。基线时 ctDNA 阴性的患者(0/13)均未复发;相比之下,10/38 例(26.3%)基线时 ctDNA 阳性的患者发生远处转移(p = 0.02)。
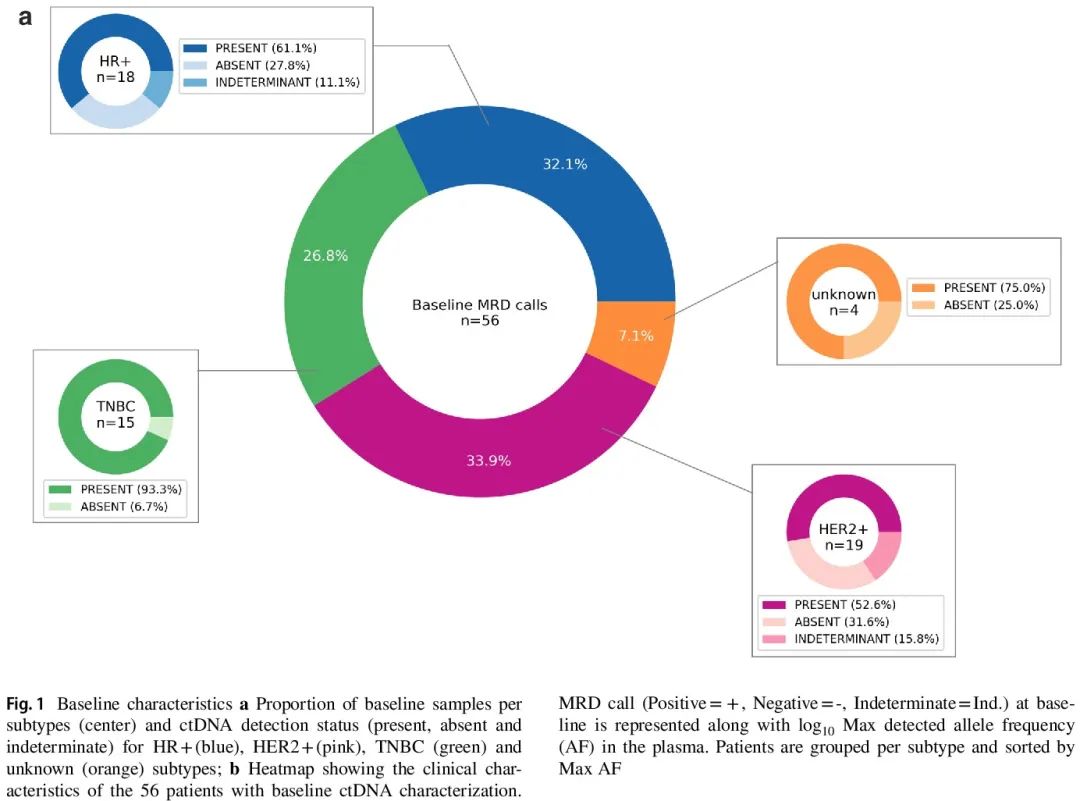
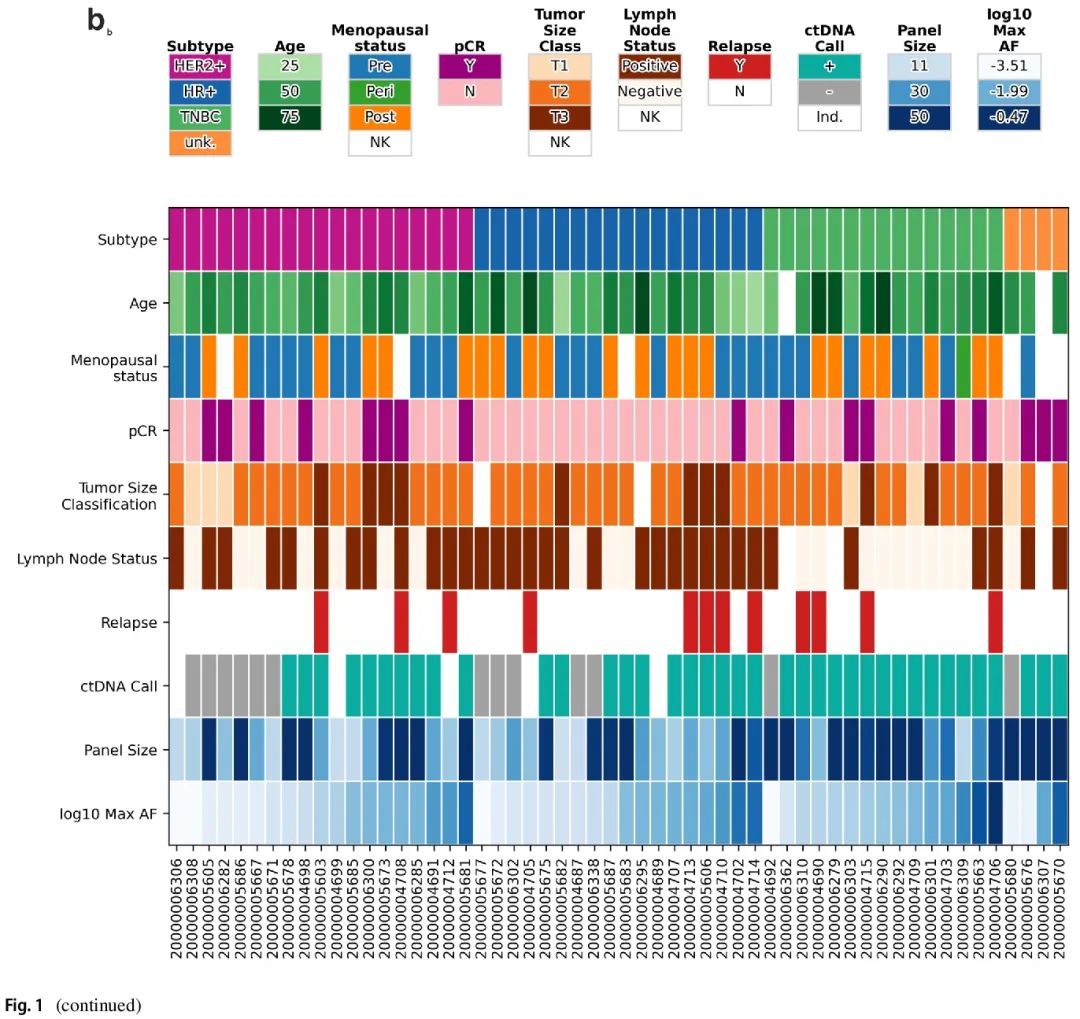
图1
标志性和监测ctDNA
在新辅助化疗后和手术后 8 周内采集的标志性血浆样本(n = 46)均未显示 ctDNA 阳性(图 2);相比之下,在监测期间,10/61 例(16.4%)患者变为 ctDNA 阳性,所有 10 例患者随后都复发(图 3)。在监测样本中首次检测到 ctDNA 阳性的平均时间为术后 16.7 个月。监测期间 ctDNA 阳性与未来复发风险高相关(HR 37.2,95% CI 10.5-131.9,p < 0.0001),从 ctDNA 阳性到临床复发的中位提前时间为 11.7 个月(范围 3.9-58.9)(图 4)。HER2+、HR+ 和 TNBC 从手术到首次检测到 MRD 的中位时间分别为 15 个月和25,17 和 6 个月。1 例患者在复发后检测到 ctDNA,该患者在基线时 ctDNA 呈阳性,监测血浆样本是在复发前一年多收集的。另外 2 例复发患者(骨和肝脏以及附件肿块)在监测阶段未检测到 ctDNA;在基线时,一例 ctDNA 呈阳性,另一例不确定,分别在复发前 3 个月和 8 个月没有收集血浆样本。

图2
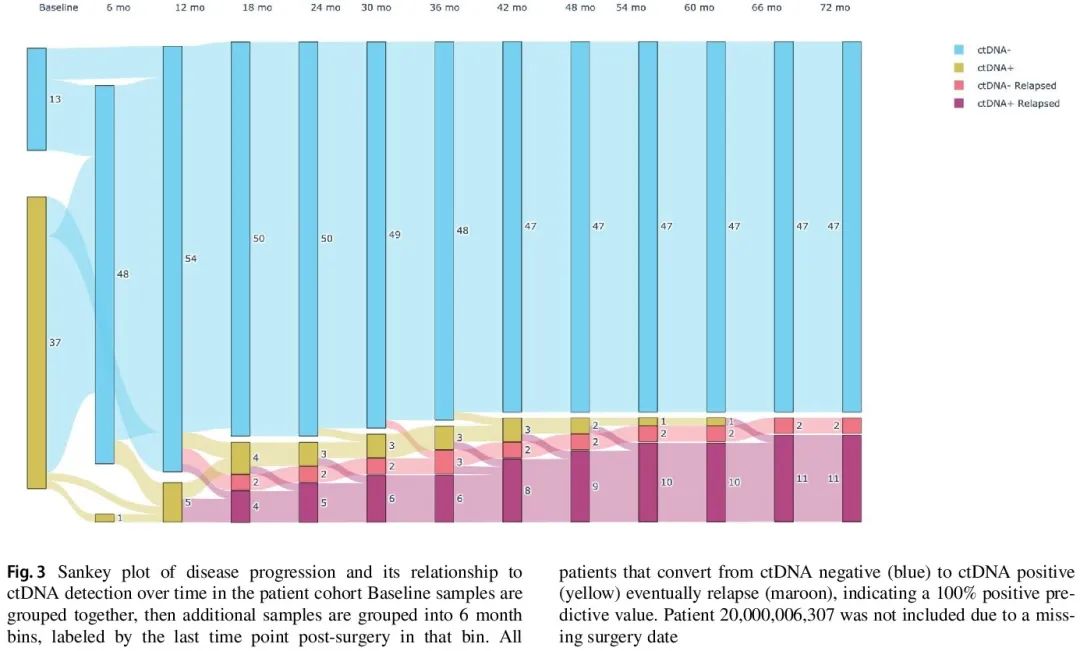
图3
总体检测灵敏度为 76.9%,仅考虑临床复发 6 个月内有血样的患者时,检测灵敏度为 90.9%(10/11),HR+、HER2+ 和 TNBC 肿瘤患者的灵敏度分别为 100%、100% 和 75%。复发的特异性和阳性预测值均为 100%。HR+ 和 HER2+ 的阴性预测值为 100%,TBNC 亚型为 92%。HR+ 肿瘤患者(6/21,28.6%)监测期间 MRD 阳性率最高,其次是 TNBC(3/16,18.8%)和 HER2+(1/20,5.0%)(图 2)。
值得注意的是,2 例复发患者(HER2+ n=1,HR+ n=1)发生脑转移,没有其他已知的转移部位。这两例患者在基线和复发前均检测到 ctDNA。这些患者的提前期分别为 5.6 个月和 3.8 个月。
小PSP
在 12 例 PSP 较小(11-17 个追踪变异)的患者中,10 例有基线样本。4 例患者(40%)基线时 ctDNA 阳性,2 例不确定,4 例阴性。相比之下,在 PSP ≥ 18 个追踪变异的患者中,34/46例(73.9%)基线时 ctDNA 阳性。值得注意的是,较大的panel并不能保证检出, 4/9例(44.4%)ctDNA 阴性患者的 PSP 大小为 50 个变异。在标志性和监测期间样本中,panel 靶向少于 18 个变异的患者均未复发或检测到 ctDNA。
讨 论
美国临床肿瘤学会(ASCO)和美国国家综合癌症网络(NCCN)都强烈不建议通过常规影像学检查来识别转移性疾病。因此,需要替代策略来识别可能复发的 MRD 患者,从而这些高危患者可以接受辅助治疗,同时降低低风险患者过度治疗的可能性,避免其遭受与额外治疗相关的潜在毒性和费用。本研究显示,在复发患者中,PCM 检测在监测阶段检测 MRD 的临床灵敏度为 76.9%,特异性为 100%,中位提前期为 11.7 个月。
既往研究报道了检测治疗后 MRD 的能力,但是,这些研究使用了不同的技术,仅包括 TNBC 患者或监测晚期复发(诊断后 >5 年)MRD。两项研究也使用肿瘤特异性方法检测 MRD,分别纳入了 49 例和 156 例不同亚型的乳腺癌患者,灵敏度达到 88.2–88.9%;然而,与我们的研究不同的是,这两项研究不仅限于早期乳腺癌患者,还包括 20% 和 33% 的 IIIB/C 期乳腺癌患者。本文首次报告了在所有亚型的早期乳腺癌患者中,使用有限数量的肿瘤特异性变异来检测 MRD 的效用。
值得注意的是,在两例达到 pCR 但后来复发的患者中,PCM 检测到 ctDNA。对于诊断时为高分期疾病的患者,尽管达到pCR,仍有复发风险,在原本预期预后良好的患者中检测到分子复发可能促使干预措施来预防复发。此外,对于 2 例 HR+ 肿瘤患者,ctDNA是在辅助内分泌治疗期间检测到的。最近一项关于结直肠癌患者的研究发现,在术后 4 周 ctDNA 阳性的患者中,接受辅助化疗的患者 24 周前 ctDNA 清除的可能性显著高于未接受化疗的患者。ctDNA 从阳性转为阴性的患者的无病生存率高于保持阳性或从阴性转为阳性的患者。在我们的研究中,PCM 还在两例发生孤立性脑转移的患者中均检测到 ctDNA,平均早于临床发现 4.8 个月。这一结果令人惊讶,因为血脑屏障被认为会限制 ctDNA 进入循环系统,而先前一项纳入 55 例早期乳腺癌女性患者的研究显示,3 例脑转移患者未在任何时间点检测到 ctDNA。虽然在我们的研究中,PCM 在两例孤立性脑转移患者中都检测到 MRD,但患者数量很少。因此,需要进一步的研究来确定 PCM 在检测脑转移方面的效用。
监测期间采集样本的时间和数量可能会影响检测 MRD 的能力。一项研究也纳入了来自 ChemoNEAR 研究的 55 例患者,69% 的基线样本和 19% 的标志性样本(术后 2-4 周收集)为 ctDNA 阳性。在我们的研究中,基线 ctDNA 检出率相似(67.8%),但是,术后 8 周内收集的标志性血浆样本均未显示 ctDNA 阳性。值得注意的是,Garcia-Murillas 等人的研究显示,在复发患者中,监测样本的 ctDNA 检出率(80%)高于标志性样本。76.9% 的复发患者在监测样本中检测到 ctDNA,这些数据强调了治疗后使用 PCM 检测连续样本的重要性。
能够有效检测 MRD 的最佳 PSP 大小的差异很大:一项研究发现,使用 1-7 个变异的灵敏度仅为 31%,而第二项研究显示,分析 ~ 500 个变异时,灵敏度达到 81%,而当 PSP 包含中位 57 个变异时,灵敏度下降到 19%。对于乳腺癌患者来说,使用较少变异检测 ctDNA 至关重要,因为乳腺癌患者的体细胞变异数量通常比其他癌症类型少。先前的一项验证研究表明,当 PCM 在 PSP 中包含 18-50 个变异时,特异性和灵敏度达到> 99.9%。在本研究中,12 例体细胞变异数量较少的患者需要包括 11-17 个变异的较小panel。较小的 PSP 可以在治疗前血浆样本中检测到 ctDNA,尽管没有监测阶段样本检测到 ctDNA。由于突变负荷低的肿瘤患者复发可能性较低,需要更大规模的研究来确定 PCM 在肿瘤知情 DNA 变异数量较少的患者中的效用。
本研究有几个局限性。样本量仅限于 61 例不同乳腺癌亚型的患者。基线和/或标志性时期的一些数据点由于未采集和/或样本处理失败,不可及。与既往研究相比,我们的研究中按亚型划分的 ctDNA 检出模式和检测复发的灵敏度不同:例如,HR+ 和 HER2+ 肿瘤患者的基线 ctDNA 检出率分别为 72% 和 50%,而 Magbanua 等人的研究中分别为 48% 和 84%,在我们的研究中,TNBC 患者的灵敏度为 67%,而 Coombes 等人的研究中为 100%。同时,本研究的中位随访时间为 55 个月;虽然在本研究中 HR+ 组复发率最高,但这组肿瘤通常复发时间较长。例如,一项研究分析了高危 HR+ /HER2- 乳腺癌女性患者诊断后 >5 年的情况,发现 7.2% 的患者(均为 MRD 阳性)发生远处转移。因此,需要更多的研究来确定长期 ctDNA 监测如何预测复发,尤其是在 HR+ /HER2- 乳腺癌中。许多临床试验正在进行中,例如 TRAK-ER(NCT04985266)将确定哌柏西利和氟维司群能否延缓或预防 MRD 患者的复发。
总之,MRD 在所有乳腺癌亚型中均检测到,比临床复发提前很多。监测阶段 ctDNA 阳性与显著较短的无复发生存期相关。因此,PCM 检测是识别复发高风险患者的有效工具,促使早期干预并可能改善患者结局。
参考文献:
Garcia-Murillas I, Cutts RJ, Walsh-Crestani G, Phillips E, Hrebien S, Dunne K, Sidhu K, Daber R, Hubert B, Graybill C, DeFord PM, Wooten DJ, Zhao J, Ellsworth RE, Johnston SRD, Ring A, Russell S, Evans A, Skene A, Wheatley D, Smith IE, Korn WM, Turner NC. Longitudinal monitoring of circulating tumor DNA to detect relapse early and predict outcome in early breast cancer. Breast Cancer Res Treat. 2024 Oct 18. doi: 10.1007/s10549-024-07508-2. Epub ahead of print. PMID: 39424680.

本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言
















前往app查看评论内容
2 0