我国学者发现FOXO3a-BAP1 轴调节蛛网膜下腔出血后早期脑损伤神经元铁死亡
2025-03-20 Selene MedSci原创 发表于陕西省
FOXO3a 和 BAP1 在体内和体外对 SAH 后 SLC7A11 相关铁死亡的影响,抑制 FOXO3a-BAP1 轴可以显着减轻 SAH 后 EBI 的神经元损伤和铁死亡。
蛛网膜下腔出血 (Subarachnoid hemorrhage,SAH) 被认为是一种临床综合征,由大脑底部或表面的血管破裂和血液直接流入蛛网膜下腔引起。早期脑损伤(brain injury,EBI)的治疗对神经功能的恢复至关重要,严重的 EBI 是导致 SAH 患者神经功能预后不良的重要因素。因此,探索 SAH 治疗的潜在靶点和可能的途径可为 SAH 的后续治疗提供重要见解。
铁死亡是一种不同于细胞凋亡、细胞焦亡和自噬的新型细胞死亡模式,逐渐进入脑卒中研究的视野,主要表现为铁代谢紊乱、谷胱甘肽(glutathione,GSH)耗竭和脂质过氧化富集。出血性脑卒中后血红蛋白降解引起的铁蓄积和铁代谢紊乱是神经元损伤的重要原因,细胞内铁蓄积过多是铁死亡的重要前提。一些研究证实SAH后脑损伤中存在过量的铁积累和脂质过氧化富集。抑制脂质过氧化或铁浓度可以显着改善 SAH 后的神经元损伤。溶质载体家族7成员11(Solute carrier family 7 member 11,SLC7A11)是磷脂双层中氨基酸转运蛋白的重要组成部分,也是必需的抗氧化系统的一部分。P53可通过抑制胱氨酸的表达来抑制胱氨酸的吸收和谷胱甘肽 (GSH) SLC7A11,从而导致活性氧 (oxygen species,ROS) 积累和铁死亡。因此,SAH 后 EBI 中 SLC7A11 的具体机制值得进一步探索。
BRCA相关蛋白1(BRCA-associated protein 1,BAP1)属于泛素C末端水解酶(ubiquitin C-terminal hydrolases,UCHs)家族,通过去泛素化直接或间接调节底物蛋白的表达和活性,从而调节相关的信号转导,在细胞代谢和细胞死亡中起重要作用,但其在 SAH 后 EBI 中的特定作用值得进一步研究。
叉头盒蛋白O3a(Forkhead box protein O3a,FOXO3a)是一个进化上保守的转录因子家族,参与调节神经系统内的细胞功能和存活,特别是与氧化应激反应、神经元死亡和自噬有关。FOXO3a 在大脑皮层和海马体中含量较高,急性神经元损伤(如缺血性卒中和创伤性脑损伤)中 FOXO3a 的激活会诱导细胞死亡、脂质过氧化和神经炎症。目前尚不清楚 BAP1 是否参与 FOXO3a 蛋白的去泛素化。因此,探讨 FOXO3a-BAP1 在 SAH 后 EBI 发病机制中影响神经元铁死亡的潜在机制至关重要。
2月27日,武汉大学人民医院李明昌教授团队在Redox Biology(if=10.7)上在线发表了题为“FOXO3a-BAP1 axis regulates neuronal ferroptosis in early brain injury after subarachnoid hemorrhage”的研究,结果发现FOXO3a 和 BAP1 在体内和体外对 SAH 后 SLC7A11 相关铁死亡的影响,抑制 FOXO3a-BAP1 轴可以显着减轻 SAH 后 EBI 的神经元损伤和铁死亡。
本研究通过一系列的实验操作,结果表明:
体内和体外 SAH 后神经元的铁死亡,并伴有 FOXO3a 和 BAP1 表达的上调。抑制 BAP1 可显著降低神经元脂质过氧化和铁死亡水平,减轻 SAH 小鼠的神经功能缺损、脑水肿和脂质过氧化。ChIP 实验表明,FOXO3a 可以与 BAP1 的启动子区结合,从而调节其 mRNA 表达水平。沉默 FOXO3a 可以调节 BAP1 的表达,减少脂质过氧化和神经元铁死亡。过表达 FOXO3a 可增加 BAP1 的表达并加重神经元的铁死亡。此外,CoIP 实验显示,去泛素化酶 BAP1 通过 UCH 结构域直接与 FOXO3a 相互作用,并介导 FOXO3a 蛋白的去泛素化。这些结果还表明,FOXO3a-BAP1 轴可以通过转录组调控和去泛素化修饰增强 SAH 后神经元的铁死亡。
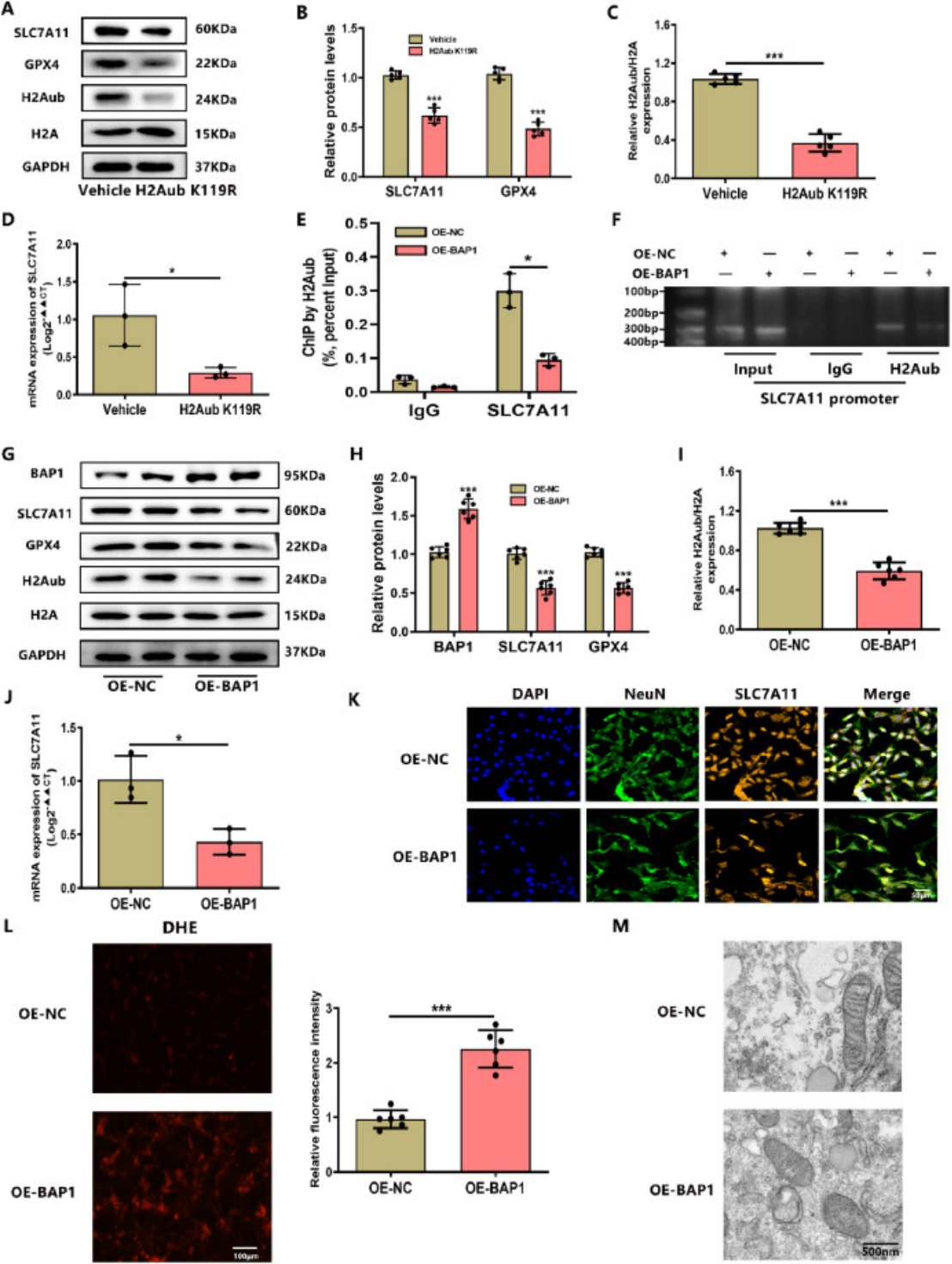
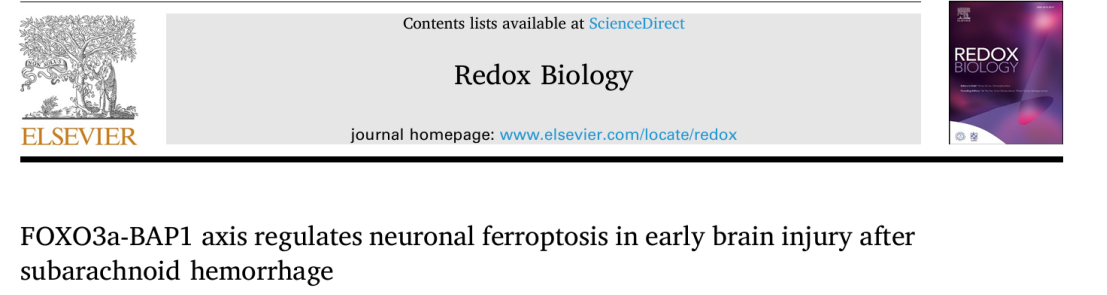
图 1.BAP1 通过调节 H2Aub 水平影响神经元中SLC7A11蛋白表达 (A-C) 蛋白质印迹图像和定量数据显示 293T 细胞中 H2Aub、H2A、SLC7A11 和 GPX4 表达水平 (n = 5/组)
单泛素 H2Aub 主要发生在赖氨酸 K119 位点,与染色质中的基因抑制有关。BAP1 被 ASXL1 激活,可以选择性地去泛素化 H2Aub K119 位点,该位点参与调节细胞生理活动和各种细胞损伤模式。本研究结果显示,转染 H2Aub K119R 突变质粒降低了 SLC7A11 和 GPX4 的转录和蛋白表达,过表达 BAP1 可通过调节 H2Aub 水平促进神经元铁死亡,BAP1和H2Aub在SLC7A11的表达中起着重要的调节作用。小鼠实验还表明,抑制 BAP1 可通过提高 SAH 小鼠的神经功能评分、减轻脑水肿和组织损伤、缓解脑组织中脂质过氧化程度来发挥神经保护作用。因此,BAP1 可以调节 SAH 后 EBI 中的神经元铁死亡。
FOXO3a 广泛参与中风后的病理损伤过程。结果表明,随着血红素处理时间的延长,血红素处理神经元中 FOXO3a 和 BAP1 蛋白的表达逐渐增加。SAH 小鼠大脑皮层中 FOXO3a 和 BAP1 蛋白的表达也显著升高,在 24 h 达到峰值。72 h后,两组蛋白表达均下降,但仍高于假手术组。脑组织的免疫荧光还显示 SAH 后神经元中 FOXO3a 和 BAP1 表达显着增加,这些蛋白质主要位于细胞核内。SAH后FOXO3a表达增加可能与神经元损伤和脑组织损伤有关。为进一步研究转录因子 FOXO3a 对 BAP1 的影响,构建了 BAP1 启动子序列突变质粒,并进行了染色质 CoIP、qPCR 和双荧光素酶报告基因实验。实验结果表明,FOXO3a 可以与 BAP1 启动子序列结合。它主要通过结合 BAP1 启动子的B 位点(pre-TSS -1761∼ -1754)和 D位点(pre-TSS -1007~ -1000)起作用。沉默FOXO3a 显著抑制 BAP1 的表达,调节 SLC7A11 和 GPX4 的水平,减弱神经元中脂质过氧化和线粒体损伤的水平。此外,它减少了 SAH 小鼠的神经功能缺损和脑水肿,而 FOXO3a 的过表达加剧了 SAH 后神经元铁死亡和脂质过氧化的程度。
图 2.BAP1 从 FOXO3a 中去除 K48 连接的多泛素,并以去泛素酶活性依赖性方式稳定其蛋白质 (A) 通过光密度测定法定量 FOXO3a 的表达水平,并在用 CHX 和 sh-NC/sh-BAP1 处理 HT22 细胞指定时间间隔后绘制 (n = 3/组)
另外,结果表明,BAP1可能通过UCH结构域与FOXO3a的FKH-DBD + NLS结构域之间的特异性相互作用参与 FOXO3a 蛋白的翻译后调控。FOXO3a 表达的显著上调伴随着 BAP1 过表达持续时间的延长,而 FOXO3a 表达的增加随着 BAP1 的C91S突变体的过表达而显著降低。将Flag-FOXO3a、HA-BAP1和各种泛素突变体(K48、K63、K48R 和 K63R)转染到 293T 细胞中后,观察到 BAP1 主要降低 FOXO3a 蛋白在 K48 位的泛素修饰,从而验证了关于 FOXO3a 半衰期的实验结果。这些结果最终表明,BAP1 通过 K48 泛素化位点促进了 FOXO3a 蛋白的去泛素化,而BAP1蛋白的 C91S 位点在此过程中起着关键作用。
总之,研究发现BAP1可以通过调节 H2Aub 的细胞水平来转录调节 SLC7A11 表达并影响 SAH 后神经元的铁死亡水平。此外,转录因子 FOXO3a 与 BAP1 启动子的结合可以通过增强 BAP1 表达来调节神经元脂质过氧化和铁死亡。去泛素酶 BAP1 能够直接与 FOXO3a 蛋白结合,促进其去泛素化,从而维持 FOXO3a 的稳定性。因此,FOXO3a-BAP1 轴可能代表了解决 SAH 患者神经元铁死亡的一种有前途的治疗策略。
原始出处:
FOXO3a-BAP1 axis regulates neuronal ferroptosis in early brain injury after subarachnoid hemorrhage. Redox Biol. 2025 Feb 27;82:103550. doi: 10.1016/j.redox.2025.103550. Epub ahead of print. PMID: 40080966.

本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言













#蛛网膜下腔出血# #铁死亡# #BAP1# #FOXO3a 蛋白#
4