Nat Cancer:重庆医科大学肖柳玲等揭示了Tc9细胞在体内激活肿瘤特异性CD4+ T细胞的机制!
2025-04-08 iNature iNature
该研究表明过继转移的肿瘤特异性产生IL-9的细胞毒性CD8+ T细胞激活宿主CD4+ T细胞以控制抗原丢失的肿瘤。
宿主效应CD4+ T细胞作为肿瘤消退的关键介质出现,但它们是否能被适应性转移的CD8+ T细胞激活仍然未知。先前报道过继转移产生白细胞介素9 (IL-9)的细胞毒性CD8+ T (Tc9)细胞实现了对肿瘤生长的长期控制。
2025年4月3日,重庆医科大学肖柳玲、美国康奈尔医学院易庆共同通讯在Nature Cancer在线发表题为“Adoptively transferred tumor-specific IL-9-producing cytotoxic CD8+ T cells activate host CD4+ T cells to control tumors with antigen loss”的研究论文,该研究表明过继转移的肿瘤特异性产生IL-9的细胞毒性CD8+ T细胞激活宿主CD4+ T细胞以控制抗原丢失的肿瘤。
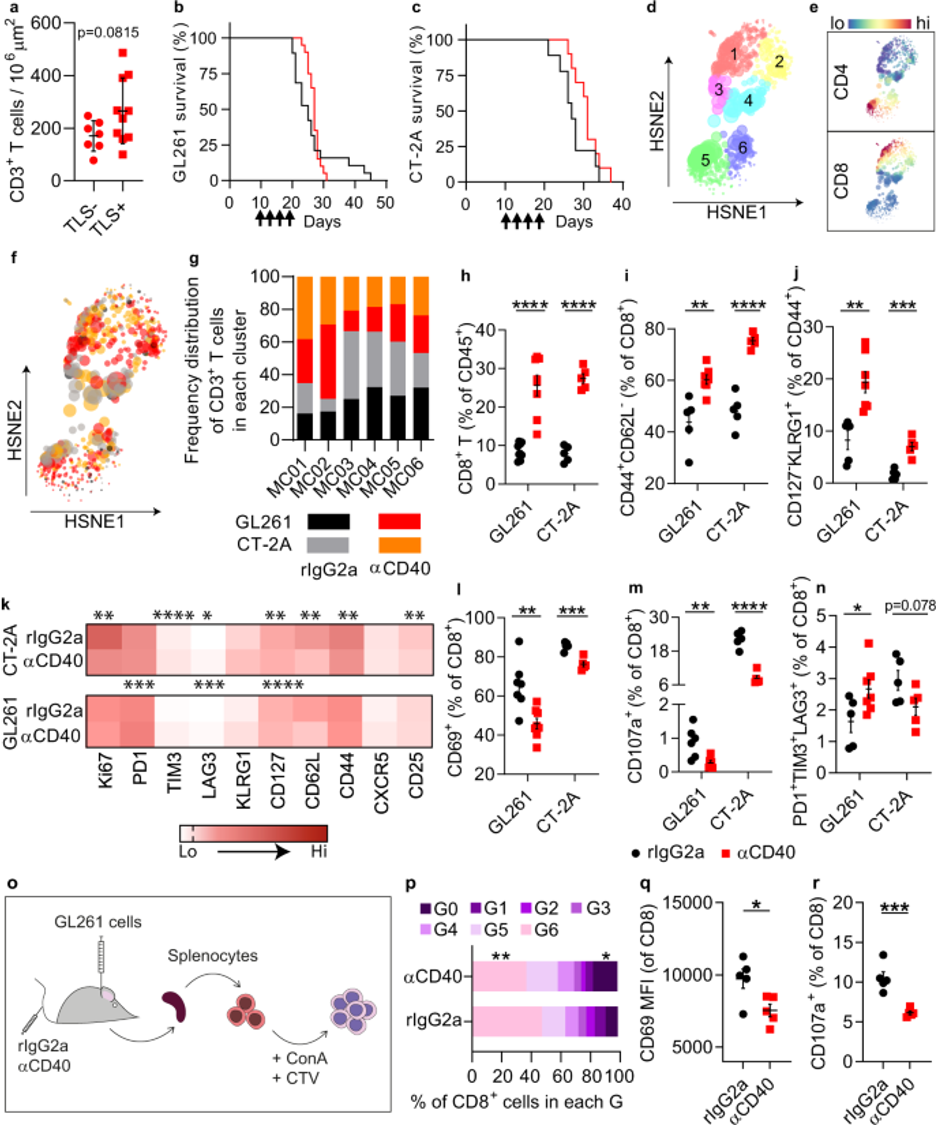
该研究证明了鼠肿瘤特异性Tc9细胞通过募集和激活宿主效应CD4+ T细胞来控制抗原缺失复发肿瘤的生长。Tc9细胞分泌IL-24,并将表达CCR7的常规2型树突细胞(cDC2细胞)募集到肿瘤引流淋巴结中,以引发宿主CD4+ T细胞对抗复发肿瘤。宿主CD4+ T细胞或cDC2缺陷削弱了Tc9细胞控制复发肿瘤生长的能力。此外,在人类癌症中,肿瘤内IL24表达与cDC2和CD4+ T细胞基因标记相关,并且它们的表达与更好的患者存活率相关。这项研究报告了体内激活肿瘤特异性CD4+ T细胞的机制。

近年来,依靠强效抗肿瘤T细胞靶向破坏癌细胞的癌症免疫疗法取得了前所未有的成功。作为癌症免疫疗法的主要形式,过继性T细胞疗法(ACT)在某些癌症患者中表现出持久的反应。然而,这种反应通常是短暂的,并且由于抗原丢失变异体(ALV)肿瘤的生长和较差的抗肿瘤免疫反应,肿瘤会复发。为了防止肿瘤复发,已经开发了几种策略,例如在ACT后激活宿主免疫。随着肿瘤的发展,宿主通过识别肿瘤而自发启动免疫反应。越来越多的证据表明,在包括黑色素瘤、乳腺癌和结肠癌在内的各种癌症中,宿主淋巴细胞浸润与预后改善之间存在正相关关系。然而,大多数肿瘤细胞免疫原性差,并且免疫抑制性肿瘤微环境(TME)阻碍了宿主免疫。因此,激活宿主免疫被认为是癌症免疫治疗的一个有吸引力的选择。
关于宿主免疫的激活,大多数研究集中在CD8+ T细胞上,但最近的研究表明,CD4+ T细胞也识别比以前更高百分比的新抗原,并引发有效的抗肿瘤能力。据报道,在对细胞毒性T淋巴细胞相关蛋白4 (CTLA4)治疗或疫苗治疗的反应中,宿主效应CD4+ T细胞可被诱导产生强烈的抗肿瘤效应。然而,过继转移的CD8+ T细胞是否可以通过诱导宿主CD4+ T细胞反应来根除肿瘤尚未被描述。
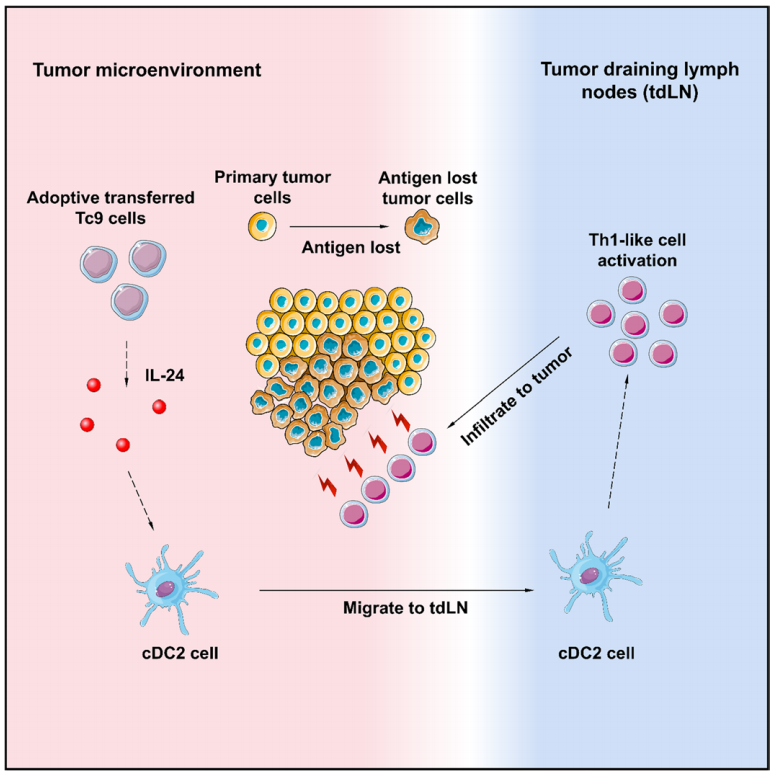
机理模式图(图源自Nature Cancer )
除了传统的细胞毒性CD8+ T细胞(CTL/Tc1)之外,新兴的研究表明,初始CD8+ T细胞可以分化成各种亚群。分泌白细胞介素9 (IL-9)的细胞毒性T (Tc9)细胞是最近鉴定的CD8+ T细胞亚群,在体外由产生IL-9的辅助性T细胞(Th9)极化条件下的初始CD8+ T细胞产生,并已在各种小鼠和人类组织中检测到。
在这里,研究人员报道了肿瘤特异性Tc9细胞通过诱导针对ALV肿瘤的宿主CD4+ T细胞应答来抑制复发肿瘤的生长,这些肿瘤已经失去了主要肿瘤抗原的表达。机理研究表明,肿瘤浸润性Tc9细胞分泌高水平的IL-24,它吸引树突细胞(DCs),特别是常规2型DCs (cDC2),激活宿主效应CD4+ T细胞,并控制小鼠肿瘤模型中ALV肿瘤的生长。在人类黑色素瘤和乳腺癌中发现了IL24–CD C2–效应CD4+ T细胞轴,并观察到其基因标记的表达与癌症患者的生存率之间存在正相关。综上所述,该研究报告了Tc9细胞通过IL24-DC回路诱导宿主效应CD4+ T细胞应答,抑制TME含ALV肿瘤生长的机制。这表明激活宿主效应CD4+ T细胞可能是增强ACT对人类癌症的抗肿瘤效果的有前途的方法。
参考信息:
https://www.nature.com/articles/s43018-025-00935-0

本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言















#癌症免疫疗法# #Tc9细胞#
10