【协和医学杂志】血管化脑类器官的技术进展与应用前景
2025-04-11 协和医学杂志 协和医学杂志 发表于重庆
本文系统阐述类器官技术在脑血管疾病领域的应用进展,深入探讨血管化脑类器官模型的构建方法,分析基于这些模型的药物研究与疾病机制研究成果,并评估其在脑血管疾病治疗方面的应用前景。
脑血管病是一类以脑部血管病变为基础,导致脑组织发生缺血性或出血性损伤的疾病,具有高发病率、高致残率和高死亡率等特点[1-2]。在全球范围内,脑血管病已成为导致死亡和长期残疾的主要原因之一,给患者及其家庭带来沉重经济和心理负担的同时,也对社会医疗资源构成了巨大挑战[3]。在我国,脑血管病的发病率和患病率呈逐年上升趋势,其防治形势十分严峻,已成为公共卫生领域亟待解决的重要问题。
类器官技术作为生物医学领域的重大突破,近年来发展迅速。类器官是具有一定组织结构和功能的微型器官模型,由干细胞或组织细胞在体外培养形成,能够模拟体内器官的发育、生理和病理过程[4]。自2009年Hans Clevers团队首次成功培育出肠道类器官以来,类器官技术在多个器官系统的研究取得了显著进展[5]。在脑血管疾病领域,类器官技术展现出了广阔的应用前景。通过构建脑类器官,研究人员能够在体外模拟脑血管疾病的发病机制,深入探究血管生成、神经血管单元相互作用等关键环节,为疾病的早期诊断、治疗靶点的发现以及药物研发提供全新的研究平台[6-8]。尽管类器官技术在脑血管疾病研究领域具有较大潜力,但目前仍面临诸多挑战,其中血管化问题是制约其进一步发展的关键瓶颈。血管化对于类器官的生长、成熟和功能维持至关重要,缺乏完善的血管系统将导致类器官内部营养和氧气供应不足,代谢废物堆积,影响其长期存活和功能发挥[9]。
鉴于类器官技术在脑血管疾病研究与治疗领域展现出的潜力以及面临的挑战,本文系统阐述类器官技术在脑血管疾病领域的应用进展,深入探讨血管化脑类器官模型的构建方法,分析基于这些模型的药物研究与疾病机制研究成果,并评估其在脑血管疾病治疗方面的应用前景。
1 血管化脑类器官模型的构建
1.1 体内移植
生成血管化脑类器官的首要方法之一是将其植入动物模型中[10-12]。一项研究采用慢病毒载体标记绿色荧光蛋白(GFP)的人类胚胎干细胞(hESCs)培育大脑类器官胚状体(EBs),并在体外精心培养40~50 d,确保这些类器官具备清晰的胚体边界、径向排列的神经上皮及定义明确的芽[10]。
经严格筛选后,这些类器官被移植至成年免疫缺陷小鼠(NOD-SCID)的压后皮质区域。移植手术包括在小鼠大脑中制造一个空腔,将类器官植入其中,并用盖玻片和粘合剂密封,形成颅窗,图1展示了小鼠体内移植类器官模型构建的示意图。
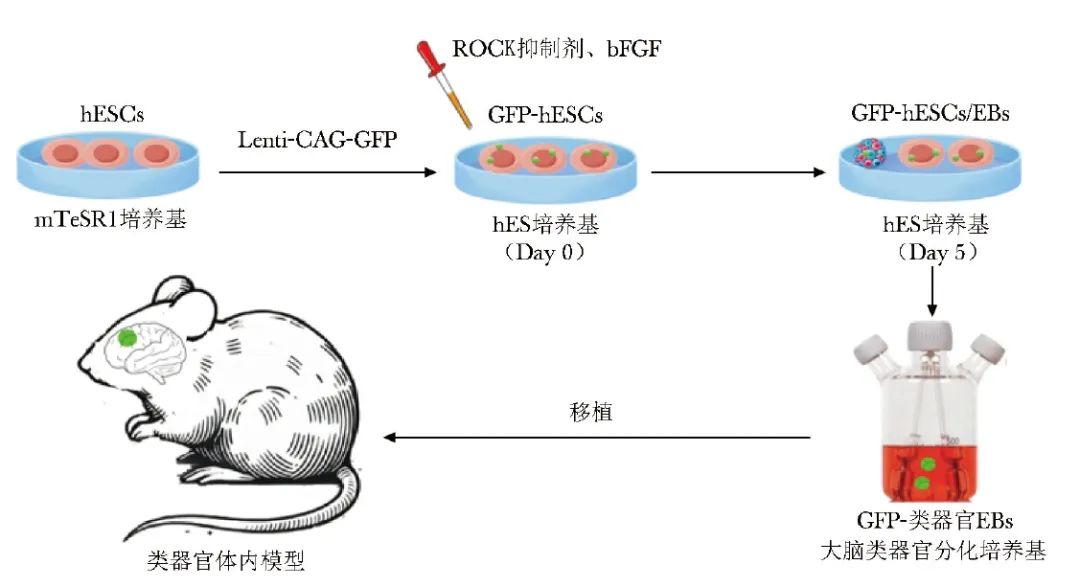
图1 体内移植类器官模型示意图
hESCs(human embryonic stem cells):人类胚胎干细胞;GFP(green fluorescent protein):绿色荧光蛋白;ROCK(Rho-associated protein kinase):Rho相关蛋白激酶;bFGF(basic fibroblast growth factor):碱性成纤维细胞生长因子;EBs(embryoid bodies):胚状体
术后7~10 d,宿主血管开始侵入类器官,术后14 d可形成广泛的血管网络,血管化成功率达到(85.4±6.4)%,且这些血管均源自宿主。这个过程不仅显著提高了类器官的存活率,还促进了神经元的渐进分化和成熟、神经胶质的生成、小胶质细胞的整合,以及轴突向宿主大脑多个区域延伸。通过体内双光子成像技术,研究人员直接观察到移植物中功能性神经元网络和血管的存在。进一步的体内细胞外记录结合光遗传学技术揭示了移植物内神经元的活动,并证实了移植物与宿主大脑之间功能性突触连接的建立。
上述发现表明,将脑类器官移植至富含血管的微环境中,可有效利用宿主血管的天然生成能力,实现类器官的血管化和功能化。总体而言,脑类器官的体内移植策略成功克服了坏死核心的限制,通过提供有效灌注显著提升了类器官的活力。
体内移植类器官模型在一定程度上弥补了体外类器官模型中血管系统与完整人类大脑生理环境相互作用的缺失,但这一技术目前仍面临诸多问题。首先,模型中的血管成分源自鼠类,这一特点限制了其在人类应用的可移植性,从而阻碍了模型向临床转化的进程。其次,目前观察到的体内移植类器官模型类似于晚期胚胎或早期出生后的组织,其成熟度和空间结构仍与正常血管存在差距。此外,如何精确监测和量化模型的功能表现,尤其是复杂的血流变化、血管壁的应力和变形,仍是技术上的一大难题。
1.2 体外培养
1.2.1 类器官的内皮化
成血管化脑类器官的关键挑战是协调不同胚层和细胞命运的诱导因子,这些因子常存在相互抑制现象。因此,一些研究方案选择分别培养脑类器官和血管类器官。也有方法通过将非外胚层来源的细胞或其祖细胞直接引入脑类器官中,形成多谱系组装体[13-15]。
一项开创性研究首次尝试生成来源于同一患者的同源结构[12]。该研究利用患者来源的人诱导多能干细胞(hiPSCs)分别生成脑类器官和内皮细胞(ECs),随后在分化后进行共培养。研究中通过无翅型整合位点(Wnt)信号激活诱导中胚层细胞,并采用骨形态发生蛋白4(BMP4)、血管内皮生长因子(VEGF)和成纤维细胞生长因子2(FGF2)分化为内皮祖细胞。在分化至第34天时,将脑类器官重新嵌入含内皮祖细胞的聚合Matrigel基质胶中,继续在体外培养3~5周,最终形成具有较强血管结构的类器官。尽管研究未对神经元区室的细胞结构进行详细描述,但类器官中出现了多条具有穿透性和灌注功能的血管。这些血管表达了人类ECs标志物分化簇31(CD31),证明患者来源的ECs能够成功用于脑类器官的血管化。
此后,相关研究将hESCs或hiPSCs与人类脐静脉内皮细胞(HUVECs)共培养,成功构建了具有血管结构的脑类器官模型(vOrganoids)[16]。在培养过程中,细胞首先聚集成胚状体样结构,随后经历神经诱导和分化。研究者发现HUVECs在vOrganoids中形成网状和管状结构,这些结构主要分布于脑室区/亚脑室区上方,而该区域正是神经干细胞和前体细胞的富集地。随着发育进程的推进,血管结构不断向新生神经元区域延伸,且这种状态可持续200 d以上。电生理学进一步检测显示,vOrganoids中存在自发兴奋性突触后电流、自发抑制性突触后电流以及双向电传输现象,表明vOrganoids内部具备化学和电突触。通过单细胞RNA测序分析,研究人员验证了vOrganoids在细胞类型和分子属性上与人类胎儿端脑具有高度相似性,并发现vOrganoids的发育速度相较于非血管化类器官更快。此外,体内移植实验结果证实,vOrganoids可与宿主脑组织实现良好整合,并与宿主血管系统建立了功能性连接。
另一类脑类器官血管化策略则是通过基因改造,在脑类器官形成过程中诱导ECs分化[14]。研究显示,从hESCs生成人类皮质类器官,并对其进行基因改造,可异位表达人类ETS突变体2(ETV2)。ETV2能够促使hESCs分化为ECs,这一过程不依赖特定的分化条件,也无需生长因子(如VEGF等)。实验中确定了最佳ETV2表达细胞比例(20%),并于第18天开始诱导ETV2表达,这样处理的类器官可有效形成血管样结构。这些结构不仅在形态上表现为ECs标志物的表达,且在功能上可支持氧气和营养物质的传输,减少细胞死亡,并促进神经元成熟。此外,这些血管化的类器官还展现出血脑屏障(BBB)特性,包括紧密连接、营养转运蛋白和跨内皮电阻表达增加。通过单细胞转录组分析,研究进一步证实了血管化可促进神经元成熟。该模型的一个重要特征是血管状结构被星形胶质细胞和周细胞包围,与人类神经血管单元的组成非常相似。这种单一转录因子介导的方法可跨胚层诱导血管化,并实现类器官中细胞命运诱导时间的精准控制。
1.2.2 血管类器官融合
作为一种创新性可选方案,一项研究提出了混合神经血管球体新策略,以实现脑类器官的有效血管化[17]。研究者们在hiPSCs基础上独立培养了诱导神经祖细胞(iNPCs)和诱导内皮细胞(iECs)的细胞球体;随后,在两种球体的混合培养基中加入人间充质干细胞(MSC)和SB431542、LDN193189等试剂,形成iNPC-iEC-MSC融合球体。图2展示了体外球体融合类器官模型构建的示意图。
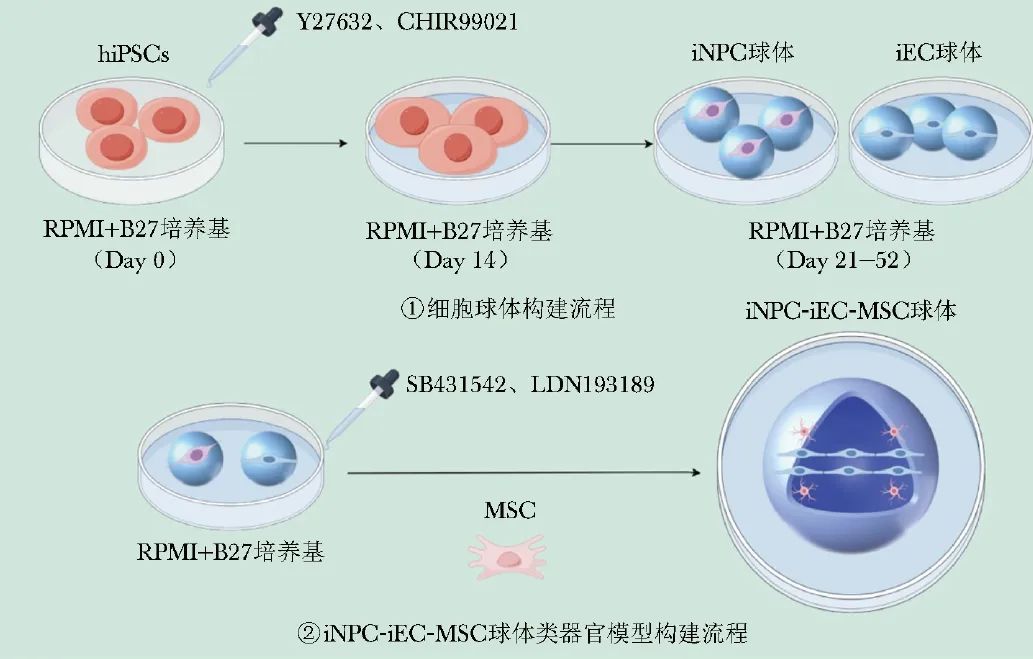
图2 体外球体融合类器官模型示意图
hiPSCs(human induced pluripotent stem cells):人诱导多能干细胞;iNPC(derived neural progenitor cell):诱导神经祖细胞;iEC(derived endothelial cell):诱导内皮细胞;MSC(mesenchymal stem cell):间充质干细胞
在融合实验中,研究者们精心调整了培养基成分,发现5%的Geltrex基质胶和0.025 wt%的透明质酸能够显著促进球体融合,而高浓度的ROCKi Y27632则对融合过程产生了阻碍效果。通过一系列评估手段,包括细胞增殖、代谢活性检测、细胞因子分泌分析、神经与血管标志物的表达检测以及基因表达分析,研究者们观察到融合后的球体不仅成功促进了神经元和血管细胞的分化,还表现出与脑区特异性标记、基质重塑以及BBB特性相关的基因表达水平显著上调。
此外,电生理特性测试进一步证实了融合球体衍生的细胞具备神经元功能和形态学特征。相较于传统的直接混合方法,球体融合策略展现出了显著优势。该策略避免了细胞分离和重新组合的过程,减少了细胞损失,同时允许创建具有精心设计隔间的混合球体结构,从而为研究人员提供了更精准的实验控制。此外,这种精确的排列方式通过组装皮质球体、血管球体和MSC,促进了VEGF-A的分泌,进而加速了皮质组织发育,并展现出层次分布潜力。
1.2.3 生物工程技术
尽管众多体外培养模型均出现分支血管,且其灌注能力也得到了预测或证实,但这些模型普遍存在一个缺陷,即缺乏主动血流。除此之外,在精确性、重复性、功能模拟以及实验应用等多个方面,也存在不同程度的限制。而生物工程类技术,如3D(three-dimensional)打印技术、微流控芯片技术等相继涌现与不断发展,为突破这些限制带来了新的希望与可能[18]。
微流控芯片技术是在微米尺度上精确操控流体,集成生物、化学、医学分析过程的技术,具有体积小、速度快、用量少、成本低等优点,适用于类器官血管化研究中精确控制微环境和细胞共培养[18]。相关研究设计并制造了一种“开放式井”结构的微流控芯片,利用3D打印技术,并选用Dental SG树脂作为打印材料[19]。通过特殊的清洗程序,确保了芯片的生物相容性。该芯片中央是类器官培养室,两侧设有微流控通道,二者通过50 μm的间隙相连,允许细胞和分子交换。
血管细胞和脑类器官均从人类多能干细胞(hPSC)分化而来。在分化的第6天,血管细胞被接种至微流控通道中;而在分化的第5天,脑类器官则被接种至类器官培养室,实现了二者的共培养。在含有VEGF-A培养基的诱导下,血管细胞从微流控通道向类器官培养室伸出血管芽,形成有序的血管网络,并与脑类器官相互作用,最终形成整合的神经血管类器官。共培养实验结果表明,血管细胞的存在可能加速脑类器官的成熟过程。此外,生成的血管网络不仅结构完整,且具有功能性,可进行小分子灌注和通透性实验。
相较于体内移植模型,各种体外类器官模型具有环境变量控制性强、成本低、灵活性和重复性高、伦理问题少等一系列优势。但体外模型无法完全再现体内复杂的生理和生物学条件、无法模拟真实的血液动力学环境,虽可通过培养不同类型的细胞模拟细胞群体和细胞间的交互作用,但其行为可能与体内复杂的组织环境不同,导致实验结果出现偏差。对于长时间体外培养的血管化脑类器官,如何保证组织的持续生长和功能稳定也是面临的一项技术难题。各种生物工程技术展现出了解决上述问题的潜力,但现阶段在应用方面仍不够成熟,需进一步深入研究。
2 基于血管化脑类器官的药物研发
BBB是维持中枢神经系统稳态的关键屏障,其通透性调控直接关系到药物跨屏障输送的效率以及在脑组织中的疗效,是中枢神经系统药物研究不可忽视的重要因素。血管化脑类器官在一定程度上再现了BBB的结构与功能,为中枢神经系统药物研发提供了一个全新平台。Saglam-Metiner等[8]介绍了一种ICU患者芯片平台,该平台将hiPSCs分化的肥大细胞与脑类器官相结合,并在三维基质中进行培养,从而成功模拟了BBB与脑组织之间的相互作用。该平台利用一层覆盖有人类脑微血管ECs的膜模拟血管腔与组织室的分离,部分再现了BBB的结构和功能。研究发现,异丙酚能够激活肥大细胞、微胶质细胞和星形胶质细胞,进而增加一系列促炎基因的表达。同时,还伴随脑组织中缝隙连接蛋白、抑制性神经递质受体以及兴奋性神经递质受体表达水平升高。表明异丙酚可能通过激发神经炎症反应和改变神经递质平衡,进而影响神经元的功能和存活。
相比之下,咪达唑仑对BBB的破坏作用更为显著,其能够降低ECs之间的电阻值、增加屏障通透性及损伤屏障完整性。此外,咪达唑仑还可激活肥大细胞和小胶质细胞,加剧谷氨酸相关的神经毒性,并诱导白细胞介素、干扰素等炎症因子过度表达,这些作用最终导致脑组织细胞凋亡明显增多。咪达唑仑还抑制了抑制性神经递质受体和兴奋性神经递质受体的表达,进一步扰乱神经递质平衡,从而对脑组织功能造成显著负面影响。
与传统研究模型相比,血管化脑类器官技术结合微流控平台更贴近人脑的生理环境,可更准确地反映药物在脑部的作用机制,为中枢神经系统药物研究提供了强有力工具,有助于推动相关药物研发工作的深入开展。但BBB并非孤立存在,而是由ECs、星形胶质细胞、平滑肌细胞等共同作用维持,模拟这些周围细胞与ECs相互作用对于再现BBB功能同样重要,如何通过体外模型进一步复现BBB紧密连接的结构和选择性透过药物分子的功能是后续研究的重点。
3 脑血管疾病机制的探究
脑类器官模型在模拟人体组织三维结构及细胞间复杂相互作用方面更具精准性,为深入探究疾病发病机制带来了独特优势[20]。近期,一项研究借助脑类器官芯片,为遗传性出血性毛细血管扩张症(HHT)1型发病机制的研究提供了新的视角与见解[7]。HHT是一种以血管脆弱为显著特征的遗传性疾病,其中HHT 1型是由ENG(ENDOGLIN)基因突变所引发。该研究从1例罕见的嵌合HHT 1型患者体内获取细胞,成功生成了同源的突变型和正常型hiPSCs,并进一步将其分化为ECs,从而在体外模拟出HHT 1型血管状况。研究结果显示,在二维培养条件下,突变型和正常型ECs的功能表现相似。然而,当其置于三维模型中时,突变型ECs所形成的血管网络却呈现出诸多组织缺陷:血管密度明显降低、直径变小、ECs数量减少,且血管渗漏现象显著增加。此外,突变型ECs与脑血管周细胞之间的相互作用也受到损害,周细胞的覆盖率大幅下降,且与ECs的距离更远,进一步加剧了血管的脆弱性。荧光葡聚糖渗漏实验进行验证,证实突变型血管的渗漏程度更高,反映出其屏障功能出现明显受损。
此外,另一项研究通过构建患者源性类器官,成功复制了脑海绵状畸形(CCM)的特征,为深入理解CCM的发病机制提供了重要见解[21]。CCM是一种遗传性脑血管疾病,其特征是由众多薄壁血管组成的海绵状异常血管团,其易破裂出血,导致卒中和神经功能障碍。该研究观察到,CCM患者源性的BBB类器官中内皮通道异常扩大,且通道呈现背靠背排列,这一现象与体内CCM的病理特征高度相似。进一步分析显示,这些类器官中紧密连接蛋白和基底膜蛋白的表达显著降低,这表明BBB的完整性受到了破坏。单细胞RNA测序揭示了ECs中病变标记基因显著上调,以及血管生成相关基因表达增强,表明ECs的病理变化在CCM发病机制中占据主导地位。此外,研究还发现CCM患者的MSC向血管平滑肌细胞分化的潜能减弱,这种平滑肌细胞的发育损失可能是导致CCM发病的关键因素之一。
4 脑血管疾病治疗的新策略
类器官技术作为一种新兴的脑血管疾病治疗策略,正展现出较大发展潜力。2020年,一项研究首次探索了脑类器官技术在缺血性卒中治疗中的可行性和潜在机制[22]。研究人员将培养了55 d的脑类器官移植至大鼠大脑中动脉闭塞模型中,发现脑类器官移植后不仅显著减小了脑梗死体积,还显著改善了神经功能,这种效果与脑类器官的多系分化能力密切相关。移植的脑类器官能够模拟体内皮质发育,分化出多种细胞类型,包括神经前体细胞、神经元和星形胶质细胞等,通过神经发生、突触重建、轴突再生和血管生成作用,促进脑损伤修复。此外,移植细胞可沿胼胝体广泛迁移并在受损区域长时间存活。
研究还表明,卒中后6 h或24 h内移植类器官可显著减轻脑损伤并改善行为表现,而超过7 d则移植效果有限,这一研究为脑类器官作为一种新型缺血性卒中治疗策略提供了重要证据。随后,另一项研究在该领域进一步探索,尤其是脑类器官在长期组织修复和功能恢复中的作用[23]。研究人员利用hPSC诱导生成脑类器官,并将其移植至NOD-SCID小鼠脑梗死核心与梗死周边交界处,数月后类器官在脑梗死核心区域内可长期存活,分化为目标神经元,形成与宿主神经网络相连接的功能性突触,恢复受损脑组织结构。
移植的类器官在梗死区域内分化为成熟的谷氨酸能神经元,还通过轴突延伸连接至远端脑区,整合至宿主神经回路。这种结构修复和功能整合体现在小鼠行为改善上,包括感知和运动功能的恢复。与单一细胞移植相比,脑类器官移植表现出更高的细胞存活率、更强的组织修复能力和更优越的神经功能恢复效果。这一研究完善了脑类器官移植的实施方法,证明其可重建梗死组织并恢复卒中后功能障碍。由此可见,脑类器官为脑血管疾病的治疗开辟了一条极具潜力的新途径,其在缺血性卒中治疗领域的应用前景令人期待。
5 小结与展望
类器官技术为脑血管疾病的研究和治疗开辟了新视角,其在疾病机制探究、药物研发及治疗策略中的应用展现出了广阔潜力。通过体内移植、体外培养以及生物工程技术的创新发展,血管化脑类器官的构建逐步克服了传统模型在结构和功能上的局限,为研究神经血管单元相互作用、血管生成及BBB功能提供了更接近人体生理环境的实验平台。此外,这些模型在药物筛选中实现了中枢神经系统药物效应的精确评估,为复杂脑血管疾病的发病机制研究提供了突破性手段,在治疗策略方面展现出了重要潜力。
尽管类器官技术取得了诸多进展,但仍面临诸多挑战。伦理问题和安全性评估是其临床应用中的关键问题,特别是涉及人类干细胞和基因编辑技术问题。人类干细胞的使用(特别是胚胎干细胞),涉及伦理问题,因其来源于胚胎,且在胚胎发育过程中可能导致生命终结。为确保其伦理合规性,所有使用人类干细胞的研究均必须严格遵守国际伦理规范,确保研究参与者知情同意,并保证数据的透明性。此外,基因编辑技术(如CRISPR/Cas9),虽为类器官研究提供了强大工具,但也伴随伦理问题和安全性风险,特别是对生殖细胞或胚胎进行基因编辑时,可能引发设计婴儿的伦理争议,并对后代的遗传信息产生不确定影响。因此,基因编辑技术在临床的应用必须经过严格的伦理审查,并确保编辑过程不会对患者及其后代产生不可预见的后果。所有基因编辑操作应遵循“最小干预”原则,仅对必要的基因进行精准修正。
在安全性评估方面,类器官技术的临床转化面临细胞异质性、免疫反应、肿瘤发生风险等挑战。类器官在体外培养中的异质性可能导致不同患者之间的效果差异。因此,需通过严格的动物实验和长时间的安全性测试评估其临床应用风险。此外,类器官移植后可能引发免疫排斥反应、癌变风险等问题,需通过实验数据进一步验证,并制订详细的安全性评估标准。
在技术实现方面,体外类器官模型在控制环境变量、降低成本和伦理问题方面具有优势,但难以完全再现体内复杂的生理环境和血液动力学,且长期培养时如何维持功能稳定仍是难题。体内移植模型虽然弥补了这一缺陷,但血管成分源自鼠类,限制了其在人体的临床应用。此外,这些模型的成熟度和血管功能尚存在差距,血管化效率和主动灌注能力的进一步优化亟待解决[18]。BBB的模拟也面临挑战,特别是如何有效复现紧密连接和药物透过性方面,需开展进一步研究和技术突破。
结合基因编辑、微流控技术及高通量3D打印等前沿手段,未来有望进一步提升类器官模型的精确性和功能性。特别是在脑血管疾病领域,探索血管化脑类器官在个性化治疗方面的应用潜力,如针对特定患者设计定制化的药物筛选平台和治疗方案,将推动精准医疗的发展。与此同时,随着生物工程技术的进步和多学科协作的深化,类器官技术有望逐步实现从实验室到临床的转化[24],为脑血管疾病的诊疗带来革命性突破。
参考文献
[1]Walter K. What is acute ischemic stroke?[J]. JAMA,2022,327(9): 885.
[2]Montaño A,Hanley D F,Hemphill J C,3rd. Hemorrhagic stroke[J]. Handb Clin Neurol,2021,176: 229-248.
[3]Goldstein L B. Introduction for focused updates in cerebrovascular disease[J]. Stroke,2020,51(3): 708-710.
[4]Li Y,Zeng P M,Wu J,et al. Advances and applications of brain organoids[J]. Neurosci Bull,2023,39(11): 1703-1716.
[5]Sato T,Vries R G,Snippert H J,et al. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche[J]. Nature,2009,459(7244): 262-265.
[6]Song L Q,Yan Y W,Marzano M,et al. Studying heterotypic cell-cell interactions in the human brain using pluripotent stem cell models for neurodegeneration[J]. Cells,2019,8(4): 299.
[7]Orlova V V,Nahon D M,Cochrane A,et al. Vascular defects associated with hereditary hemorrhagic telangiectasia revealed in patient-derived isogenic iPSCs in 3D vessels on chip[J]. Stem Cell Reports,2022,17(7): 1536-1545.
[8]Saglam-Metiner P,Yanasik S,Odabasi Y C,et al. ICU patient-on-a-chip emulating orchestration of mast cells and cerebral organoids in neuroinflammation[J]. Commun Biol,2024,7(1): 1627.
[9]Hofer M,Lutolf M P. Engineering organoids[J]. Nat Rev Mater,2021,6(5): 402-420.
[10]Mansour A A,Gonçalves J T,Bloyd C W,et al. An in vivo model of functional and vascularized human brain organoids[J]. Nat Biotechnol,2018,36(5): 432-441.
[11]Wilson M N,Thunemann M,Liu X,et al. Multimodal monitoring of human cortical organoids implanted in mice reveal functional connection with visual cortex[J]. Nat Commun,2022,13(1): 7945.
[12]Pham M T,Pollock K M,Rose M D,et al. Generation of human vascularized brain organoids[J]. Neuroreport,2018,29(7): 588-593.
[13]Kistemaker L,van Bodegraven EJ,de Vries HE,Hol EM. Vascularized human brain organoids: current possibilities and prospects[J]. Trends Biotechnol,2025,S0167-7799(24)00357-3.doi: 10.1016/j.tibtech.2024.11.021. Epub ahead of print.
[14]Cakir B,Xiang Y F,Tanaka Y,et al. Engineering of human brain organoids with a functional vascular-like system[J]. Nat Methods,2019,16(11): 1169-1175.
[15]Wörsdörfer P,Dalda N,Kern A,et al. Generation of complex human organoid models including vascular networks by incorporation of mesodermal progenitor cells[J]. Sci Rep,2019,9(1): 15663.
[16]Shi Y C,Sun L,Wang M D,et al. Vascularized human cortical organoids (vOrganoids) model cortical development in vivo[J]. PLoS Biol,2020,18(5): e3000705.
[17]Song L Q,Yuan X G,Jones Z,et al. Assembly of human stem cell-derived cortical spheroids and vascular spheroids to model 3-D brain-like tissues[J]. Sci Rep,2019,9(1): 5977.
[18]Tan S Y,Feng X H,Cheng L K W,et al. Vascularized human brain organoid on-chip[J]. Lab Chip,2023,23(12): 2693-2709.
[19]Salmon I,Grebenyuk S,Abdel Fattah A R,et al. Engineering neurovascular organoids with 3D printed microfluidic chips[J]. Lab Chip,2022,22(8): 1615-1629.
[20]Xu C,Alameri A,Leong W,et al. Multiscale engineering of brain organoids for disease modeling[J]. Adv Drug Deliv Rev,2024,210: 115344.
[21]Dao L,You Z,Lu L,et al. Modeling blood-brain barrier formation and cerebral cavernous malformations in human PSC-derived organoids[J]. Cell Stem Cell,2024,31(6): 818-833.e11.
[22]Wang S N,Wang Z,Xu T Y,et al. Cerebral organoids repair ischemic stroke brain injury[J]. Transl Stroke Res,2020,11(5): 983-1000.
[23]Cao S Y,Yang D,Huang Z Q,et al. Cerebral organoids transplantation repairs infarcted cortex and restores impaired function after stroke[J]. NPJ Regen Med,2023,8(1): 27.
[24]Zheng F Y,Xiao Y M H,Liu H,et al. Patient-specific organoid and organ-on-a-chip: 3D cell-culture meets 3D printing and numerical simulation[J]. Adv Biol (Weinh),2021,5(6): e2000024.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言
















#脑血管病# #血管化脑类器官#
0