好文推荐 | 高原吉兰-巴雷综合征临床和电生理特点分析
2025-01-17 中风与神经疾病杂志 中风与神经疾病杂志 发表于陕西省
本研究旨在探讨高原高寒缺氧特殊地理环境对GBS患者的影响,分析其临床和神经电生理特点。
摘要
目的 探讨高原吉兰-巴雷综合征(GBS)患者的临床特征和神经电生理特点。方法 回顾性纳入自2023年7月1日—2024年9月30日就诊于青海省人民医院16例GBS患者并进行描述分析。结果 16例GBS患者中,出现四肢瘫痪13例(81%),下肢瘫痪3例(19%),感觉减退7例(46%),感觉异常9例(56%),感觉过敏3例(19%),腱反射减弱或消失16例(100%),共济失调7例(37%),动眼神经受累2例(11%),球部受累2例(11%),舌下神经受累1例(6%);上肢和下肢皮肤交感反应(SSR)异常分别为9例(56%)和10例(63%)。GBS临床分型,15例患者(94%)为经典型,1例为(6%)为咽-颈-臂型。GBS电生理分型,9例(56%)患者为急性炎症性脱髓鞘性多发性神经根神经病(AIDP),7例(44%)为急性运动轴索性神经病/急性运动感觉轴索性神经病(AMAN/AMSAN)。结论 高原高寒缺氧环境可引起人体的免疫系统和生理机能变化,导致GBS患者病情危重,临床表现为四肢瘫痪,脑神经受累,呼吸肌受累,明显的低氧血症,其电生理损害可表现为脱髓鞘和轴索受损,容易累及小纤维感觉神经、自主神经,考虑可能与高原缺氧环境下免疫介导的炎症反应、神经细胞线粒体能量代谢障碍,氧化应激和免疫系统功能障碍有关。
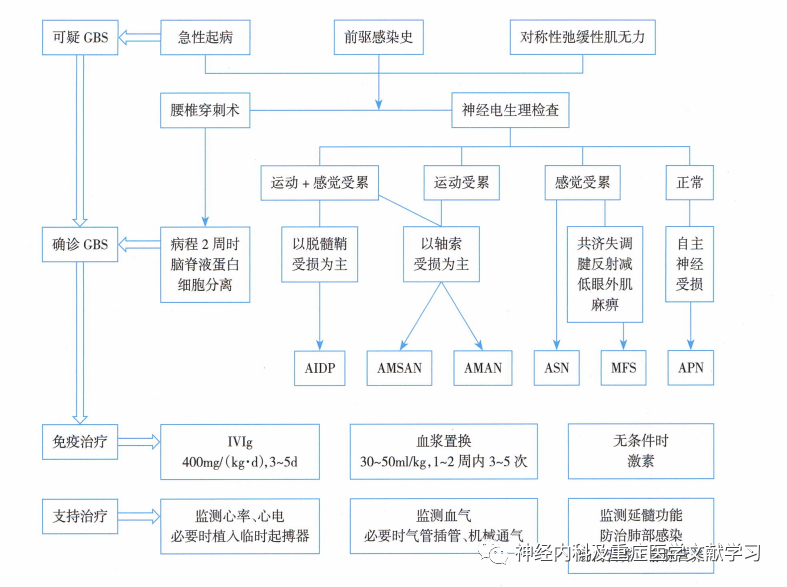
高原高寒缺氧的特殊地理环境严重影响着人体的机能健康,对缺氧最为敏感的神经系统,其结构与功能也相应变化,对其致病因素及病理机制的深入研究意义重大。吉兰⁃巴雷综合征(Guillain-Barré syndrome,GBS)系一类免疫介导的急性炎性周围神经病,临床特征为急性起病,临床症状多在2周左右达到高峰,表现为多发神经根及周围神经损害,也可累及颅神经,发病率为0.4/10万~2.5/10万。发病前常伴有上呼吸道或胃肠道感染,常见空肠弯曲杆菌、人类免疫缺陷病毒、Zika病毒、EB病毒、肺炎支原体或其他病原菌感染,以及疫苗接种,手术,移植等。本研究旨在探讨高原高寒缺氧特殊地理环境对GBS患者的影响,分析其临床和神经电生理特点。
1 资料与方法
1.1 研究对象
根据GBS的Brighton criteria 标准和中华医学会神经病学分会《中国吉兰-巴雷综合征诊治指南2019》标准纳入自2023年7月1日—2024年9月30日就诊于青海省人民医院神经内科的GBS患者16例(海拔2 260~4 080 m的高原世居人群)。排除标准为糖尿病、尿毒症、中毒、吸毒、酗酒、免疫系统紊乱、副肿瘤综合征以及其他潜在可能的原因导致周围神经病变。
1.2 临床资料
临床数据包括人口统计学、神经系统症状和体征,具体见表1。Brighton criteria标准中,1级为确诊GBS,包括神经传导检查(nerve conduction studies,NCS)、脑脊液(cerebrospinal fluid,CSF)中出现蛋白细胞分离和临床表现均支持GBS诊断。2级为拟诊GBS,CSF或NCS任意一项检查结果和临床表现支持GBS诊断。3级为可能GBS,仅有临床特征支持GBS诊断,无需NCS或CSF结果支持。本研究中,高原病例中9例(56%)患者符合Brighton criteria标准1级,7例(44%)患者符合Brighton criteria标准2级。Hughes量表用于GBS症状达峰时残疾程度的测量。评分标准如下:0分为健康状态;1分为轻微症状,能够跑步;2分为在没有协助情况下能够步行10 m或更远但无法跑步;3分为在帮助下能够在开放空间行走10 m;4分为卧床不起或坐在椅子上;5分为至少在1 d中的部分时间需要辅助通气;6分为死亡。
1.3 电生理检查
电生理检查采用标准肌电图(electromyography,EMG)仪器(仪器Dantec丹麦)。所有患者均被要求平躺在检查床上,四肢皮肤温度保持在至少32 ℃。由具有7~10年以上电生理诊断经验的神经电生理医生进行检查。神经传导检查遵循标准程序,分别在拇短展肌、小指展肌、趾短伸肌和踇展肌这些靶肌肉上记录正中神经、尺神经、腓总神经和胫神经的运动神经传导。运动神经传导采用复合肌肉动作电位波幅(compound muscle action potential,CMAP)、远端运动潜伏期(distal motor latency,DML)、运动传导速度(motor conduction velocity,MCV)、F波潜伏期4个参数。采用逆向法评估感觉神经传导,测量正中神经、尺神经、腓浅神经和腓肠神经的起始潜伏期、感觉神经动作电位(sensory nerve action potential,SNAP)和感觉传导速度(sensory conduction velocity,SCV)3个参数。皮肤交感反应(sympathetic skin response,SSR)用于评估小纤维的功能。
2 结 果
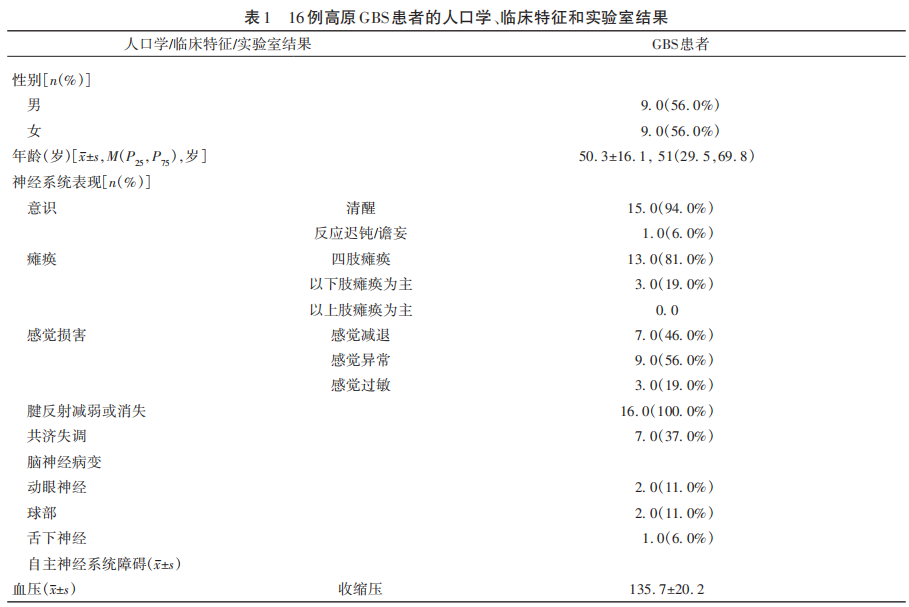
2.1 高原GBS患者的临床特征和实验室结果
16例高原GBS患者中,出现四肢瘫痪13例(81%),下肢瘫痪为主3例(19%),感觉减退7例(46%),感觉异常9例(56%),感觉过敏3例(19%),腱反射减弱或消失16例(100%),共济失调7例(37%),动眼神经受累2例(11%),球部受累2例(11%),舌下神经受累1例(6%);上肢和下肢SSR异常分别为9例(56%)和10例(63%)。高原GBS临床分型,15例患者(94%)为经典型,1例为(6%)为咽-颈-臂型。高原GBS电生理分型,9例(56%)患者为急性炎症性脱髓鞘性多发性神经根神经病(acute inflammatory demyelinating polyradiculoneuropathy,AIDP),7例(44%)为急性运动轴索性神经病/急性运动感觉轴索性神经病(acute motor axonal neuropathy,AMAN;acute motor-sensory axonal neuropathy,AMSAN)。高原GBS患者的临床特征和实验室结果见表1。

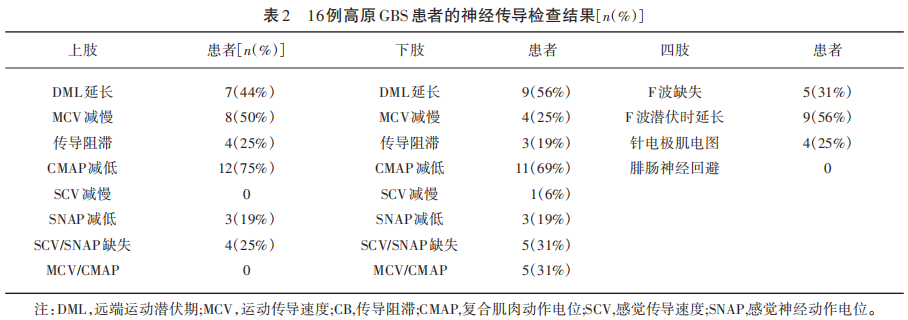
2.2 神经传导检查
16例高原GBS神经电生理特点表现为四肢运动神经DML和F波潜伏时明显延长,四肢CMAP减低。有4例(25%)GBS患者针电极肌电图异常。高原GBS患者的详细神经传导检查结果见表2。
3 讨 论
高原气候寒冷、缺氧、低气压、干燥的特殊环境,对人体机能影响较大,机制复杂,特别是对缺氧最敏感的神经系统影响最为显著,缺氧时神经细胞线粒体结构出现明显损害,表现为线粒体肿胀、膜结构损伤、嵴溶解断裂等,导致神经细胞的能量代谢障碍,影响其正常的生理功能,神经细胞受到的损伤。高原GBS神经损害程度较平原GBS更为显著。本研究发现,高原GBS患者中,9例(56%)患者为AIDP,7例(44%)为AMAN/AMSAN,表现为四肢瘫痪,脑神经受累明显,神经电生理表现为四肢运动神经DML和F波潜伏时明显延长,四肢CMAP减低,4例(25%)GBS患者针电极肌电图异常,出现上述表现可能与免疫介导的炎症发应和高原氧化应激反应有关,高原高寒缺氧的特殊地理环境可导致活性氧(ROS)的生成增多和抗氧化防御系统的减弱,进一步导致脂质过氧化、蛋白质氧化修饰、DNA损伤等病理改变从而出现周围神经损害。在高原自由基介导的神经源性损伤及炎症反应,参与高原缺氧性神经变性疾病的发生。
高原低氧反应中的炎症反应作用明显,在高原血浆1L-1、1L-6和TNF-α均显著升高。研究发现,低氧可显著增强溶血磷脂酰胆碱诱导的炎症反应,从而导致小纤维神经和自主神经损害,可出现轴突的突触前突肿胀,突触池减少、碎裂、变形、分解等,树突则出现空泡形管分解、消失、曲张样增厚、小分支和微分支减少等改变。本高原组GBS有6例为急性运动感觉轴索性神经病,上肢和下肢皮肤交感反应(sympathetic skin response,SSR)异常分别为9例(56%)和10例(63%),说明高原GBS容易累及小纤维感觉神经、自主神经。
高原缺氧环境下人体的免疫系统和生理机能变化,增加了感染的易感性。同时,寒冷的气候影响人体的血液循环,导致外周血管收缩,降低神经的血供,影响神经的营养和免疫功能。免疫系统在GBS综合征的发病机制中起着关键作用,因为它是一种自身免疫性疾病。长期处于低氧状态可能导致免疫系统的失衡,影响免疫细胞的功能和调节,进而干扰机体对自身神经髓鞘的免疫识别,增加GBS发病的潜在机制及风险,一旦发病,往往病情较重,本高原GBS有6例AMAN/AMSAN患者达38%,高原GBS患者脑神经受累,呼吸肌无力明显,肺部感染严重,其中1例血氧饱和度低,波动在64%~70%之间,出现严重呼吸衰竭。GBS病死率3%左右,主要死于呼吸衰竭、感染、低血压、严重心律失常等并发症。
综上所述,高原GBS临床表现为四肢瘫痪,可累及颅神经,呼吸肌受累明显,可出现明显的低氧血症,其电生理损害可表现为脱髓鞘和轴索受损,且容易累及小纤维感觉神经、自主神经。
参考文献
[1]吴世政. 高原脑科学研究进展[J]. 高原医学杂志,2019,29(1):47-53.
[2]中华医学会神经病学分会,中华医学会神经病学分会周围神经病协作组,中华医学会神经病学分会肌电图与临床神经电生理学组,等. 中国吉兰-巴雷综合征诊治指南2019[J]. 中华神经科杂志,2019,52(11):877-882.
[3]Shahrizaila N,Lehmann HC,Kuwabara S. Guillain-Barré syndrome[J]. Lancet,397(10280):1214-1228.
[4]Finsterer J. Triggers of Guillain-Barré syndrome:Campylobacter jejuni predominates[J]. Int J Mol Sci,2022,23(22):14222.
[5]Shepherd SJ,Black H,Thomson EC,et al. HIV positive patient with GBS-like syndrome[J]. JMM Case Rep,2017,4(8):e005107.
[6]Barbi L,Coelho AVC,Alencar LCA,et al. Prevalence of Guillain-Barré syndrome among zika virus infected cases:a systematic review and meta-analysis[J]. Braz J Infect Dis,2018,22(2):137-141.
[7]Masajtis-Zagajewska A,Muras K,Mochecka-Thoelke A,et al. Guillain-Barré syndrome in the course of EBV infection after kidney transplantation:a case report[J]. Ann Transplant,2012,17(3):133-137.
[8]Suzuki M,Watanabe G,Watari T. Guillain-Barré syndrome caused by Mycoplasma pneumoniae infection in an elderly patient initially misdiagnosed as frailty[J]. Cureus,2022,14(2):e22386.
[9]Andalib S,Biller J,Di Napoli M,et al. Peripheral nervous system manifestations associated with COVID-19[J]. Curr Neurol Neurosci Rep,2021,21(3):9.
[10]Wakerley BR,Uncini A,Yuki N,et al. Guillain-Barré and Miller Fisher syndromes:new diagnostic classification[J]. Nat Rev Neurol,2014,10(9):537-544.
[11]Sejvar JJ,Kohl KS,Gidudu J,et al. Guillain-Barré syndrome and Fisher syndrome:case definitions and guidelines for collection,analysis,and presentation of immunization safety data[J]. Vaccine,2011,29(3):599-612.
[12]Hughes RA,Newsom-Davis JM,Perkin GD,et al. Controlled trial prednisolone in acute polyneuropathy[J]. Lancet,1978,2(8093):750-753.
[13]Chen S,Andary M,Buschbacher R,et al. Electrodiagnostic reference values for upper and lower limb nerve conduction studies in adult populations[J]. Muscle Nerve,2016,54(3):371-377.
[14]Roshanzamir S,Mohamadi Jahromi LS. Study of sympathetic skin response in patients with COVID-19 infection[J]. Acta Neurol Belg,2023,123(3):949-955.
[15]格日力. 高原医学[M]. 2版. 北京:北京大学医学出版社,2020.
[16]吴天一. 吴天一高原医学[M]. 武汉:湖北科学技术出版社,2020.

本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言















#吉兰-巴雷综合征# #电生理特点#
11