PNAS:清华大学陈默团队研究发现靶向TUT1耗竭三小核核糖核蛋白池以抑制剪接过程和胰腺癌细胞的存活
2025-04-11 iNature iNature 发表于重庆
该研究发现,TUT1对PDAC细胞的存活至关重要,但对正常胰腺细胞则非必需。
胰腺导管腺癌(PDAC)具有高度侵袭性且缺乏有效的治疗选择。由于转录速率增加,癌细胞通常比正常细胞更依赖于剪接因子。末端尿苷酰转移酶1(TUT1)是U6小核RNA(snRNA)的特异性末端尿苷酰转移酶,在剪接体中发挥催化作用。
2025年4月3日,清华大学陈默独立通讯在Cancer Research在线发表题为“Targeting TUT1 Depletes Tri-snRNP Pools to Suppress Splicing and Inhibit Pancreatic Cancer Cell Survival”的研究论文。该研究发现,TUT1对PDAC细胞的存活至关重要,但对正常胰腺细胞则非必需。
在PDAC细胞中,TUT1的尿苷酰化活性通过促进LSM蛋白与U6 snRNA的结合以及随后的三小核核糖核蛋白颗粒(tri-snRNP)组装,从而推动U4/U6.U5 tri-snRNP的组装。PDAC细胞需要更多的U4/U6.U5 tri-snRNP来高效剪接具有弱剪接位点的前体mRNA,以支持其高转录输出。在PDAC细胞中耗尽TUT1会导致一组含有弱剪接位点且高度表达的RNA中的外显子剪接效率降低,进而导致mRNA加工回路的崩溃,并由此引发PDAC细胞所需的剪接失调。总体而言,本研究揭示了TUT1通过调节U4/U6.U5 tri-snRNP水平来调控剪接的有趣功能,并展示了胰腺癌细胞剪接成瘾的独特机制。

胰腺癌导管腺癌(PDAC)是胰腺最常见且侵袭性最强的恶性肿瘤,其整体5年生存率低于10%,情况堪忧。其高致死率主要是由于诊断较晚,导致手术切除困难。PDAC对传统化疗药物具有抗药性,同时缺乏有效的靶向和免疫治疗手段。
在肿瘤发生过程中,致癌信号会驱动转录活性增强,这就要求癌细胞依赖于额外的基因调节因子,如RNA结合蛋白(RBPs),以维持增强的转录输出。已证实,RBPs(特别是剪接因子)的改变对于驱动肿瘤发生和维持癌细胞存活至关重要。核心剪接因子(如SF3B1和U2AF1)的突变已被确定为血液恶性肿瘤的驱动因素。同时,癌细胞中序列特异性剪接调节因子(如SR蛋白和hnRNP蛋白)表达水平的非突变性改变,也对癌细胞的存活至关重要。除了序列特异性剪接调节因子外,与正常细胞相比,癌细胞还更加依赖于通用剪接因子,需要大量的剪接因子来满足转录的过度激活。然而,目前尚不清楚癌细胞和正常细胞对三聚小核核糖核蛋白(tri-snRNP)水平的需求是否存在差异。
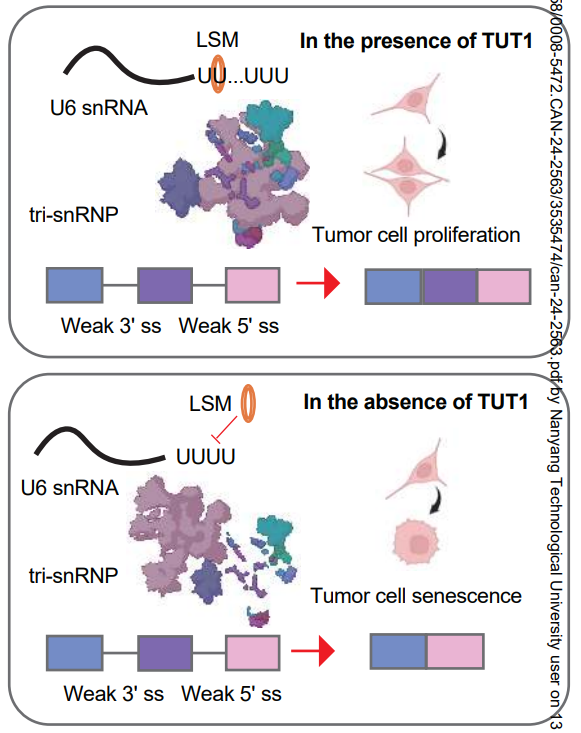
模式机理图(图片源自Cancer Research)
末端尿苷酸转移酶1(TUT1)是末端尿苷酸转移酶(tutase)的一种,最初被描述为能够在U6核小RNA(snRNA)的3'端添加尿苷酸的酶。U6 snRNA 3'端的成熟涉及一个独特的过程,包括末端尿嘧啶尾部的动态变化,这一过程的初始延长由TUT1催化。经过适当处理的U6 snRNA 3'端可作为LSM2-8蛋白复合物的结合位点,从而进一步促进二聚小核核糖核蛋白(di-snRNP)的形成。尽管TUT1通过调节U6 snRNA来调节剪接,但目前尚不清楚TUT1是否影响tri-snRNP的组装,以及TUT1的主要作用途径是什么。
本研究表明,TUT1在人类胰腺癌中高表达,对小鼠模型中PDAC的启动至关重要,并且通过促进细胞增殖对PDAC细胞存活具有重要意义。作者发现,TUT1通过其尿苷酸转移酶活性来调节剪接,确保LSM蛋白与U6 snRNA的结合,从而促进tri-snRNP的组装。有趣的是,TUT1的耗竭会影响一部分前mRNA的剪接,包括具有弱剪接位点的RNA加工因子,这表明存在一个正反馈回路以确保强大的剪接调控。PDAC细胞而非正常胰腺细胞对TUT1的选择性依赖,关键在于癌细胞中tri-snRNP形式的U6 snRNA比例高于正常细胞。总体而言,本研究确立了TUT1在剪接调控中的功能作用,并阐明了PDAC细胞对TUT1需求的潜在机制。
原文链接:
https://doi.org/10.1158/0008-5472.CAN-24-2563

本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言


















#胰腺导管腺癌# #末端尿苷酰转移酶1#
9