Nature:窦科峰团队发表国际首个异种肝脏移植研究工作「eG学术观察」
2025-03-27 eGastroenterology eGastroenterology 发表于陕西省
供体短缺制约肝移植,窦科峰院士团队将六基因编辑猪肝脏异位辅助移植到脑死亡患者体内,证实其可行性与安全性,为肝移植提供新思路。
导读
肝移植作为终末期肝病的根治性疗法,面临供体器官严重短缺的全球性难题。基于猪源器官的生理结构近似性和基因编辑技术的突破,异种移植已展现革命性潜力。既往研究虽在心脏和肾脏异种移植中取得阶段性成果,但肝脏因其独特的代谢功能与免疫特性,始终未能实现人体内移植。仅有一国外科研团队在2024年首次尝试体外猪肝辅助治疗并发肝衰竭的脑死亡患者,为技术突破奠定了基础。
3月26日,空军军医大学西京医院肝胆外科窦科峰院士团队在Nature发表题为“Gene-modified pig-to-human liver xenotransplantation”的研究论文,报道了六基因编辑猪肝脏经异位辅助移植到脑死亡患者体内后的效果。西京医院肝胆外科窦科峰院士、王琳教授,麻醉科董海龙教授为该论文的共同通讯作者,肝胆外科陶开山教授、杨诏旭副教授、张玄医师、张洪涛医师为论文的共同第一作者。

研究团队选用了一头六基因编辑的巴马小型猪作为供体。通过流式细胞术和免疫组化等手段确认了相关基因编辑的成功,包括超急性排斥相关基因GGTA1、B4GALNT2和CMAH敲除,人类补体调节蛋白CD46和CD55,以及人类血栓调节蛋白TBM过表达。同时,猪内源性逆转录病毒(PERV)和猪巨细胞病毒(PCMV)在受体中未被检测到,微嵌合现象也未出现。
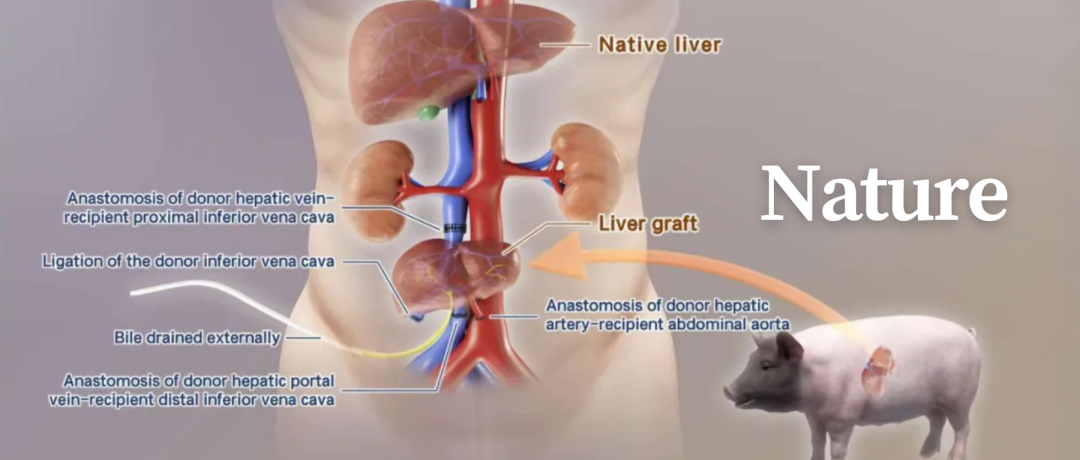
研究团队采用了异位辅助性肝移植的方式,在保留供体自身肝脏的同时,将异种肝脏安置于下腹部。供肝在移植后即刻产生金黄色胆汁,术后第10天胆汁量增加至66.5毫升。猪源性白蛋白分泌量在术后持续增加。丙氨酸转氨酶(ALT)水平保持在正常范围内,天门冬氨酸转氨酶(AST)水平在术后第1天短暂升高后迅速下降。此外,碱性磷酸酶(ALP)水平保持正常,胆红素和γ-谷氨酰转肽酶(GGT)在研究后期有所升高。以上肝功能指标表明供肝损伤轻微,开始发挥功能。
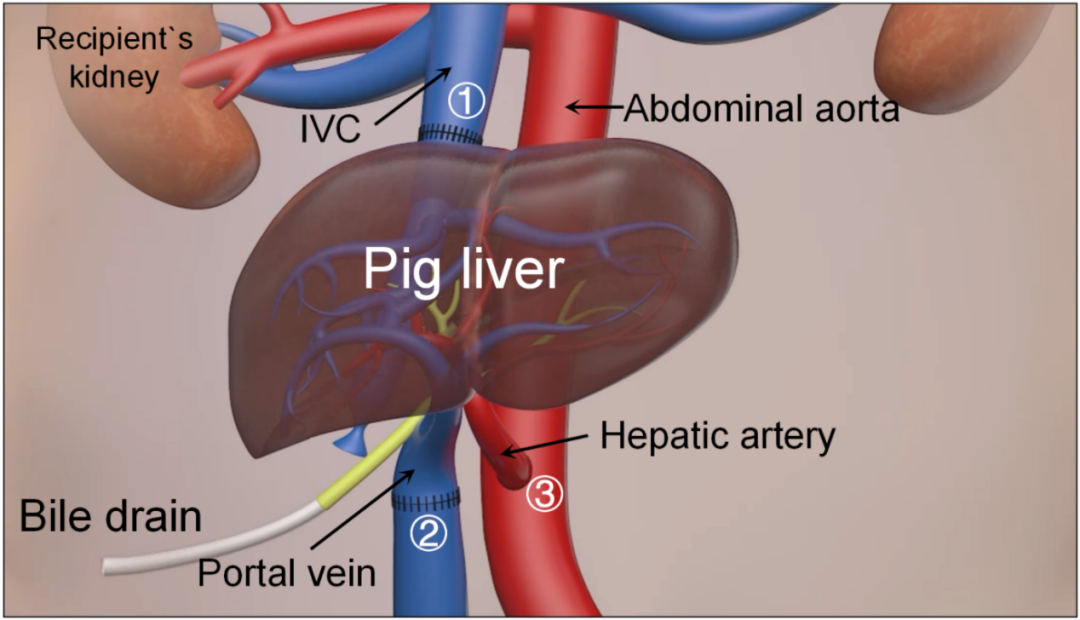
图1:异位辅助肝异种移植手术示意图。①、②和③代表图c中标注的血管吻合口
来源:原文扩展数据图2d
在血流动力学方面,供肝动脉、门静脉和肝静脉的血流速度均保持在可接受水平,门静脉血流量在整个研究期间稳定。受体的凝血酶原时间(PT)维持在正常水平。血小板数量在术后早期有所下降,活化部分凝血活酶时间(APTT)早期升高,但最终都恢复正常水平。表明移植后凝血功能受到一定影响,但整体可控。
研究团队采用的免疫抑制方案包括他克莫司、麦考酚酯、依那西普、利妥昔单抗和甲泼尼龙等,有效抑制了移植后的免疫反应。C反应蛋白(CRP)和降钙素原(PCT)水平在术后初期升高后迅速下降,表明炎症反应得到了良好控制。组织学分析显示,移植后的猪肝在术后出现了轻微的血窦充血和炎症细胞浸润,但未见明显的补体和免疫球蛋白沉积。在术后第10天可观察到肝细胞和血窦内皮细胞增殖,未见星状细胞激活。以上结果表明异种肝脏未受到严重的免疫损伤,状态良好。
本研究在异种移植领域取得重大突破,首次在人体中证实了基因编辑猪肝脏的临床应用可行性及生物安全性,创新性地建立了异位辅助肝移植技术体系。本研究不仅为急性肝衰竭患者和等待同种肝源患者提供了新型过渡性桥接治疗方案,更通过突破性实践,为未来开展原位异种肝移植奠定了重要的理论基础,并积累了宝贵的临床经验。后续研究将聚焦异种移植关键科学问题,重点突破跨物种免疫排斥机制,优化多基因编辑策略及个体化免疫调控方案,通过系统性基础研究向临床转化医学迈进,为终末期肝病患者开辟全新的生命希望。
引证本文
Tao, KS., Yang, ZX., Zhang, X. et al. Gene-modified pig-to-human liver xenotransplantation. Nature (2025).
https://doi.org/10.1038/s41586-025-08799-1

本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言








#肝异种移植# #基因编辑猪#
9