四川大学华西医院宋涂润教授《自然·通讯》:B型血肾的酶促转化可预防ABO血型不相容移植中由抗体介导的急性损伤
昨天 BioMed科技 BioMed科技 发表于陕西省
器官短缺,ABOi 肾移植受限。研究用 α-galactosidase 将 B 型肾转为 O 型,经实验证实可防排斥,有望改善移植现状,避免现有预处理方案缺陷。
器官短缺是目前限制器官移植发展的重要瓶颈;死亡器官捐献虽然已经成为我国器官的主要来源,但是捐献数量有限,远远不能满足需求。为了解决这些问题,亲属活体移植成为了有效的途径,能够显著增加肾脏供给并提高移植数量。然而,约三分之一的亲属供受者之间存在血型不合,成功进行血型不合(ABO incompatible,ABOi)肾移植的比例仅为1.5%。因此,ABOi肾移植成为缓解器官短缺并满足高致敏患者需求的一个重要途径。
ABOi肾移植由于供体与受体之间存在血型屏障,移植前必须进行一系列预处理,以降低免疫排斥的风险。目前,常见的预处理方法主要针对受体,通常包括以下几种策略:(1)通过血浆置换或免疫吸附去除血型抗体(如IgG和IgM),将抗体水平降低至安全值(<1:32),并持续保持2周以上以帮助受体的免疫系统适应;(2)使用B细胞清除剂(如美罗华)以减少抗体的产生;(3)提前使用免疫抑制药物抑制B细胞增殖。然而,这些方法存在一系列问题。例如,免疫吸附只能清除IgG抗体,并且费用高昂;血浆置换需要大量新鲜冰冻血浆,且可能导致受体凝血因子的丧失,从而增加手术出血的风险。另外,许多患者抗体水平在治疗后虽一时降低,但难以长期维持,且抗体可能反弹,从而引发排斥反应。B细胞清除后,过度的免疫抑制还可能导致术后感染及并发症的风险显著上升。对于一些抗体水平极高的个体(如>1:1024),即便多次进行血浆置换或免疫吸附,抗体水平也难以有效降低。因此,现有预处理方案存在显著局限性,使得许多医生和患者对ABOi肾移植方案的接受度较低,并且临床实施过程中面临着许多困难与挑战。
血型抗原为糖抗原。从其结构来看,A型和B型抗原均是在O型血的H抗原基础上通过不同的糖基修饰形成的。例如,A型抗原通过加入N-乙酰-半乳糖胺(GalNAc),而B型抗原则加入半乳糖(Gal)。如果可以将血型抗原顶端的单糖清除,就可以把A型或者B型抗原转化为H型抗原,从而将血型从A型或者B型转变为O型。
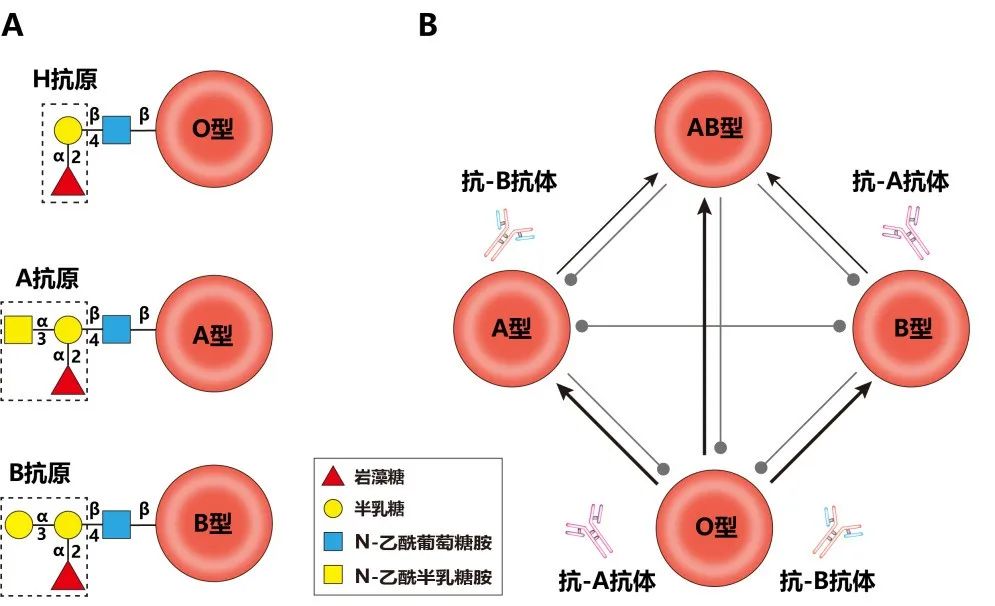
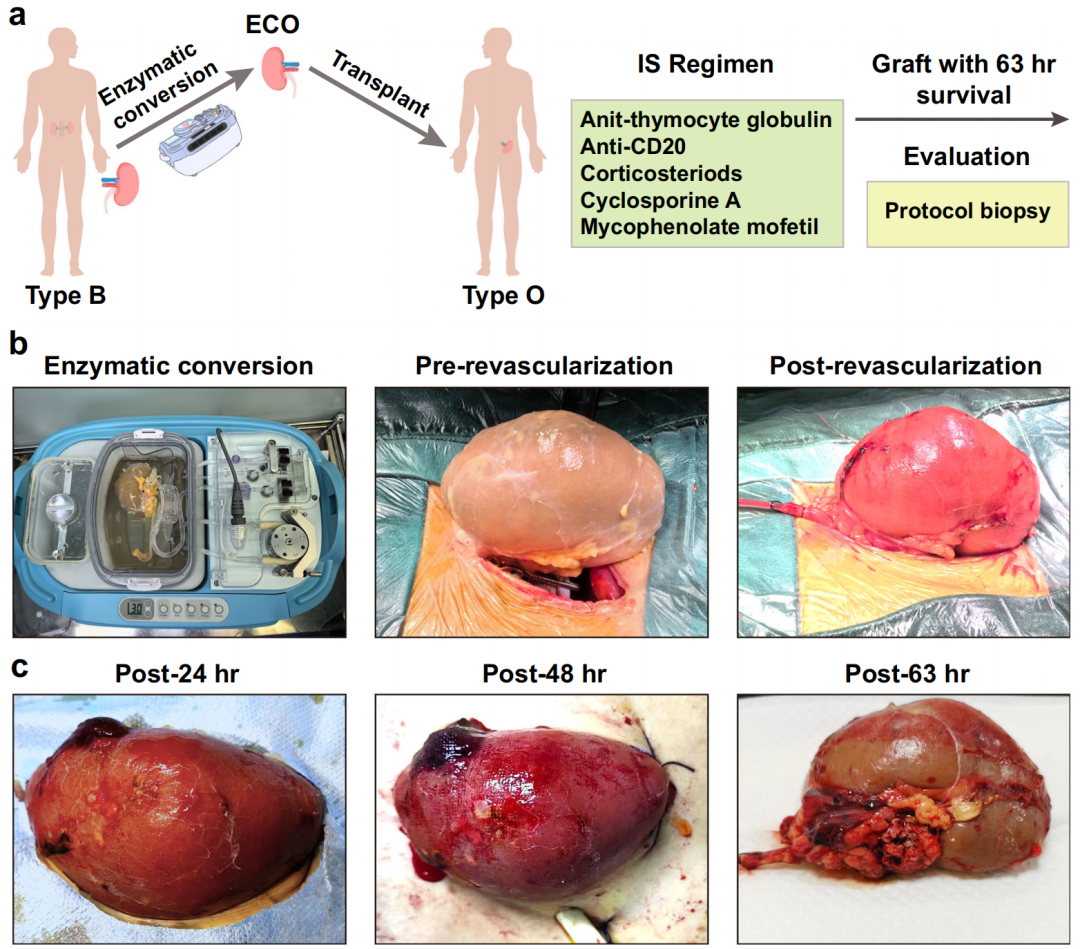
近期,四川大学华西医院宋涂润教授等人使用α-galactosidase (B-zyme)成功实现将B型肾脏转化为O型肾脏,并通过体内外实验证实该方法构建的O型肾脏可以成功的实现血型不合的肾脏移植。相关工作以“Enzymatic conversion of blood group B kidney prevents hyperacute antibody-mediated injuries in ABO-incompatible transplantation”为题发表在Nature Communications。

文章要点
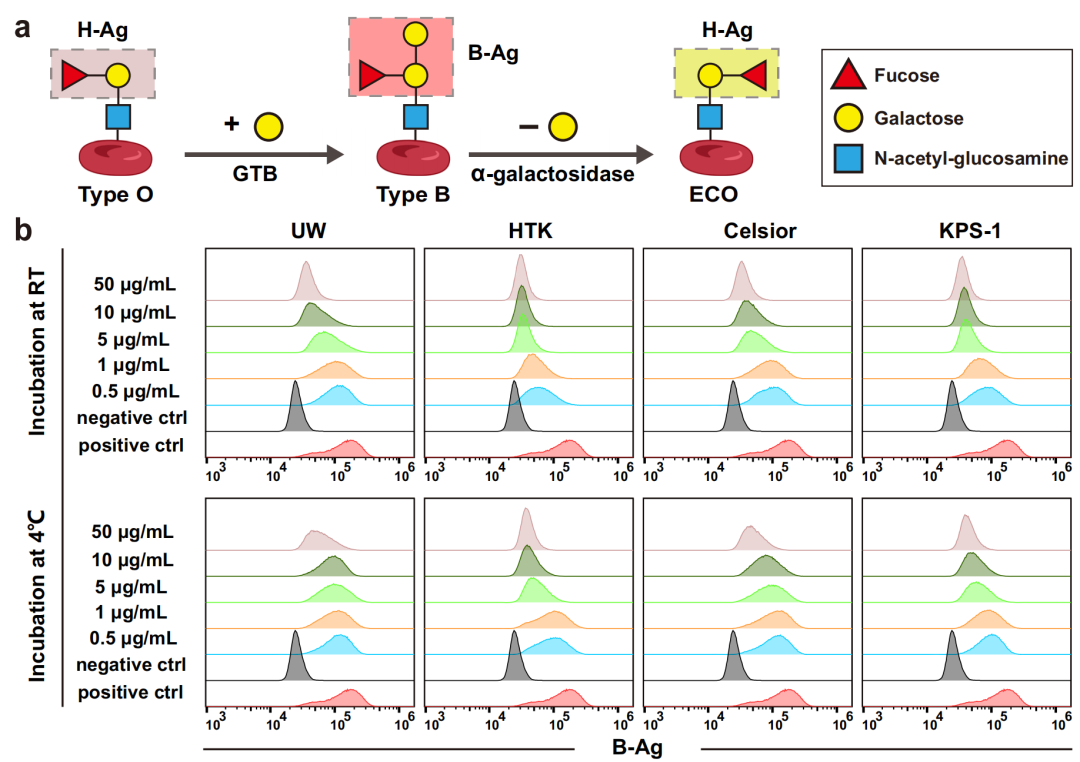
在这项研究中,作者使用α-galactosidase (B-zyme)水解α-1,3-galactose,从器官移植临床运用的角度出发,筛选了其最合适的工作条件,包括工作浓度、工作buffer及处理时间。首先使用红细胞,筛选出B-zyme工作效率最高的器官保存液;我们发现HTK液作为工作Buffer的条件下,50ug/ml的B-zyme可以在60min内将红细胞表面的B型抗原清除,其效率远高于其他灌注液。后续,为了进一步提高B-zyme效率,我们对HTK灌注液做了改进。
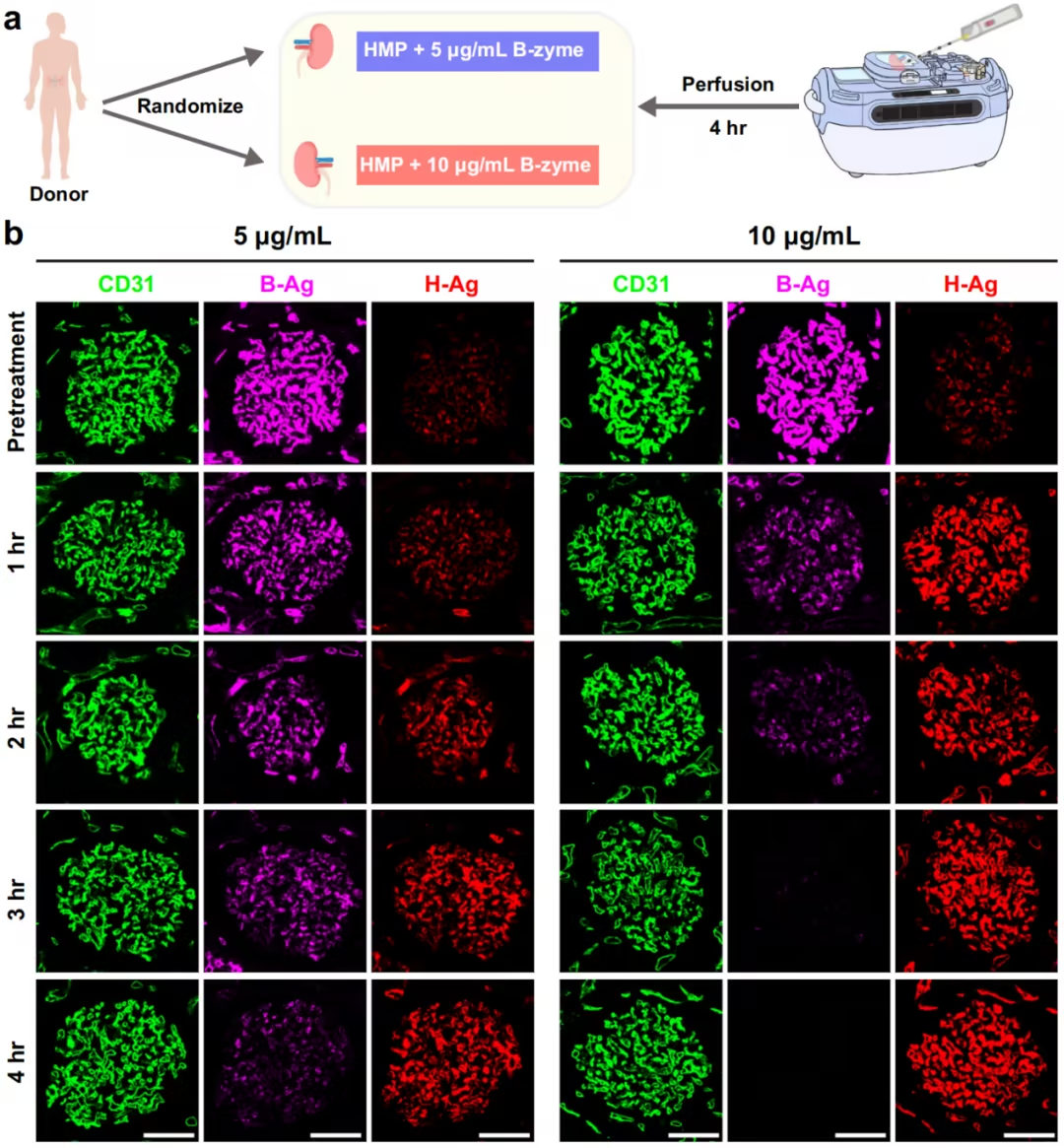
进一步我们将B-zyme及改进的灌注液联合肾脏的低温灌注系统(HMP),发现10ug/ml的B-zyme可以在3h将B型肾脏血管内皮表面的B型抗原完全清除,将B型肾脏转化为O型肾脏。
后续我们采用常温灌注系统构建体外血型不合肾移植的模型发现,经B-zyme处理构建的O型肾脏不会诱发血型抗体沉积,也不会激活补体系统;相应的不会在微血管内形成血栓;证实经B-zyme处理的肾脏可以预防抗体介导的组织损伤。
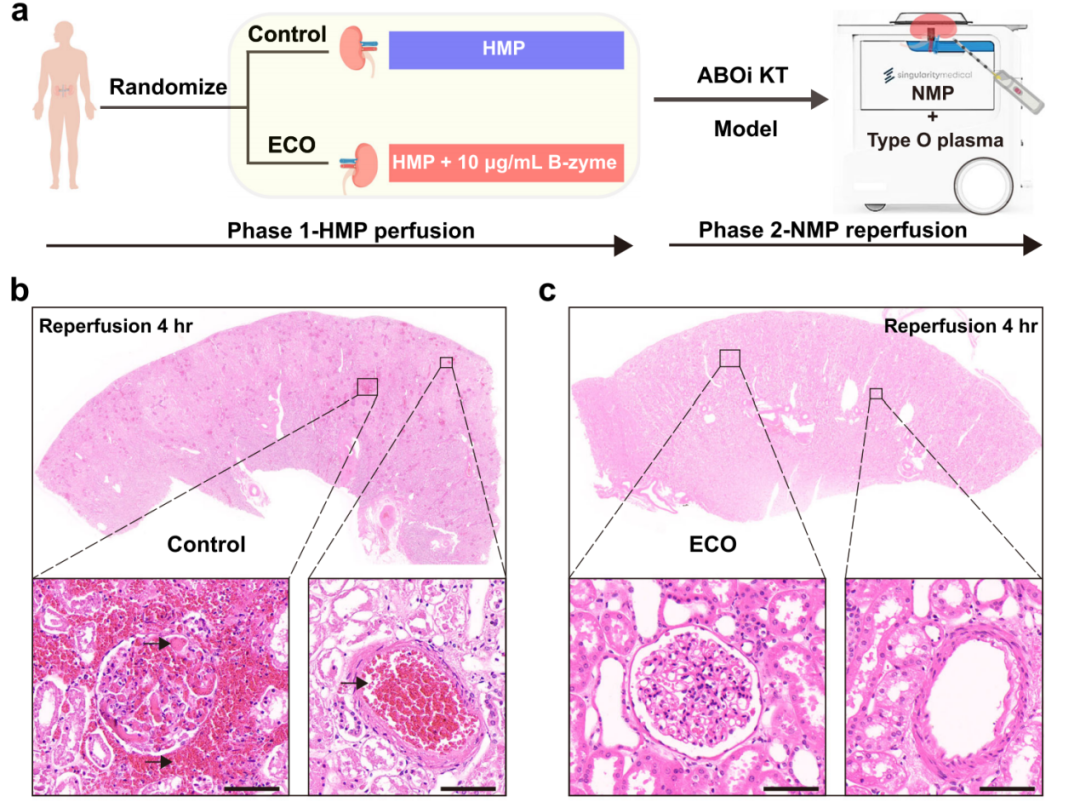
最后也是最重要的一步,我们将经B-zyme处理构建的O型肾脏移植给了一名具有高抗-B抗体的O型脑死亡患者。在常规免疫抑制方案的情况爱,术中未观察到超急性排斥反应,术后1d,2d及63h后的移植肾活检均未发现明显的抗体沉积及补体激活,有没有发现明显的组织损伤;证实经B-zyme处理构建的O型肾脏可以避免发生超急性排斥反应,成功实现血型不合肾脏移植。
结论与展望
目前血型不合肾脏移植需要在术前针对受体进行非常复杂、昂贵且伴随多种并发症的预处理。我们的工作证明可以使用特异性的单糖水解酶实现血型糖抗原的转化,将B型肾脏转化为O型肾脏;更为重要的是,我们首先实现了血型转化器官的体内实验验证,并成功实现了血型不合的肾脏移植。上述工作表明,在血型不合移植中,可以建立一个针对供肾的预处理方案,从而避免了目前预处理方案的诸多缺陷。此外,这些发现支持了器官血型是可以转化的;一旦成功运用于临床,还可能改变目前的死亡器官分配规则,即器官不在受到血型的限制实现ABO血型的自由分配。
原文链接:
https://www.nature.com/articles/s41467-025-56563-w

本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言

















#器官移植# #ABOi肾移植#
6