Nat Genet:张鹏/王晨飞/孙毅/张乐乐/曾安团队合作利用多组学分析揭示NSCLC免疫联合化疗的耐药因素
2025-01-06 测序中国 测序中国 发表于陕西省
该研究为复杂的NSCLC生态系统提供了新的见解,并为未来开发联合疗法提供了思路。
近年来,免疫检查点阻断疗法(ICB)在非小细胞肺癌(NSCLC)治疗中取得了显著成效,并治愈了一些晚期患者。其中,新辅助免疫治疗比单独使用ICB更有效,平均有效率为32%。但许多NSCLC患者对新辅助免疫治疗存在耐药性,其背后分子机制尚不明确。
肿瘤微环境(TME)包括多种促进肿瘤生长和免疫逃逸的免疫细胞和基质细胞。研究表明新辅助ICB治疗能对部分TME进行重编程并增加CD8阳性T细胞的浸润性,但TME的抑制作用依然存在,限制了该疗法的长期疗效。
近期,同济大学附属上海市肺科医院张鹏、张乐乐团队,同济大学生命科学与技术学院王晨飞团队,同济大学医学院孙毅团队和中科院生化细胞所曾安团队合作在Nature Genetics发表了题为“Multi-omic profiling highlights factors associated with resistance to immuno-chemotherapy in non-small cell lung cancer”的文章。研究团队通过整合单细胞转录组测序数据(scRNA-seq)、批量转录组学数据(bulk RNA-seq)和空间转录组学数据来分析新辅助ICB治疗前后肿瘤细胞的组成和空间结构及TME,确定了与该疗法不良反应相关的癌细胞状态、基质细胞和免疫细胞类型及其空间组成等。总之,该研究为复杂的NSCLC生态系统提供了新的见解,并为未来开发联合疗法提供了思路。

文章发表在Nature Genetics
为揭示新辅助ICB治疗前后NSCLC的变化,研究团队使用scRNA-seq和bulk RNA-seq分析了抗PD-1新辅助免疫治疗前后19例NSCLC患者的26个肿瘤样本,6例患者对治疗有应答,13例患者无应答。经质量控制,共获得232,080个高质量细胞,可划分为上皮细胞、T细胞、B细胞等多种不同类型。
分析结果显示,治疗应答者肿瘤内恶性细胞基本消除;与治疗前相比,无应答者的单核/巨噬细胞和树突状细胞比例上升。此外,相较应答者,无应答者中COL11A1阳性癌症相关成纤维细胞(COL11A1+ CAFs)比例显著更高,表明这些细胞在影响新辅助免疫治疗反应性方面存在潜在作用。
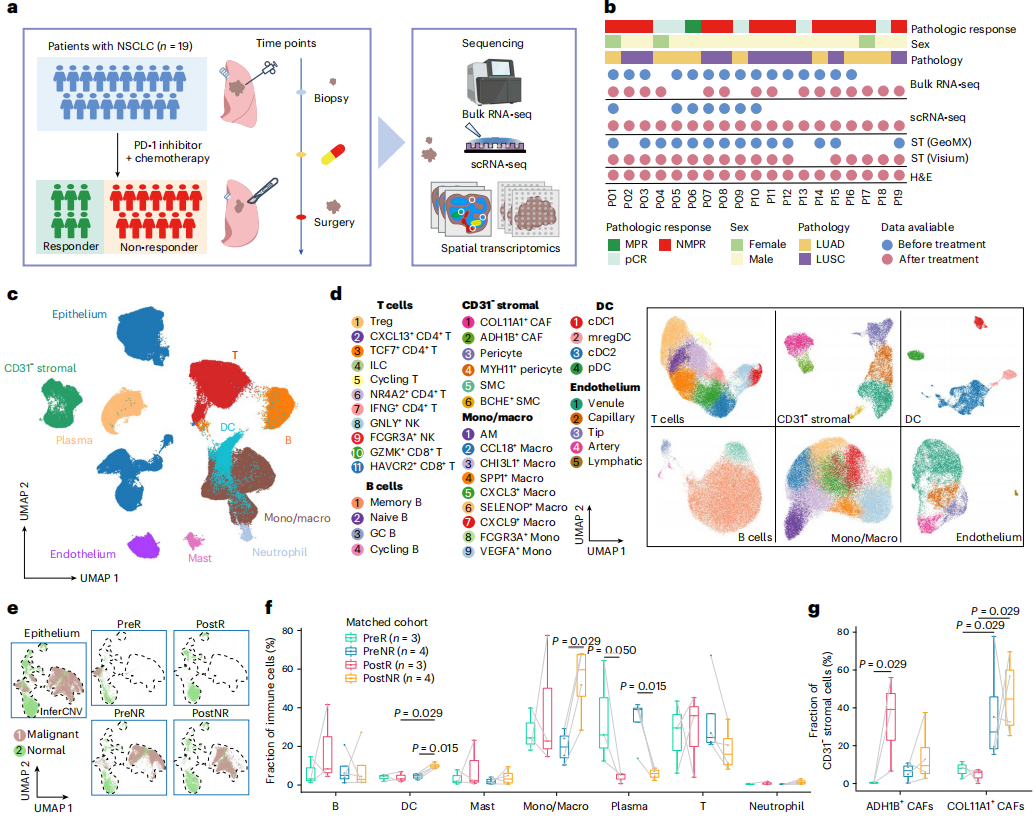
图1. 基于scRNA-seq的NSCLC细胞和分子特征分析
研究团队对14个治疗前和17个治疗后样本进行空间转录组学分析,以了解细胞在TME中的空间分布和相互作用;并将肿瘤分为肿瘤核心、浸润性边缘、肿瘤分离和肿瘤间质4个区域。细胞类型反卷积分析显示,肿瘤核心区主要由恶性细胞组成,而浸润边缘和肿瘤分离区的肿瘤区域则同时包含恶性和非恶性细胞,肿瘤间质区几乎没有恶性细胞。
通过无监督聚类,研究团队鉴定了15个肿瘤生态位,每个生态位都有其高度富集的细胞类型。高富集COL11A1+ CAF的生态位在空间上包裹着高富集肿瘤细胞的生态位;高富集B细胞和T细胞的生态位在空间上与H&E染色中的淋巴聚集区域相对应。上述结果为肿瘤边界的细胞组成以及免疫细胞的空间结构提供了新见解。

图2. 新辅助免疫治疗后NSCLC的空间细胞组织结构
由于COL11A1+ CAFs在应答者和无应答者中表现出不同的富集模式,研究团队探索了该亚群的潜在功能。基因集富集分析显示,COL11A1+ CAFs中与缺氧、TGF-b信号、上皮-间质转化和血管生成相关的基因特征富集,并表现出促肿瘤表型。
接下来,研究团队比较了应答者和无应答者在肿瘤边界的细胞比例。与应答者相比,无应答者的CD8+ T细胞比例较低,COL11A1+ CAFs比例较高且在肿瘤边界聚集,但肿瘤基质区域这些细胞显著较少。此外,在肿瘤核心区和浸润边缘,肿瘤细胞还被COL11A1+ CAFs包裹。
为探究COL11A1+ CAFs能否阻碍免疫细胞浸润,研究团队分析了COL11A1+ CAFs与T细胞的关联。结果显示,在含有恶性细胞的样本和未接受治疗的队列中,COL11A1+ CAFs丰度均与T细胞丰度呈显著负相关,这表明COL11A1+ CAFs可能是预测患者预后和对ICB治疗反应性的有效生物标志物。进一步研究发现,SPP1+巨噬细胞与COL11A1+CAF丰度呈显著正相关,其相关肿瘤边界结构可能促进NSCLC免疫抑制微环境的形成。

图3. COL11A1+ CAFs的空间定位与促肿瘤功能
已知TME中的三级淋巴结构(TLSs)遵循顺序成熟过程,为此,研究团队全面表征了TLSs的成熟过程,发现所有TLSs可分为4类:Lymphoid Aggregates、Activated TLS、Declining TLS和Late TLS,分别代表不同的成熟阶段。
不同成熟阶段的免疫细胞组成不同,其中生发中心B细胞、效应记忆CD4 T细胞和滤泡辅助T细胞对TLSs的激活和功能至关重要,记忆B细胞则与TLSs的长期影响相关。此外,TLSs的成熟状态与新辅助免疫治疗应答相关:无应答者在免疫治疗后检测到更多TLSs,表明TLSs具有潜在抗肿瘤作用;病理完全缓解(pCR)患者中TLSs较少且均处于晚期阶段。
最后,研究团队分析了TLSs成熟状态作为患者生存和对新辅助免疫治疗反应的预测因子的潜力。主要病理缓解(MPR)患者中多数TLSs被鉴定为激活的TLSs,其与更好的总生存率、更低的肿瘤残留相关;而缺氧TME似乎抑制TLSs发育并与预后不良相关。上述结果表明,激活的TLSs有利于患者的生存,并可能作为未来免疫治疗的潜在生物标志物或治疗靶点。

图4. TLSs的特征分析及其临床相关性
综上所述,利用单细胞和空间转录组学分析,研究团队绘制了新辅助免疫治疗前后NSCLC 肿瘤微环境的高分辨率空间细胞和分子图谱,揭示了不同肿瘤细胞特征和微环境区域,及其在治疗反应中表现出的显著异质性和动态变化。该研究为了解与NSCLC ICB联合化疗反应性相对应的不同细胞和分子成分提供了见解。
参考原文:
Yan, Y., Sun, D., Hu, J. et al. Multi-omic profiling highlights factors associated with resistance to immuno-chemotherapy in non-small-cell lung cancer. Nat Genet (2024).
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言














#NSCLC# #联合疗法#
11