eGastroenterology:哈佛医学院揭示Gasdermin D在慢加急性肝衰竭中的多器官效应
2025-04-10 eGastroenterology eGastroenterology 发表于重庆
该蛋白在加剧肝脏损伤的同时,却又能保护肾脑免遭“连带伤害”。这一发现提示GSDM-D在ACLF中的效应可能有器官特异性,为ACLF治疗提供了全新思路!
导读
肝脏是人体最“沉默”的器官,一旦发生慢加急性肝衰竭(Acute-on-Chronic Liver Failure, ACLF),死亡率可高达50%以上!这种疾病常伴随多器官功能衰竭,治疗手段极为有限。近日,来自哈佛医学院Gyongyi Szabo教授及团队在eGastroenterology发表了一项题为“Gasdermin D deletion prevents liver injury and exacerbates extrahepatic damage in a murine model of alcohol-induced ACLF”的原创研究。首次揭示了焦亡关键蛋白——Gasdermin D(GSDM-D)在酒精诱发ACLF中的“双刃剑”作用:该蛋白在加剧肝脏损伤的同时,却又能保护肾脑免遭“连带伤害”。这一发现提示GSDM-D在ACLF中的效应可能有器官特异性,为ACLF治疗提供了全新思路!

一、ACLF:肝脏的“生死危机”,为何如此凶险?
什么是ACLF?
ACLF是一种在慢性肝病(如肝硬化)基础上突然恶化的致命综合征。患者可能在数天到数周内出现肝功能急剧恶化,并伴随至少一个肝外器官(如肾、脑、肺等)衰竭。据统计,全球每年有约80万例肝硬化患者因并发症住院,其中大部分因ACLF而需要重症监护和器官支持,而肝移植是目前唯一的有效治疗手段。
酒精:ACLF的“隐形推手”
长期酗酒是导致肝硬化和ACLF的主要原因之一。酒精会通过多种机制破坏肝细胞,包括:(1)直接毒性:代谢产物乙醛损伤DNA和蛋白质。(2)炎症风暴:激活免疫细胞(如中性粒细胞),可释放大量促炎因子。(3)细胞死亡:诱导细胞坏死性凋亡(necroptosis)和焦亡(pyroptosis)等。其中,焦亡作为一种炎症性程序性死亡方式,近年来备受关注,而执行焦亡的关键蛋白GSDM-D,正是本研究的核心。
二、Gasdermin D:细胞焦亡的“刽子手”还是“守护者”?
焦亡:一场“自爆式”免疫防御
当细胞感知到病原体或危险信号时,会启动焦亡:(1)炎症小体激活:如NLRP3识别危险信号。(2)Caspase酶切割GSDM-D:生成N端片段(NT-GSDM-D)。(3)细胞膜穿孔:NT-GSDM-D在细胞膜上形成孔道,释放促炎因子(如IL-1β、IL-18),同时细胞肿胀破裂。焦亡本是机体清除感染的防御机制,但过度激活会导致组织损伤。此前研究发现,GSDM-D在肝炎、脂肪肝等多种肝病中高表达,但其在ACLF中的作用尚不明确。
针对上述背景,研究团队提出3个关键问题并试图用小鼠模型来回答:
-
GSDM-D是否驱动ACLF的肝脏损伤?
-
抑制GSDM-D能否保护肝脏?
-
这种保护是否以牺牲其他器官为代价?
三、研究设计:小鼠模型揭秘GSDM-D的“双面角色”
研究团队构建了一种酒精诱发的ACLF小鼠模型:
-
慢性肝损伤:通过胆管结扎(bile duct ligation,BDL)手术诱导28天肝硬化。
-
急性打击:单次灌胃高剂量酒精(5g/kg),模拟酗酒引发的急性失代偿。
-
基因敲除:对比野生型(wild-type,WT)与GSDM-D基因敲除(knockout,KO)小鼠的病理变化。
在酒精灌胃9小时后,采集肝脏、肾脏和脑组织,评估:(1)炎症水平(如IL-6、中性粒细胞浸润);(2)细胞死亡类型(焦亡、凋亡和坏死性凋亡);(3)器官功能(肝纤维化、肾功能指标和脑神经炎症)。
四、颠覆性发现:敲除GSDM-D虽“拯救肝脏”,却让肾脑“遭殃”
01 肝脏:炎症减轻,但再生能力受损
积极作用:
-
炎症下降:GSDM-D敲除小鼠肝脏中促炎因子(IL-6、MCP1)、中性粒细胞浸润显著减少 (见图1)。
-
细胞死亡减少:凋亡(Caspase-3)、焦亡(IL-1β/IL-18)和坏死性凋亡(RIPK3)均被抑制。
-
纤维化缓解:胶原沉积减少,纤维化标志物(Col1a1)表达降低。
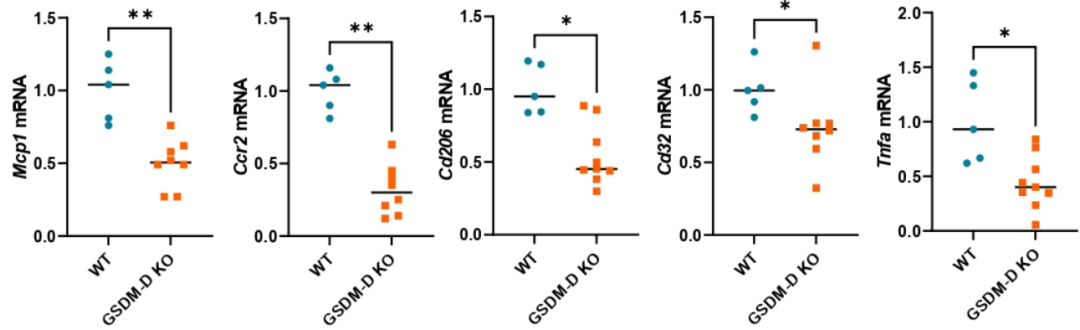
图1:GSDM-D敲除鼠(橘黄色,右侧)的炎症因子水平明显低于对照组
来源:原文图2C
消极作用:
-
肝细胞功能退化:凝血因子(F5、F8)合成减少,胆红素水平升高。
-
再生障碍:增殖标志物(Ki67)下降,干细胞/胆管细胞标记物(KRT7)增加,提示肝细胞转向“衰老”或“去分化”状态(见图2)。
上述结果表明:GSDM-D缺失虽然缓解肝脏炎症,但抑制了肝细胞再生并促进其衰老,这可能影响长期肝功能恢复。
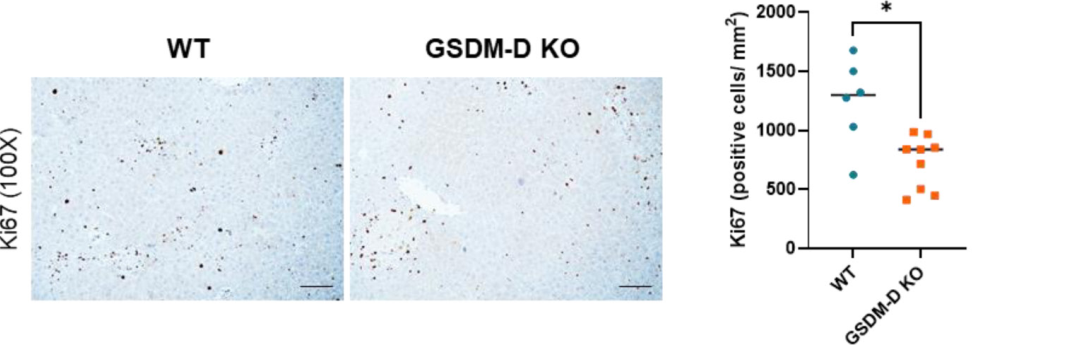
图2:GSDM-D敲除鼠的肝细胞增殖能力明显下降
来源:原文图6F
02 肾脏:损伤加重,坏死性凋亡“抬头”
-
功能恶化:KO小鼠血清尿素氮(blood urea nitrogen,BUN)和肾损伤标志物(KIM-1)升高。
-
病理评分上升:肾小管扩张、炎细胞浸润加剧。
-
死亡方式转变:焦亡减少,但坏死性凋亡相关基因(Ripk3、Mlkl)表达增加。
这表明:抑制焦亡本为减轻损伤,却意外激活了另一种死亡途径!
03 脑部:神经炎症加剧,神经元受损
小脑变化:
-
星形胶质细胞活化:GFAP(Glial Fibrillary Acidic Protein,胶质纤维酸性蛋白)表达升高。
-
神经元凋亡:促凋亡基因(Fas、Caspase-3)上调,抗凋亡因子(Bcl2)减少 (见图3)。
-
突触功能异常:突触蛋白(Syp、Psd95)表达紊乱。
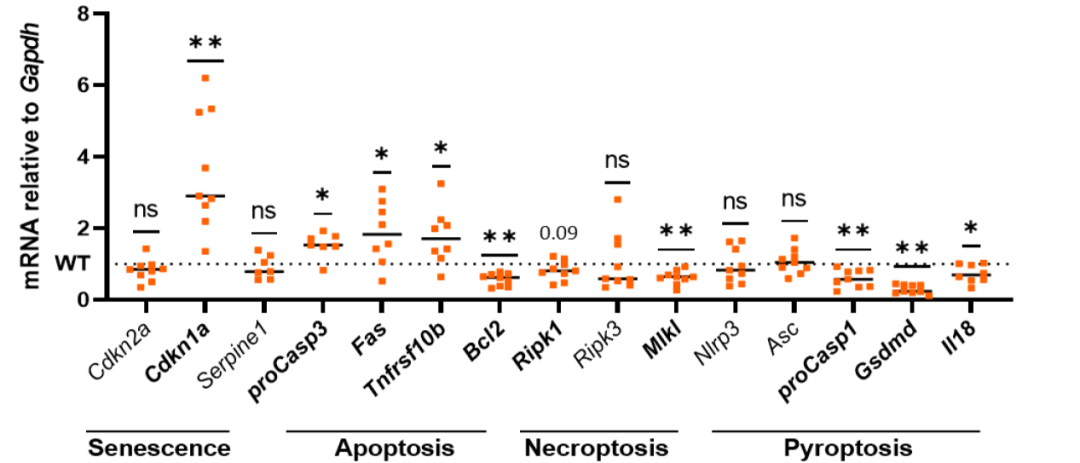
图3:焦亡得到了抑制,但神经元的凋亡却显著升高
来源:原文图8E
五、科学意义:ACLF的器官特异性治疗
1. 本研究首次揭示GSDM-D在ACLF中的多器官效应:挑战了“抑制焦亡必然有益”的传统观点。
2. 临床治疗启示:直接靶向GSDM-D可能“顾此失彼”,需开发器官特异性抑制剂(如肝脏特异性药物)。
结语
本研究像一把钥匙,打开了理解ACLF多器官损伤机制的新大门。同时,再次敲响警钟:长期酗酒不仅导致肝硬化,还可能引发全身多器官连锁衰竭。即便肝脏“暂时扛住”,肾、脑等器官也可能默默承受不可逆损伤。
引证本文
Martí Ortega-Ribera, Yuan Zhuang, Veronika Brezani, Radhika S Joshi, Zsuzsanna Zsengeller, Prashanth Thevkar Nagesh, Aditi Datta, Gyongyi Szabo - Gasdermin D deletion prevents liver injury and exacerbates extrahepatic damage in a murine model of alcohol-induced ACLF: eGastroenterology 2025;3:e100151.
https://doi.org/10.1136/egastro-2024-100151

本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言














#慢加急性肝衰竭# #Gasdermin D#
10