【Blood】How I Treat之急性髓系白血病的维持治疗
2024-10-16 聊聊血液 聊聊血液 发表于上海
文章通过四个病例讨论急性髓系白血病维持治疗,强调基于白血病生物学等因素个体化决策,介绍不同患者情况的维持治疗方案及相关研究进展。
AML的维持治疗
急性髓系白血病 (AML) 的长期生存取决于完全缓解的获得和维持。形态学完全缓解 (CR) 定义为骨髓原始细胞<5%,无循环原始细胞或髓外疾病,且血液学恢复(外周血中性粒细胞绝对计数[ANC]≥1000/μL且血小板计数≥100000/μL);其他 CR 类别包括CRh(除外ANC≥0.5×109/L [500/μL] 和血小板计数≥50×109/L [50000/μL],符合所有 CR 标准)和CRi(除外残留中性粒细胞减少<1.0×109/L [1000/μL或血小板减少<100×109/L [100000/µL],符合所有 CR 标准)。所有 CR 亚组均可达到无可测量残留病灶 (MRD),即持续白血病水平低于常规形态学检测。使用流式细胞术、聚合酶链反应 (PCR) 和/或二代测序 (NGS) 技术测量MRD,MRD阴性缓解与最长生存期相关。这些技术的灵敏度介于流式细胞术的10-3至双链测序的10-7,且指南也在不断发展,以帮助临床医生和病理学家解释 AML MRD 结果。大多数 AML 患者可通过当前诱导策略达到某种形式的CR,并进行缓解后治疗(通常包括不同周期的巩固化疗和/或造血干细胞移植,最常见的是来自异基因供者)。然而,许多 AML 患者(包括达到 MRD- 缓解的患者)即使完成巩固和/或移植也仍复发,AML复发后的生存期通常仅有数月。基于此,再加上维持治疗在改善急性淋巴细胞白血病患者总生存期方面获得成功,导致了几十年来寻找 AML 有效的缓解维持策略。
《Blood》杂志的How I Treat 系列近日发表文章” How I Treat: Maintenance Therapy in Acute Myeloid Leukemia(注:官网的题目为 “How I use Maintenance Therapy in Acute Myeloid Leukemia” ),作者通过4例实际病例,强调了在治疗缓解期 AML 患者和考虑使用缓解后维持治疗时面临的挑战,讨论了 AML 维持治疗的方案,并强调了选择策略需基于白血病生物学和风险分层、是否存在靶向突变、初始治疗方法、体能状态和异基因干细胞移植可行性进行个体化决策。

病例1:需要异基因干细胞移植的适合移植的高危AML患者,但在强化疗后发生并发症
患者为64岁男性销售高管,患有高血压,因呼吸短促、进行性运动不耐受和鼻出血到急诊科就诊。全血细胞计数 (CBC) 显示白细胞增多症,白细胞计数 (WBC)50x109/L、循环原始细胞50%、重度贫血和血小板减少。骨髓穿刺和活检确诊为AML,快速 FISH panel排除急性早幼粒细胞白血病和核心结合因子(CBF)重排。FISH检测也显示单体7,随后通过核型证实。快速分子学检测排除FLT3、NPM1和 IDH1/2 突变。患者开始伊达比星和阿糖胞苷标准诱导化疗。一周后NGS检测显示 ASXL1 和 RUNX1 突变。患者在接受诱导的同时接受异基因干细胞移植评估,发现是具有合适供者的良好候选者。患者获得形态学缓解,但流式细胞术显示MRD+。为根除MRD,患者接受一个周期的中剂量阿糖胞苷巩固治疗。该治疗并发 COVID-19 感染和耐药性大肠杆菌脓毒症,需要插管和重症监护,之后患者因虚弱需要康复。通过流式细胞术,骨髓活检仍为MRD+,但低于诱导后水平。
该患者有哪些治疗选择?根据 ELN 2022 标准,该患者为高危AML,未达到 MRD- 缓解,两者都是不良预后特征,是首次缓解期异基因干细胞移植的强指征,未经进一步治疗的情况下患者可能很快复发,然而巩固治疗后的临床状况妨碍了进一步强化巩固和移植。最佳维持治疗应以安全、耐受良好和易于给药的方式延长生存期。在过去30年针对该目标进行了各种药物和联合治疗的研究,但均未尚未稳健实现目标(表1)。低剂量标准化疗药物(包括阿糖胞苷、柔红霉素、硫鸟嘌呤和长春新碱)可小幅改善无病生存期,但以牺牲显著毒性为代价。使用免疫调节剂(如干扰素-α、白细胞介素-2、来那度胺和纳武利尤单抗)也具有显著毒性,且未能有意义地改善预后。低剂量白细胞介素-2和histamine dihydrochloride (HDC/IL-2) 维持治疗可改善无白血病生存期,在欧盟获批用于该适应症,但尚未广泛采用。一般不常规使用上述任何药物进行 AML 维持治疗。
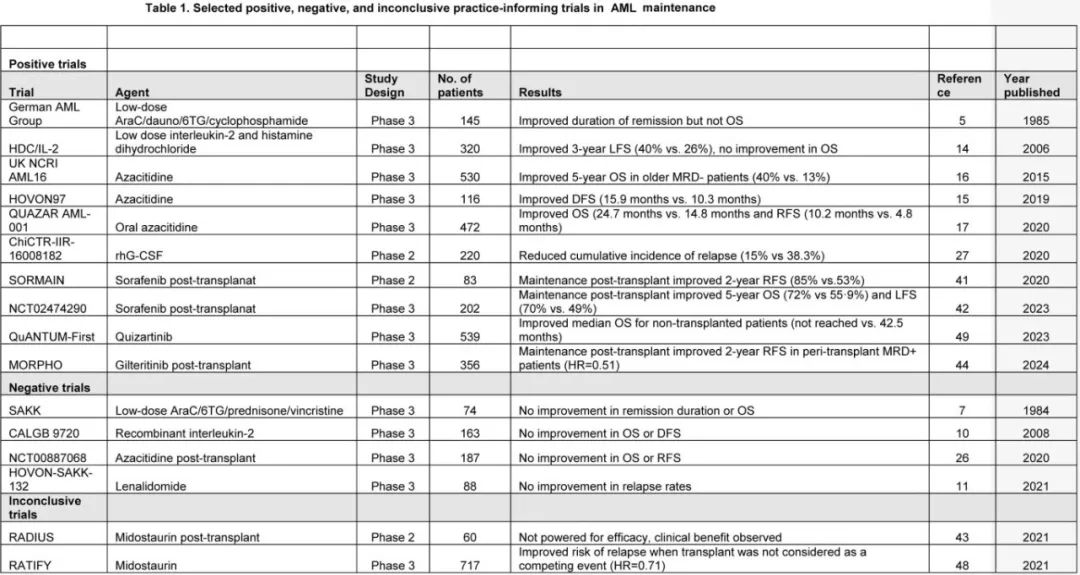
使用去甲基化药物注射用阿扎胞苷的两项缓解后维持研究显示,在老年 AML 患者中预后改善,安全性和可行性可接受。一项 III 期研究 (HOVON97) 将116例2个周期强化疗后CR/CRi 的≥60岁患者随机分配至12个周期安慰剂或皮下阿扎胞苷(50mg/m2,第1-5天)维持治疗。该治疗耐受良好(60%的患者完成所有12个维持周期),中位无病生存期从10.3提高至15.9个月,但总生存期无显著差异。与之相反,由英国NCRI开展的 AML16 III 期研究显示,化疗后MRD-(N=73) 且接受注射用阿扎胞苷维持治疗的老年 AML 患者亚组的5年总生存率改善(40% vs. 13%;P=0.003)。
根据 QUAZAR AML-001 研究的结果,在 AML 化疗后维持的特定情况下,口服阿扎胞苷在很大程度上取代了注射制剂。该研究纳入年龄≥55岁、细胞遗传学中危或高危、强化疗后首次达到 CR 或 CRi 但不适合移植的患者,对比CC-486(口服阿扎胞苷)与安慰剂。应注意的是,口服和注射阿扎胞苷具有不同的药代动力学和药效学特性,不应互换使用。重复28天治疗周期,患者在第1-14天接受口服阿扎胞苷 300mg 每日一次(n=238)与安慰剂 (n=234) 治疗。中位随访期41.2个月,口服阿扎胞苷显著延长OS(中位24.7个月vs.安慰剂组14.8个月,P=0.0009)和RFS(中位10.2个月vs. 4.8个月;P=0.0001)。基于这些数据,口服阿扎胞苷获得监管批准,并推荐作为强化疗后缓解且不计划干细胞移植的 AML 患者的维持治疗,已纳入许多国家的实践指南。在更长时间的随访(中位55.5个月)后,口服阿扎胞苷与安慰剂相比,估计的5年生存率仍显著更好 (26.5% vs 20.1%)。此外,无论基线细胞遗传学风险、接受巩固治疗、首次缓解(CR或CRi)或进入研究时是否存在MRD,口服阿扎胞苷均可带来生存获益。
该患者是否会从口服阿扎胞苷中获益?在 QUAZAR AML-001 研究中,接受口服阿扎胞苷治疗的患者中9%在研究入组时的美国东部肿瘤协作组 (ECOG) 体能状态评分为2-3,15%的患者为细胞遗传学高危,28%的患者年龄在55-65岁之间;无论这些基线特征如何,口服阿扎胞苷均可改善生存期。此外,45%的患者在随机化前接受了一个周期的巩固治疗。无论患者在研究入组前是否接受巩固治疗以及接受了多少个周期,口服阿扎胞苷均可显著延长生存期。值得注意的是,口服阿扎胞苷治疗可延长基线 MRD 阳性(通过流式细胞术测定,骨髓白血病细胞≥0.1%)患者(口服阿扎胞苷组N=103,安慰剂组N=116)的总生存期,且MRD+ 向 MRD- 的转化率高于安慰剂组 (37% vs 19%)。口服阿扎胞苷通常耐受性良好,患者接受中位12个周期(1-80)的治疗。最常见的毒性是为前两个治疗周期中观察到的1级和2级胃肠道事件及骨髓抑制,中性粒细胞减少发生率为41%。毒性很少需要停止治疗 (13%),患者能够继续接受治疗而不影响生活质量。
该患者随后如何?患者接受物理和职业治疗的同时开始口服阿扎胞苷维持治疗。由于患者在前1-2个周期内经常发生恶心和/或呕吐,因此在给药前 30 min 给予昂丹司琼4 mg。在治疗的第一周无胃肠道不适,但随后出现明显便秘,将其归因于昂丹司琼并停药。在口服阿扎胞苷的第二周期发生间歇性、轻度恶心和稀便,但能够进食,无呕吐,并拒绝进一步的预防性药物。口服阿扎胞苷2周后3天,中性粒细胞绝对计数为0.4×109/L,伴轻度贫血和血小板减少(无需输血)。给予预防性左氧氟沙星治疗,4天后中性粒细胞恢复至1.2×109/L。给予3个14天/周期的口服阿扎胞苷治疗,期间出现间歇性恶心、腹泻、中性粒细胞减少、贫血和血小板减少。尽管存在这些毒性,但患者可充分参与其康复计划,并稳定恢复其基线身体功能,达到再次适合移植的程度。第3周期结束时的骨髓穿刺显示MRD- CR(流式细胞术)。虽然患者感觉良好,并乐于成为功能性门诊患者,但也了解到其基线高危分层导致口服阿扎胞苷的长期缓解并不显示,因此选择进行异基因干细胞移植。
移植后患者是否应该进一步维持治疗?为什么?
ELN 高危患者即使在异基因干细胞移植后也有较高的复发风险,已经研究了多种预防性和抢先治疗策略来降低风险。去甲基化药物除了具有良好的耐受性外,还可以增强移植的移植物抗白血病效应,且不会加重毒性。一项在187例18-75岁高危 AML 和MDS患者中开展的 III 期研究中,患者在移植后随机接受阿扎胞苷 32mg/m2/天皮下注射(每28天给药5天,共12个周期)或未接受治疗,但研究组未显示生存获益。与之相反,一项II 期开放性随机研究纳入204例高危、MRD- AML患者(在随机后60-100天内接受异基因干细胞移植),rhG-CSF 联合低剂量地西他滨(5 mg/m2,第1-5天给药)对比不干预,结果显示出令人印象深刻的耐受性,累积复发率显著降低(15% vs 38.3%,风险比0.32,P<0.01),且未增加慢性移植物抗宿主病。虽然该研究很有希望,但尚未普遍采用。此外尚未确定其在既往暴露于去甲基化药物患者中的效用。在一项30例高危 AML 和 MDS 患者的单臂、剂量递增研究中报告了口服阿扎胞苷的移植后维持,具有良好的毒性和总生存期。口服阿扎胞苷的推荐移植后剂量为每日200mg持续14天,28天/周期。AMADEUS 研究是一项在AML或MDS患者中比较口服阿扎胞苷 (CC-486) 与安慰剂作为异基因造血干细胞移植后维持治疗的双盲、III期、随机研究,已完成入组 (NCT04173533)。还可以期待VIALE-T 研究 (NCT04161885) 的结果,其评价了 AML 患者异基因干细胞移植后维奈克拉联合阿扎胞苷与最佳支持治疗 (BSC) 作为维持治疗。目前该患者在移植后仍处于MRD- CR,未接受移植后维持治疗。
病例2:1例NPM1和SRSF2突变的54岁健康AML患者
患者女,54岁,运动,无明显病史,因乏力、气短两周就诊。血液检查示WBC 43.2×109/L、血红蛋白7.1g/dL、血小板49×109/L。骨髓检查示AML,原始细胞46%,免疫表型为CD34+、HLA-DR+ 和CD33+。常规细胞遗传学显示核型正常,分子测序确定 NPM1 和 SRSF2 突变。患者接受氟达拉滨、伊达比星、阿糖胞苷和gemtuzumab ozogamicin (FLAG-IDA + GO)诱导,随后进行第二个疗程FLAG-IDA。患者通过骨髓流式细胞术和外周血 RT-qPCR 检测 NPM1 达到 MRD-缓解。
该患者的预后如何?对于携带 NPM1 突变的患者,强有力的数据表明,在2个强化疗周期结束时通过RT-qPCR(中位灵敏度1.0×10-5)在外周血中测量获得分子学阴性可高度预测生存期。但应注意的是,该时间点为 MRD- 的患者在首次缓解期进行异基因干细胞移植未改善总生存期。虽然 NPM1 突变在 ELN2022 中归类为低危,但附加突变的预后影响仍存在争议。在入组两项 NCRI 前瞻性研究(AML17和AML19)的1357例 NPM1mut AML 患者的大型数据集中,3年总生存率为67%,不受 MDS 相关突变的影响。同样,在之前报告的德国研究联盟白血病多中心研究中接受治疗的936例 NPM1 突变 AML 患者中,继发性突变对临床结局无影响。然而其他较小的研究显示合并 MDS 相关突变具有负面影响,总生存期为15.3个月vs 43.7个月(P=0.002)。在 NCRI AML19 研究中,对于巩固治疗后转为 MRD-的 NPM1mut AML 患者 (N=115),使用FLAG-Ida + GO的3年总生存率为90%。
该患者是否应在化疗后接受维持治疗?很明显,MRD-与 NPM1mut AML 患者的生存期显著改善相关,但并非所有 MRD- NPM1mut AML 患者均将保持缓解状态。在强化诱导和巩固治疗的大型研究中,治疗后达到 MRD-且携带 NPM1 突变的 AML 患者在24-36个月内的复发率仍高达30-40%。尽管这些患者通常可通过挽救化疗和异基因干细胞移植重新获得持久缓解,但很容易担心监测复发和复发后的治疗。在口服阿扎胞苷维持治疗的 QUAZAR 研究中,在试验入组期间未常规收集突变数据;根据其正常细胞遗传学,病例2中的患者归类为中危。该研究的事后分析从患者病例报告表中收集诊断时的基因突变。对于基线 NPM1 突变患者,与安慰剂相比,口服阿扎胞苷可使总生存期和无复发生存期分别改善37%(风险比 [HR]=0.63)和45%(HR=0.55)。对于NPM1 突变MRD-患者(骨髓流式细胞术),中位总生存期为48.6个月,口服阿扎胞苷与安慰剂相比对无复发生存期的影响具有统计学意义。QUAZAR研究的进一步事后分析显示,口服阿扎胞苷治疗对后续针对复发的挽救治疗(包括移植)或复发时的突变谱均无负面影响。最后,尽管 QUAZAR 没有关于同时存在 NPM1 和 MDS 相关突变患者的具体数据,但对研究中出现 MDS 相关异常的患者 (AML-MRC,N=101/472) 进行事后分析显示,口服阿扎胞苷可改善总生存期、无复发生存期和 MRD-持续时间。
该患者如何治疗?该患者不适合参加 QUAZAR 试验,因为>55岁且适合接受异基因干细胞移植。然而患者强烈排斥异基因干细胞移植。考虑到事后分析的局限性,基于上述汇总数据,作者计划给予2个周期的大剂量阿糖胞苷巩固治疗,随后进行口服阿扎胞苷维持治疗。第一个巩固周期并发败血症。由于 NCRI AML 19 研究未显示 FLAG-IDA 2 个疗程后 MRD-的NPM1+患者中额外巩固周期有获益,且 QUAZAR 研究显示口服阿扎胞苷的获益(不考虑巩固周期数),作者选择放弃额外的大剂量阿糖胞苷,并继续口服阿扎胞苷维持治疗。
病例3:具有可靶向突变的适合移植AML患者
1例45岁一般健康男性诊断为AML。细胞遗传学分析显示正常男性核型,分子检测显示 FLT3-ITD 和 IDH1 突变。作为临床试验的一部分,患者接受7+3和吉瑞替尼诱导治疗,住院过程顺利,血细胞计数恢复后,通过高敏 PCR/NGS 检测证实形态学缓解,两种突变持续存在。患者接受大剂量阿糖胞苷和吉瑞替尼巩固疗程,FLT3-ITD和 IDH1 分子学持续存在。
如果患者接受异基因干细胞移植,是否应接受维持治疗?为什么?NCCN Version 3.2023指南指出,携带 FLT3 突变的 AML 患者移植后维持治疗有4种选择(索拉非尼、midostaurin、吉瑞替尼和quizartinib),均为 2B 类,即“基于较低水平的证据,NCCN一致认为干预是合适的。对超过3100例近期移植的北美 FLT3-ITDAML 患者进行的分析显示,移植后 FLT3 抑制剂的使用率从2014年的8%增加至2019年的40%,表明该共识在临床实践中得到体现。在随机、安慰剂对照、双盲、II期 SORMAIN 研究中,83例异基因移植后接受索拉非尼治疗2年的FLT3-ITD+ 患者的2年无复发生存率与安慰剂组相比显著改善(85% vs 53.3%,HR=0.256, P=0.002)。刘启发教授牵头的一项随机研究 (N=202) 进一步支持索拉非尼治疗,表明移植后索拉非尼维持治疗直至移植后第180天可改善总生存期 (72% vs 55.9%,HR=0.55,P=0.011) 和无白血病生存期 (70% vs 49%,HR=0.47,p=0.0007)。在 II 期 RADIUS 研究中,60例既往未暴露于 FLT3 抑制剂的FLT3-ITD+ 患者在异基因移植后随机分配至midostaurin联合标准治疗 (SOC) 组与 SOC 组。虽然其效力不足以评价疗效,但研究者认为midostaurin具有临床获益。索拉非尼和midostaurin存在耐受性问题,可导致频繁的不良事件和治疗中止。
MORPHO 研究改变了临床实践,正在指导 FLT3-ITD 患者进行移植后维持的策略。在 MORPHO 中,356例患者在异基因干细胞移植后随机接受吉瑞替尼 120mg 每日一次或安慰剂治疗2年,研究因为无复发生存期 (RFS) 的总体改善而未达到统计学显著性。然而采用高灵敏度 PCR-NGS FLT3-ITD MRD检测(1×10-6),在移植前和/或移植后可检测到 MRD 的患者中,移植后吉瑞替尼维持治疗在 RFS 方面确实显示出显著获益 (HR=0.515,P=0.0065);50.5%的患者在移植前或移植后可检测到MRD。重要的是围移植期MRD-患者未从吉瑞替尼维持治疗中获益。吉瑞替尼耐受性良好,但与唑类抗真菌药联用时骨髓抑制显著。根据经验,吉瑞替尼比索拉非尼或midostaurin更容易耐受。在 QuANTUM-FIRST 研究中,MRD检测(与 MORPHO 研究中相似)显示出在quizartinib诱导化疗后的预后价值,可以期待基于 MRD 状态的移植后quizartinib维持治疗的获益数据。鉴于 PCR-NGS MRD 检测和吉瑞替尼的使用并非普遍可及,FLT3-ITD 患者接受可用且可耐受的任何 FLT3 抑制剂都是合理的,但可能过度治疗一部分已检测不到疾病的患者。值得注意的是,患者2还携带 IDH1 突变,而目前已经可获得耐受良好的口服抑制剂。虽然在一项18例患者的小型研究中,使用艾伏尼布进行移植后维持治疗的2年无进展生存率为81%,2年总生存率为88%,但尚无足够的数据推荐 IDH 抑制剂用于这种情况。此外,对于接受移植和移植后环磷酰胺的IDH1+ AML患者,移植前 IDH1 的分子学持续并不影响结果。因此,在临床试验之外,作者不使用 IDH 抑制剂作为移植后维持治疗。
如果患者未接受移植,是否应接受维持治疗?为什么?虽然治愈 FLT3-ITD AML 的最佳机会通常是异基因干细胞移植,但移植并不总是可用或可行。在 RATIFY 研究中,虽然midostaurin维持治疗对生存期的影响尚不确定,但在 QuANTUM-First 研究中接受quizartinib维持治疗的89例非移植患者与安慰剂相比具有显著的总生存期获益(HR=0.401)。因此,对于未进行移植且接受quizartinib作为诱导治疗一部分的 FLT3-ITD 患者,作者会给予quizartinib维持治疗。移植外吉瑞替尼维持治疗的作用还需要确认。口服阿扎胞苷可改善 AML 患者的总生存期和无复发生存期(不考虑FLT3 突变状态),但应注意的是,QUAZAR研究中仅16例患者为NPM1wt 和FLT3-ITD+。
该患者如何治疗?患者接受清髓性预处理相合同胞供者异基因干细胞移植。第40天患者开始接受吉瑞替尼维持治疗,14个月时耐受良好。假设患者仍为MRD-,计划根据 MORPHO 研究数据继续治疗2年。
病例4:1例76岁患者,有医学合并症
1例76岁女性患者,患有充血性心衰,有肺癌病史,在2个月期间出现进行性贫血和中性粒细胞减少。骨髓评估示原始细胞25%,表达MPO、CD34、HLA-DR、CD13和CD33。细胞遗传学正常,NGS检测显示 IDH2 R172K 突变 (VAF,36%) 和 DNMT3A R882 突变 (VAF,15%)。开始接受阿扎胞苷和维奈克拉治疗。第36天的反应评估显示形态学完全缓解伴中性粒细胞减少,流式细胞术显示 MRD 证据。
对于接受低强度诱导治疗的AML患者,维持治疗的定义是什么?FDA将维持治疗定义为“在达到 CR 后给予延长但有时间限制的疗程,通常相对无毒,目的是降低复发风险”。FDA还对维持治疗和持续治疗进行了区分,即“诱导期后延长疗程,目的是在治疗期间控制 AML 疾病负荷。持续治疗可能有时间限制,但通常持续给药直至出现不可接受的毒性或反应后复发“。尽管如此,大多数医生将口服阿扎胞苷作为维持治疗,尽管它批准作为持续治疗。同样,大多数医生以缓解后阿扎胞苷和维奈克拉(AZA-VEN) 作为维持治疗的一种形式(AZA-VEN是老年和/或不适合 AML 患者的标准治疗)。鉴于接受 AZA-VEN 治疗的患者中,大多数接受持续的缓解后治疗的持续时间和剂量均短于/短于诱导期间,将持续的 AZA-VEN 周期称为维持治疗更简单。
对于病例4中的患者,作者继续进行重复周期的 AZA-VEN 维持治疗,并调整剂量和给药方案以减轻中期血细胞减少和其他毒性。目前尚无证据支持在这种情况下将注射用阿扎胞苷变更为其当前可用的口服剂型,但预计在不久的将来会有可能改变实践的其他口服去甲基化药物的数据。此外尚无数据支持将病例4中的患者变更为使用维奈克拉单药维持治疗。最后,尽管患者携带 IDH2 突变,但目前尚无疗效或毒性数据支持将其维持治疗变更为单独使用 IDH2 抑制剂 enasidenib 或联合 AZA-VEN。有新出现的数据表明,在接受 AZA-VEN 的特定患者(包括 IDH1/2 突变、NPM1突变和流式细胞术 MRD-患者)中停止治疗的可能性,但这些结果在常规临床实践中采用还为时过早。
结论
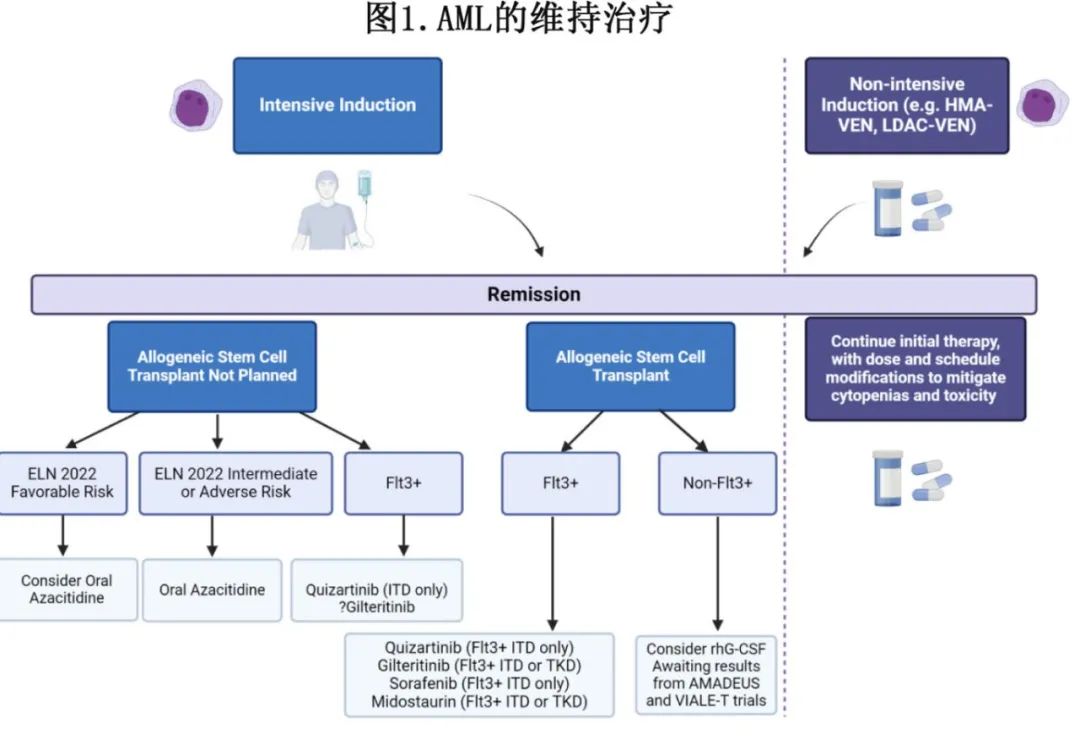
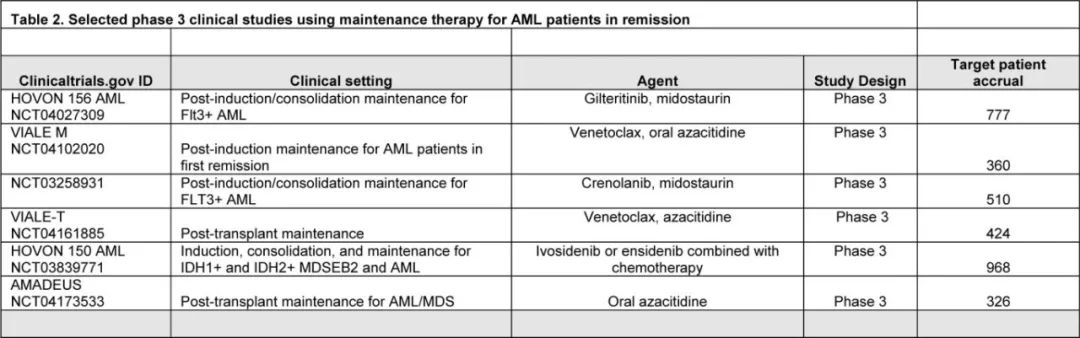
缓解后维持治疗是 AML 患者标准治疗的一部分(图1),接受强化疗且未及时进行异基因干细胞移植的中危或高危患者应接受口服阿扎胞苷,移植前和/或移植后有残留疾病的 FLT3-ITD 患者应接受 FLT3 抑制剂。还强烈建议未接受移植的 NPM1 和/或 FLT3-ITD 突变患者进行维持治疗。接受低强度诱导治疗的患者,最典型的是AZA-VEN,应接受正在进行的治疗周期治疗,并调整剂量和给药方案以优化耐受性。有多项正在进行的临床试验,预期在未来几年将产生潜在的实践变化结果(表2)。此外在不久的将来,基于 PCR/NGS 的高灵敏度 MRD 检测将常规用于指导分子学定义亚组患者的维持治疗的实施和中止。到目前为止,尚无数据明确大多数患者的“安全”维持停药时间点。因此如果可行且耐受良好,作者倾向于对许多开始维持治疗的患者进行无限期治疗,尤其是无可追踪突变的患者和 ELN 中危和高危患者。
参考文献
Roboz GJ, Canaani J.How I use Maintenance Therapy in Acute Myeloid Leukemia.Blood . 2024 Oct 7:blood.2024024010. doi: 10.1182/blood.2024024010.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言












#急性髓系白血病# #维持治疗#
17