梅奥诊所:胰腺腺泡细胞癌基因胚系/体系突变率高,存在HRR/RAF/MMR等潜在治疗靶点
2025-03-23 苏州绘真医学 苏州绘真医学 发表于陕西省
回顾性分析 65 例梅奥诊所 PACC 患者,中位年龄 66 岁,近半为可切除 / 交界可切除疾病。不同分期 5 年 OS 不同,NGS 检测出多类可操作靶点。强调异质性和侵袭性,凸显个性化治疗潜力。
胰腺腺泡细胞癌(PACC)是一种罕见、侵袭性强的胰腺癌,起源于外分泌胰腺的腺泡细胞。本研究旨在探索PACC患者的临床和分子特征。回顾性分析了2002年至2023年在梅奥诊所就诊的PACC患者。对患者的基线特征、肿瘤病理、治疗策略及生存结局进行了分析。共纳入65例PACC患者,诊断时的中位年龄为66岁。近一半患者(48%)为可切除/交界可切除疾病(n=28)。可切除/交界可切除、局部晚期/不可切除和转移性疾病患者的5年总生存率(OS)分别为72.0%、21.6%和20.9%。体细胞和胚系NGS检测识别了许多潜在可操作靶点,包括同源重组(43%体细胞,33%胚系)、RAF改变(29%体细胞)和错配修复(14%体细胞)。本研究结果强调了PACC的异质性和侵袭性。尽管可切除/交界可切除疾病患者的预后较好,但OS仍然较差,尤其是对于局部晚期或转移性疾病患者。相当一部分患者识别了可操作分子靶点,突显了个性化治疗方法的潜力。未来的研究应聚焦于利用这些分子弱点的个性化治疗策略,这可能为改善这种罕见恶性肿瘤的结局提供新的选择。
研究背景
胰腺腺泡细胞癌(PACC)是一种起源于外分泌胰腺腺泡细胞的罕见肿瘤。它与更常见的胰腺导管腺癌(PDAC)不同,约占所有胰腺恶性肿瘤的1%-2%。PACC的临床表现通常包括一系列症状,从非特异性的腹部不适、体重减轻、黄疸到消化并发症。吸烟、职业性化学物质接触以及潜在的遗传易感性等因素被认为可能与PACC的发生有关。
PACC主要发生在60岁左右的成年人中,预后较差,中位总生存期(OS)约为11-25个月。在显微镜下,这些细胞与正常腺泡细胞相似,但表现出不受控制的增殖和非典型的细胞特征。它们通常形成分化良好、结构紧密的腺状结构,常显示出明显的腺泡分化,含有酶原颗粒和嗜酸性细胞质。虽然它们可能保持一定程度的腺泡细胞分化,但也表现出多种结构模式,包括实性生长、小梁状排列和假乳头状结构,这使得肿瘤外观呈现异质性。免疫组织化学(IHC)染色通常显示腺泡细胞标记物(如胰蛋白酶、糜蛋白酶和脂肪酶)的表达,进一步证实腺泡分化。此外,这些肿瘤可能表现出不同程度的细胞异型性和核多形性,这些特征有助于将其与其他胰腺恶性肿瘤区分开来。
PACC的管理策略采用多学科方法,由于该疾病的罕见性,大多借鉴PDAC指南。在本研究中,我们回顾性分析了梅奥诊所的PACC患者,旨在更好地明确这些肿瘤的临床和分子特征。
研究结果
患者结局
识别了梅奥诊所2002年至2023年期间65例PACC患者。大多数患者为男性(74%,n=48),诊断时的中位年龄为66岁(范围为23-88岁)。7例患者有病理和人口统计学数据,但没有进一步的临床信息。在其余58例患者中,48%(n=29)为可切除/交界可切除疾病,9%(n=5)为局部晚期/不可切除疾病,43%(n=25)在诊断时已发生转移(表1)。
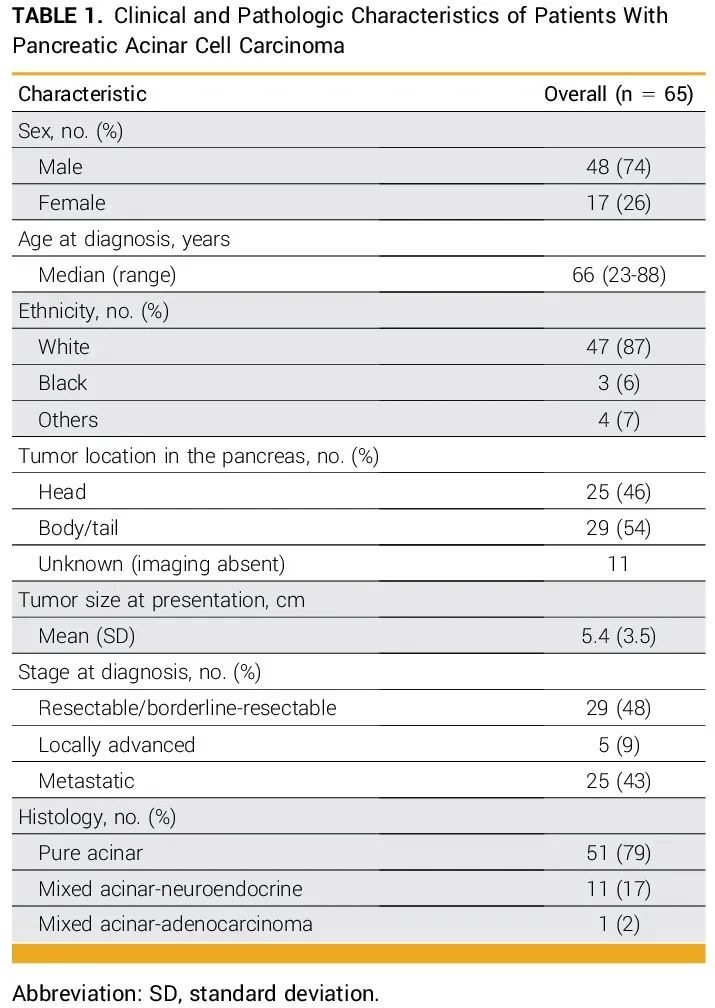
表1
几乎所有可切除/交界可切除疾病患者(93%,27/29)都接受了手术切除(表2)。2例未接受手术的患者存在基础合并症,无法进行手术干预。这些患者中,超过一半(59%,17/29)接受了围手术期化疗,最常用的方案是亚叶酸钙、氟尿嘧啶、伊立替康和奥沙利铂(FOLFIRINOX),在新辅助(n=11)和辅助(n=3)治疗中均是如此。围手术期放疗也是常见的治疗选择(41%,12/29),大多数患者接受原发性肿瘤新辅助放疗同步化疗。1例患者拒绝同步化疗,仅接受了新辅助放疗。接受诱导化疗加围手术期放疗的患者的客观缓解率(ORR)为73%(8/11;新辅助化疗加放化疗为81%,8/9;新辅助化疗加辅助放化疗为0%,0/2),而仅接受新辅助诱导化疗的患者ORR为66%(2/3)。
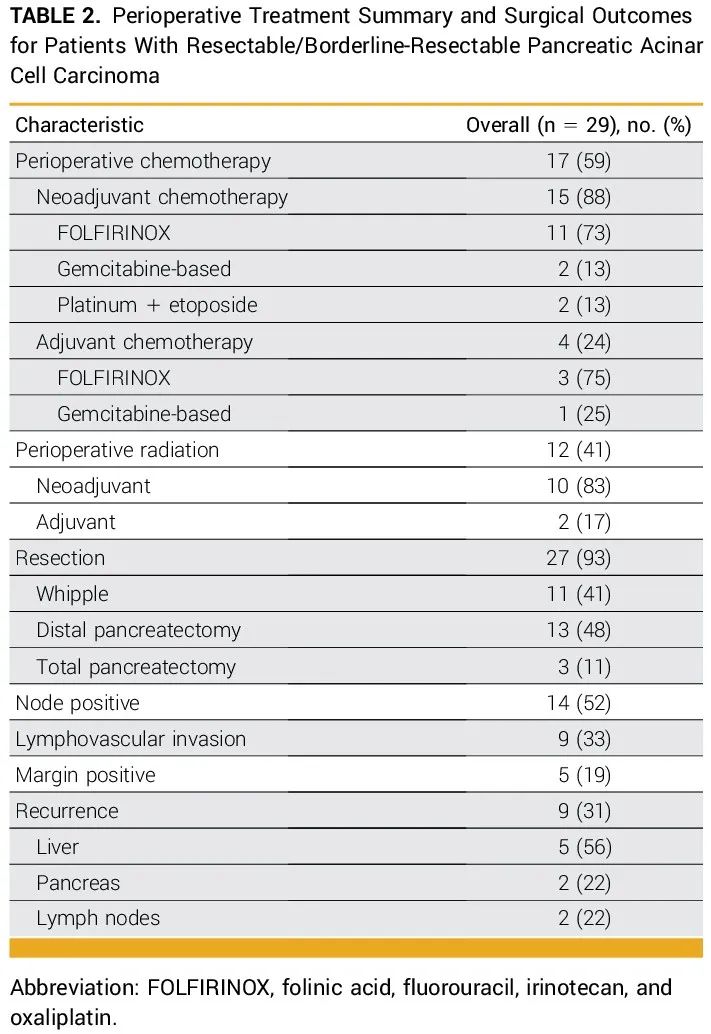
表2
在接受手术切除的27例患者中,三分之一(33%,n=9)已知出现复发,5例失访。在复发患者中,大多数为纯腺泡细胞癌(n=7),其次是腺泡-神经内分泌癌(n=2),原发性肿瘤多位于胰头(78%,7/9)。3例(33%)手术切缘阳性,其余存在淋巴结阳性疾病(66%,6/9)或淋巴管血管侵犯(33%,3/9)。接受新辅助FOLFIRINOX的患者复发率为36%(n=4)。接受顺铂加依托泊苷新辅助治疗的2例患者均出现复发。此外,2例接受肿瘤床辅助放疗的患者均复发,而接受新辅助同步放化疗的患者中只有三分之一(33%,n=3)复发。6例(66%)复发患者进行了体细胞NGS检测,其中大多数(83%,5/6)检测到致病性改变(分别为FGFR1扩增、BRCA2、NTRK1融合、MTOR和BRAF V600E)。6例(66%)患者进行了胚系NGS检测,均未发现致病性突变,1例检测到MLH3基因意义未明的变异(VUS)。可切除患者的中位随访时间为40个月,3年和5年生存率分别为79%和72%。接受根治性手术切除患者的中位无复发生存期(RFS)为36个月,3年和5年RFS均为47%(图1)。
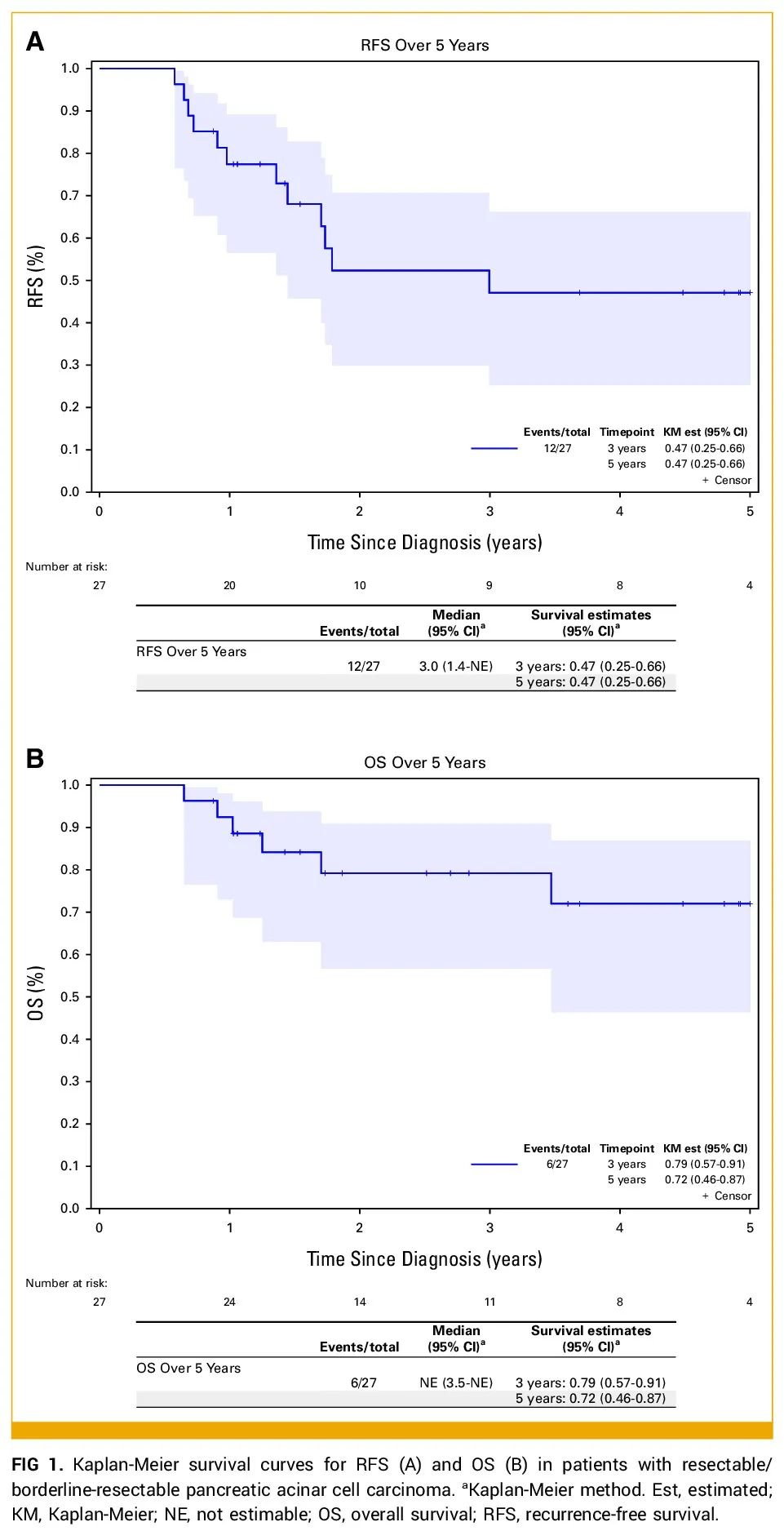
图1
大多数复发患者出现异时性肝转移(56%,5/9),其次是胰腺局部复发(22%,2/9)和仅淋巴结受累(22%,2/9,表2)。肝转移患者的中位RFS为7.2个月,而仅淋巴结受累和局部复发患者的中位RFS分别为10.7个月和17.0个月。疾病复发部位不同的患者,基因组改变无明显差异。5例异时性肝转移患者中,3例存在致病性突变(FGFR1扩增、BRCA2和MTOR)。携带NTRK融合和BRAF V600E突变的患者分别在胰腺和淋巴结复发。
8例(29.6%)接受手术切除的患者在5年时未复发。其中大多数为纯腺泡细胞癌(88%,7/8),原发性肿瘤多位于胰体/胰尾(75%,6/8)。大多数患者淋巴结阴性(75%,6/8),无淋巴管血管侵犯(88%,7/8)。一半(50%,4/8)患者接受了新辅助FOLFIRINOX和放疗。1例患者接受了新辅助吉西他滨加顺铂但未接受放疗,其余患者(n=3)在围手术期既未接受化疗也未接受放疗。这些患者均未进行体细胞NGS检测。2例患者进行了胚系检测,其中1例检出胚系BRCA2突变,另1例检出MLH1基因VUS。在局部晚期/转移性疾病患者中,只有1例因肝脏寡转移接受了手术切除。他在手术前接受了4个月的新辅助亚叶酸钙、氟尿嘧啶和奥沙利铂(FOLFOX),原发性胰腺肿块和肝转移灶达到影像学部分缓解。术后约3年,他出现肝脏疾病进展,接受吉西他滨加顺铂4个月,随后失访。大多数(95%,21/22)局部晚期/转移性疾病患者接受了姑息性全身治疗。其余1例患者在开始任何全身治疗前就进入了临终关怀阶段。一线治疗方案多样,以5FU为基础的化疗占多数(n=10,FOLFIRINOX;n=1,亚叶酸钙、氟尿嘧啶和伊立替康[FOLFIRI]),其次是吉西他滨为基础的化疗(n=2,吉西他滨加白蛋白结合型紫杉醇;n=1,吉西他滨加顺铂;n=1,吉西他滨加厄洛替尼),以及卡铂加依托泊苷(n=3)。其他一线治疗方案包括拓扑替康(n=1)和卡培他滨加替莫唑胺(n=1),这两例患者在治疗仅1个月后就出现疾病进展。中位随访时间为20.4个月,局部晚期/转移性PACC患者一线治疗的中位无进展生存期(PFS)和OS分别为10.8个月和27.3个月。单独分析时,局部晚期和转移性疾病患者的中位OS分别为42.5个月和24.7个月(图2)。
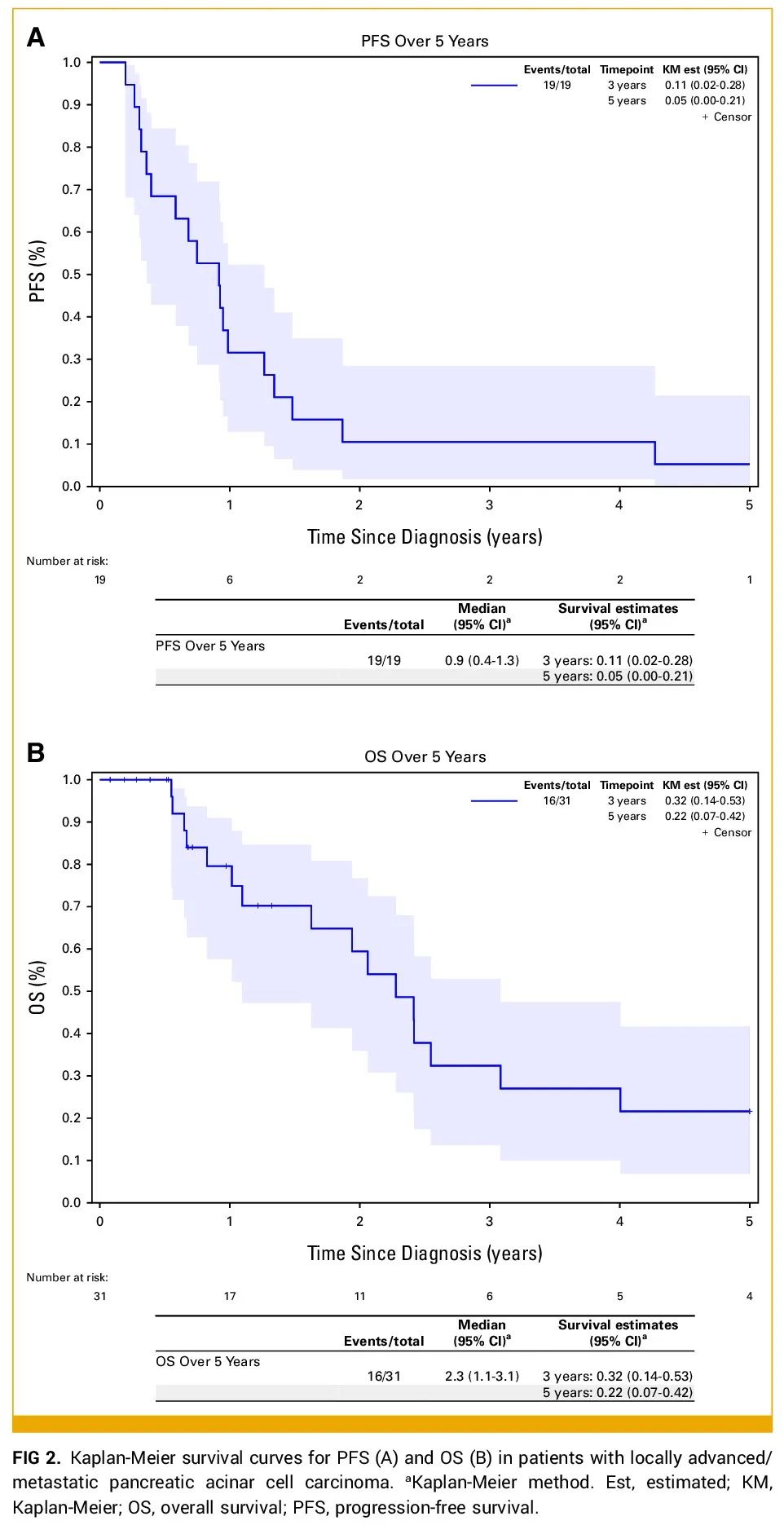
图2
68%(n=15)的患者接受了二线治疗,其中大多数是以5-FU为基础的方案(n=4,FOLFIRINOX;n=2,FOLFIRI;n=1,FOLFOX),其次是吉西他滨为基础的化疗(n=2,吉西他滨加白蛋白结合型紫杉醇;n=1,吉西他滨加顺铂;n=1,吉西他滨加卡培他滨)。不同治疗线患者的描述性结局,包括疾病控制率(DCR)、ORR和PFS,总结在表3中。
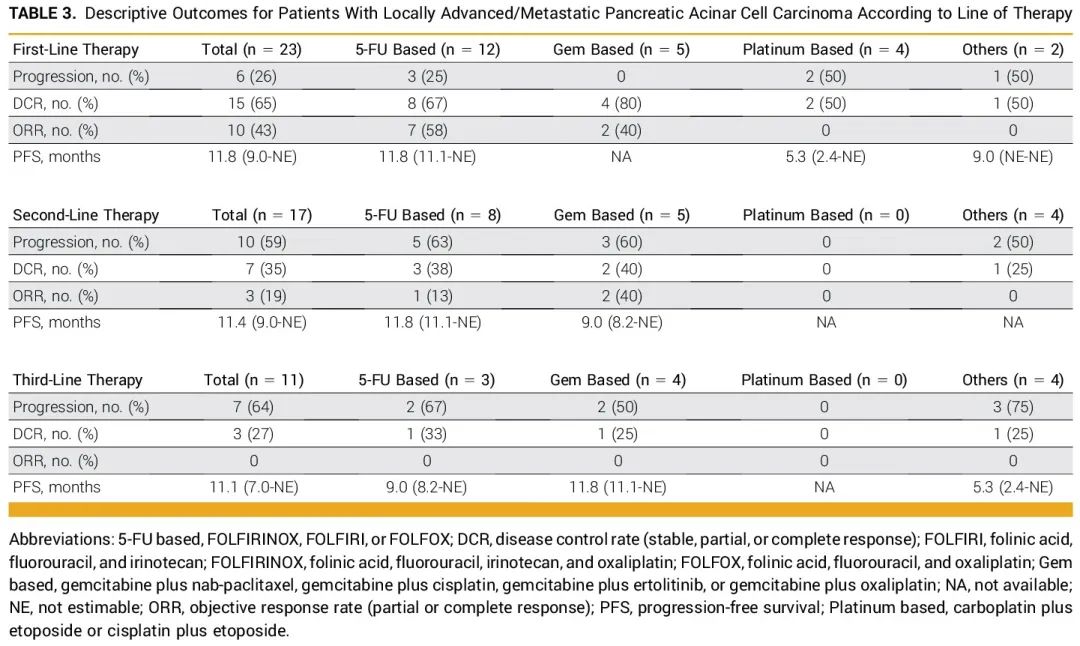
表3
体细胞NGS检测
21例患者进行了体细胞NGS和分子检测(图3),43%(n=9/21)的患者因此获得了额外的治疗选择。值得注意的是,几例患者同时存在同源重组(HR)、错配修复(MMR)和BRAF基因改变,这使得2例患者能够使用多种靶向药物。1例MMR缺陷(dMMR)的PACC患者(IHC染色显示MLH1和PMS2缺失)接受了伊匹木单抗和纳武利尤单抗治疗,最终因HR突变(PALB2、RAD51C)接受奥拉帕利治疗。另1例因胚系HR突变(CHEK2)接受奥拉帕利治疗的患者,最终因BRAF改变(SND1-BRAF融合)接受了达拉非尼加曲美替尼治疗。大多数患者(39%,n=9)存在HR通路致病性改变,涉及ATM(n=4)、BARD1(n=1)、BRCA2(n=4)、CHEK2(n=1)、PALB2(n=3)和RAD51C(n=1)。其中3例患者在病程中接受了奥拉帕利靶向治疗。1例患者在对化疗(FOLFIRINOX治疗36个月,FOLFIRI治疗33个月)达到影像学完全缓解后开始接受奥拉帕利维持治疗,疾病控制维持了超过17个月。另外2例患者在治疗仅1-2个月后就出现疾病进展。
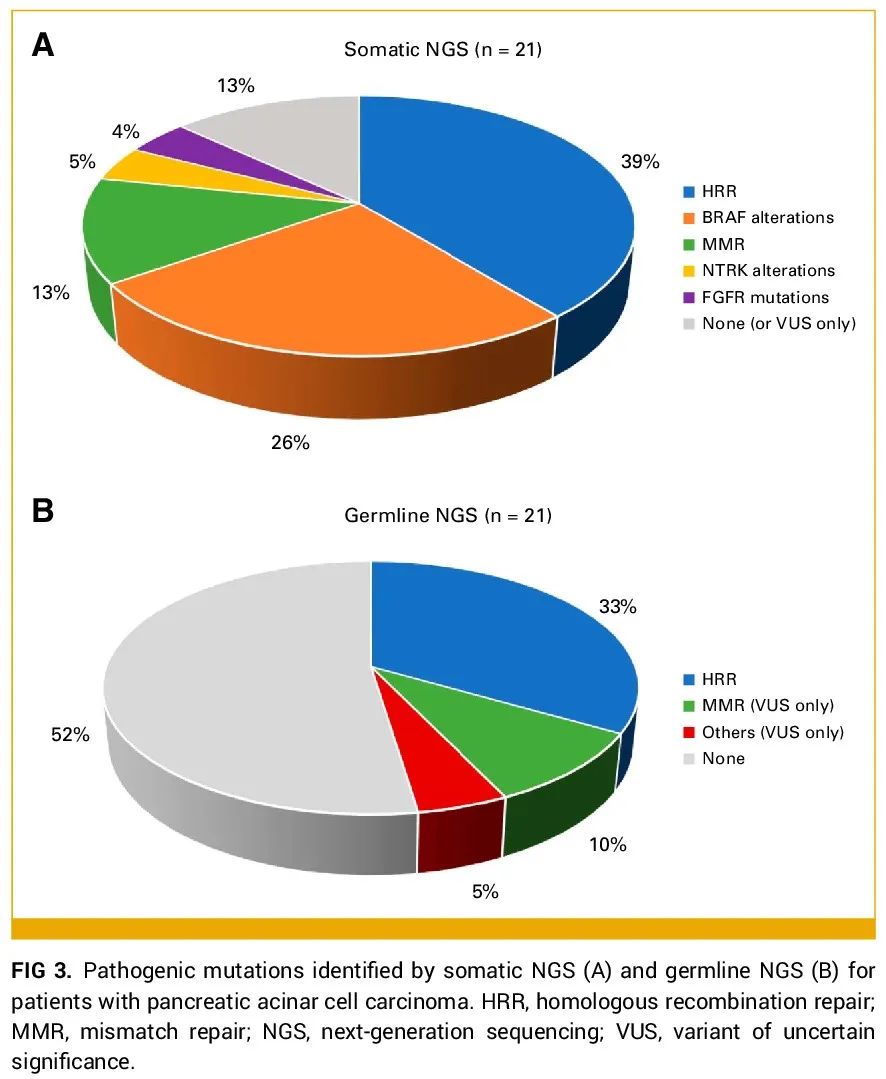
图3
体细胞NGS检测中发现的第二常见突变是RAF改变(26%,n=6)。包括BRAF V600E(n=1)、KANK4-RAF1融合(n=1)、SND1-BRAF融合(n=2)、TBXAS1-BRAF融合(n=1)、BRAF内含子9倒位(n=1)。其中3例患者接受了BRAF抑制剂靶向治疗(n=2,达拉非尼联合曲美替尼;n=1,优立替尼联合曲美替尼)。2例患者在治疗仅1个月后就出现疾病进展,另1例失访。
3例患者(13%)存在MMR基因突变。1例NGS检出TBXAS1-BRAF重排的患者,原发性肿瘤IHC染色还发现MLH1和PMS2缺失。他接受了纳武利尤单抗联合伊匹木单抗治疗。遗憾的是,免疫治疗仅1个月后就出现疾病进展。另外2例患者NGS检出MMR突变:1例为MLH1和MSH3突变,但未进行IHC染色确认;另1例为MLH1突变,IHC显示MMR正常。然而,由于疾病稳定,这两例患者均未接受免疫治疗。
还有2例患者在疾病过程中接受了靶向治疗,包括1例ETV6-NTRK3基因融合患者,接受了一线拉罗替尼(一种原肌球蛋白受体激酶抑制剂)治疗。他接受了18个月的治疗,获得影像学部分缓解,但因全身性水肿和贫血这些副作用停药。另1例患者检出FGFR1突变,在FOLFIRINOX后接受了舒尼替尼二线治疗。他获得了超过20个月的疾病稳定,之后疾病进展,更换为吉西他滨加白蛋白结合型紫杉醇治疗。
胚系NGS检测
21例患者进行了胚系NGS和分子检测,43%(n=9/21)的患者存在致病性突变,10%(n=2/21)的患者存在VUS。与体细胞NGS结果相似,大多数患者(33%,n=7)存在HR通路改变,包括ATM、CHEK2、BARD1、PALB2和BRCA2突变。2例接受奥拉帕利治疗的体细胞HR突变患者,也存在HR基因胚系改变(ATM和PALB2)。未发现患者存在胚系MMR基因突变;然而,有2例患者分别存在MLH1和MSH3 VUS。其中1例患者IHC显示MMR正常,另1例未完成IHC检测。这两例患者均未接受免疫治疗。最后,1例患者存在BLM和CDKN1B基因胚系VUS。该患者的体细胞NGS识别了上述KANK4-RAF1融合,最终接受了达拉非尼联合曲美替尼治疗。
讨 论
本研究中PACC的临床特征与先前报道一致,与PDAC的临床特征相比,PACC发病年龄更早,且男性患者发病率更高。PACC的病理特征也很独特,偶尔会出现导管和神经内分泌分化。一项类似的43例PACC病例系列研究显示,6例患者(14%)具有神经内分泌特征,这与我们队列中17%的比例相符。此外,我们发现近一半的患者在初诊时为可切除/交界可切除疾病,这也与其他多机构研究结果相似,这些研究表明,诊断时早期(I期和II期)患者占45%-55%,晚期(III期和IV期)患者占40%-50%。在各项临床结局指标中,R0切除率为81%(表2)。对美国国家癌症数据库(NCDB)PACC患者的回顾性研究显示了相似的结果,R0切除率为77%,而类似的PDAC患者回顾性研究中R0切除率为72%。在我们的研究中,接受手术切除的患者中位RFS为36个月,优于其他研究的结果。然而,这些研究大多样本量较小,且采用的是较旧的方案。最近一项回顾性多中心研究显示,中位RFS为30个月,5年RFS为38%,这与我们的结果相当。临床结局的差异可能是由于该疾病的罕见性以及不同研究中患者群体的差异。
尽管不同研究的临床结局存在差异,但总体而言,PACC的预后优于PDAC,尤其是对于可切除/交界可切除疾病患者。先前的研究对于PACC辅助化疗的获益存在相互矛盾的结果。鉴于此类研究的样本量较小,很难得出明确结论。因此,大型数据库研究可能有助于评估这一问题。最近一项NCDB分析表明,与仅手术切除相比,辅助治疗与生存获益相关。虽然由于样本量较小,我们在本研究中未进行此类分析,但值得注意的是,在5年时存活且无疾病的患者中,大多数(n=5/8)在围手术期接受了基于铂类的新辅助治疗。鉴于围手术期化疗在PDAC中的作用已得到充分证实,合理推断新辅助治疗策略在PACC中也具有价值,特别是考虑到这些患者中HR基因改变的发生率较高,此类肿瘤对铂类药物敏感。即使在晚期/转移性疾病患者中,随着治疗线数的增加,疾病控制率和客观缓解率下降,但中位无进展生存期在所有治疗线中保持一致,范围在11至12个月之间(表3)。目前直接比较这一患者群体中不同治疗方法的研究有限,但其他回顾性队列研究的结果与我们的研究结果高度一致。
PACC是一种基因组多样的恶性肿瘤,在我们的队列中有大量患者存在体细胞和胚系突变。与先前研究一致,HR通路和RAF/BRAF改变最常见。这些体细胞改变与PDAC患者不同,PDAC中KRAS和TP53突变更为常见。最近发表的一项研究对纯PACC标本与大量PDAC样本进行了全外显子测序和NGS比较。研究显示,在PACC患者中,基因组杂合性缺失常与HR(包括BRCA1/BRCA2和PALB2)改变相关。相反,TP53、CDKN2A和KRAS突变更常见于PDAC患者。该研究还发现了BRAF V600E突变,但仅在2例PACC患者(3.8%)中发现,且这些患者无其他RAF改变,作者推测这一发现可能与仅纳入纯PACC患者病例有关。
除了体细胞突变,我们发现43%的PACC患者存在胚系突变,其中大多数(33%)发生在HR通路中。这一相对较高的发生率与最近一项针对49例PACC患者的研究结果一致,该研究发现37%的患者存在HR改变。这强调了对所有PACC患者进行普遍胚系检测的重要性,这与目前PDAC指南建议一致。
在我们的研究中,NGS检测为43%(n=9/21)的患者带来了治疗上的影响,包括BRAF/MEK抑制剂、免疫检查点抑制剂、PARP抑制剂和TRK抑制剂。因此,我们强调检测这些改变的重要性,因为美国食品药品监督管理局(FDA)已批准了泛实体瘤适应症:拉罗替尼用于NTRK基因融合,达拉非尼和曲美替尼用于BRAF突变肿瘤,帕博利珠单抗或多塔利单抗用于dMMR肿瘤。虽然目前HR改变尚无泛癌种适应症,但识别此类肿瘤对于全身治疗方案的选择很重要,因为它们对铂类药物敏感。
本研究存在局限性,最明显的是回顾性研究设计和较小的样本量,这使得无法对特定化疗方案或治疗策略进行有意义的比较。此外,由于使用的是市售检测的结果,体细胞和胚系NGS检测方法存在差异。然而,我们认为本研究在描述这种罕见疾病的临床特征和多样的分子特征方面,为PACC的文献做出了重要补充。
总之,PACC是一种罕见的恶性肿瘤,需要进一步研究以确定最佳治疗策略。目前,多学科方法对于治疗这些患者至关重要,尤其是在疾病早期。此外,应进行NGS检测,因为大量患者的肿瘤存在体细胞改变,有可能符合FDA批准的适应症。正如胰腺癌指南所建议的,鉴于PACC患者中胚系突变的高发生率,建议对所有PACC患者进行普遍胚系检测。
参考文献:
Eslinger C, Seddighzadeh B, Yee C, Elsabbagh Z, Pai R, Hartley C, Starr J, Bekaii-Saab T, Halfdanarson TR, Sonbol MB. Clinical Outcomes and Molecular Profiling of Pancreatic Acinar Cell Carcinoma: A Retrospective Study. JCO Precis Oncol. 2025 Jan;9:e2400450. doi: 10.1200/PO-24-00450. Epub 2025 Jan 7. PMID: 39772831; PMCID: PMC11706351.


本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言














签到学习
3
#分子特征# #胰腺腺泡细胞癌#
6