Allergy:新型单剂量屋尘螨免疫疗法或成哮喘与过敏性鼻炎治疗新选择
2025-04-06 liangying MedSci原创
新型单剂量递增方案在成人与青少年HDM过敏患者中展现出可接受的安全性,尽管局部反应略多,但严重AEs风险未增加。
屋尘螨(HDMs)是导致过敏性鼻炎和哮喘的重要过敏原,传统皮下免疫疗法(SCIT)需通过多阶段剂量递增实现耐受,但治疗周期长(通常需3年)且频繁就诊影响患者依从性。缩短剂量递增方案可能提高治疗可及性并降低脱落率,但需验证其安全性。本研究旨在评估一种新型单剂量(仅最高效价3)快速递增方案(6次注射)与传统多阶段递增方案(14次注射,覆盖3种效价)的安全性及耐受性,重点关注局部和全身不良反应发生率、年龄亚组差异及哮喘患者的风险,并探索免疫学应答指标(如特异性IgG4)的变化,为优化临床实践提供依据。

本研究为多中心、开放标签、随机对照II期试验(EudraCT 2020–004328–41),纳入德国和波兰12个中心的12-65岁HDM过敏患者(n=143),随机分为单剂量组(6次注射,效价3)或标准组(14次注射,效价1-3)。所有患者接受铝佐剂吸附的HDM SCIT产品(Novo-Helisen® Depot),剂量递增后维持最大推荐剂量(1.0 mL效价3)。主要终点为安全性,通过不良事件(AEs)报告和Likert量表评估耐受性。安全性分析集(SAF)包含142例患者(单剂量组75例,标准组67例),监测指标包括注射后120分钟内生命体征、肺功能(FEV1)及实验室参数。不良事件分类为局部、系统性或严重反应,采用MedDRA编码,并由独立数据安全监查委员会(DSMB)监督。亚组分析涵盖成人与青少年(≥12岁)、哮喘患者与非哮喘患者。
共142例患者完成治疗(单剂量组75例,标准组67例),平均年龄分别为33.4岁和31.5岁,哮喘患病率46.8%(成人)和49.2%(青少年)。单剂量组总体不良药物反应(ADRs)发生率显著高于标准组(54.7% vs. 49.3%,p=0.0457),但严重AEs无差异(单剂量组1例,标准组0例)。局部ADRs在单剂量组更常见(45.2% vs. 27.0%,p=0.0393),但多数为轻度(94.7%)。系统性ADRs发生率无显著差异(单剂量组14.3% vs. 标准组8.1%),无WAO 3级及以上反应。青少年亚组中,单剂量组ADRs比例略高(30.3% vs. 16.7%),但统计学差异不显著(p=0.2466)。哮喘患者中,两组ADRs发生率相近(单剂量组35.3% vs. 标准组26.5%)。免疫学指标显示,两组HDM特异性IgG4均显著升高(p<0.0001),但成人组标准方案提升幅度更大(p<0.05)。治疗期间,单剂量组因ADRs调整剂量的比例略高(7例 vs. 2例),但无统计学差异(p=0.172)。总体耐受性评估中,95%以上患者和研究者认为两种方案“良好”或“非常好”。
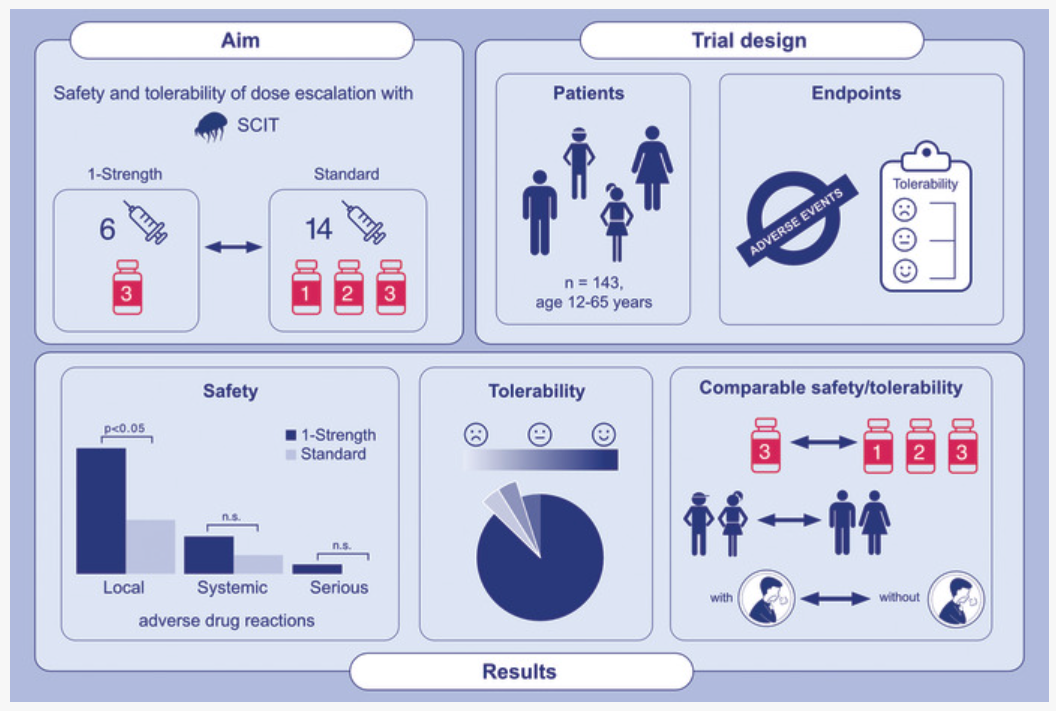
屋尘螨皮下免疫疗法新型单剂量递增方案的安全性与耐受性评估研究设计及主要研究结果
新型单剂量递增方案在成人与青少年HDM过敏患者中展现出可接受的安全性,尽管局部反应略多,但严重AEs风险未增加。其缩短疗程的优势可能提高患者依从性,为临床实践提供高效选择。然而,需进一步验证免疫学应答与长期疗效的关联,并扩大样本量以确认安全性。该方案已获德国批准,未来研究可探索其在其他人群及过敏原中的应用潜力。
原始出处:
Jutel M, Vogelberg C, Duwensee K, Troyke D, Klimek L. One-strength dose escalation of house dust mite depot product for subcutaneous immunotherapy is safe and tolerable. Allergy. 2025 Mar;80(3):807-816. doi: 10.1111/all.16370. Epub 2024 Nov 14. PMID: 39540587; PMCID: PMC11891436.

本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言









#屋尘螨过敏# #一种新型单剂量#
9