Nat Commun:利用cfDNA片段组监测癌症治疗的新方法DELFI-TF,无需肿瘤先验遗传信息即可确定肿瘤负荷!
2024-11-08 测序中国 测序中国 发表于上海
研究团队报道了新开发的肿瘤和突变非依赖性方法--DELFI-TF,这是一种基于机器学习的方法,能够利用低覆盖率全基因组测序(WGS)在不需要肿瘤先验遗传信息的情况下非侵入性地确定肿瘤负荷。
众所周知,癌症细胞的基因组和染色质特征不同于正常细胞。循环肿瘤DNA(ctDNA)已成为肿瘤检测和治疗监测的一个有效生物标志物。在整个治疗过程中监测ctDNA动态可以帮助医生及时了解治疗效果,调整治疗策略。
此前,有研究团队开发了DELFI检测方法,通过检测cfDNA来检测各种癌症并指出其起源组织。在Nature Communications近日发表的文章“Cancer treatment monitoring using cell-free DNA fragmentomes”中,荷兰癌症研究所联合Delfi Diagnostics公司团队评估了DELFI是否可以在监测疾病进展方面具有附加的临床价值。
癌症个体的ctDNA检测通常依赖于预先鉴定的肿瘤特异性突变。在该文章中,研究团队报道了新开发的肿瘤和突变非依赖性方法--DELFI-TF,这是一种基于机器学习的方法,能够利用低覆盖率全基因组测序(WGS)在不需要肿瘤先验遗传信息的情况下非侵入性地确定肿瘤负荷。验证结果表明,该方法能够通过检测cfDNA来检测癌症并指出其起源组织,并评估了其用于监测转移性结直肠癌(mCRC)患者和肺癌患者疾病状态和治疗反应的效用。

主要研究内容
利用全基因组cfDNA片段组图谱开发DELFI-TF模型
为了开发一种不依赖基因突变和肿瘤组织的方法,研究人员利用全基因组cfDNA片段组学数据来量化循环肿瘤负荷,分析了153例不能切除的肝脏局限性mCRC患者(79例KRAS/NRAS/BRAF突变型肿瘤患者和74例KRAS/NRAS/BRAF野生型肿瘤患者)的689份纵向血浆样本(治疗前和治疗中)。总体而言,在来自RAS/BRAF突变mCRC患者的309个样本中进行了肿瘤相关的cfDNA突变分析;在来自RAS/BRAF突变型和野生型肿瘤患者的689个样本中进行了DELFI-TF分析。与文库制备和WGS相关的DELFI-TF错误率<1%。对mCRC患者的片段化特征和臂位染色体变化的分析显示,绝大多数患者在基线以及与疾病进展相关的时间点的基因组中,这些特征都发生了显著变化。相比之下,在开始一线全身治疗后,在与疾病稳定或放射反应相关的时间点上,大多数患者样本与较少的片段组或基因组异常相关。以上发现表明,基于片段组的模型可能能够以非侵入性的方式实时识别全身性治疗反应。
为了研究cfDNA片段模式的来源,研究团队比较了CRC细胞和正常血细胞的全基因组片段组图谱和染色体构象捕获(Hi-C)开放(A)和封闭(B)区室。分析发现,来自CRC个体的cfDNA片段代表了来自外周血以及来自CRC细胞的染色质区室的cfDNA图谱的混合物。
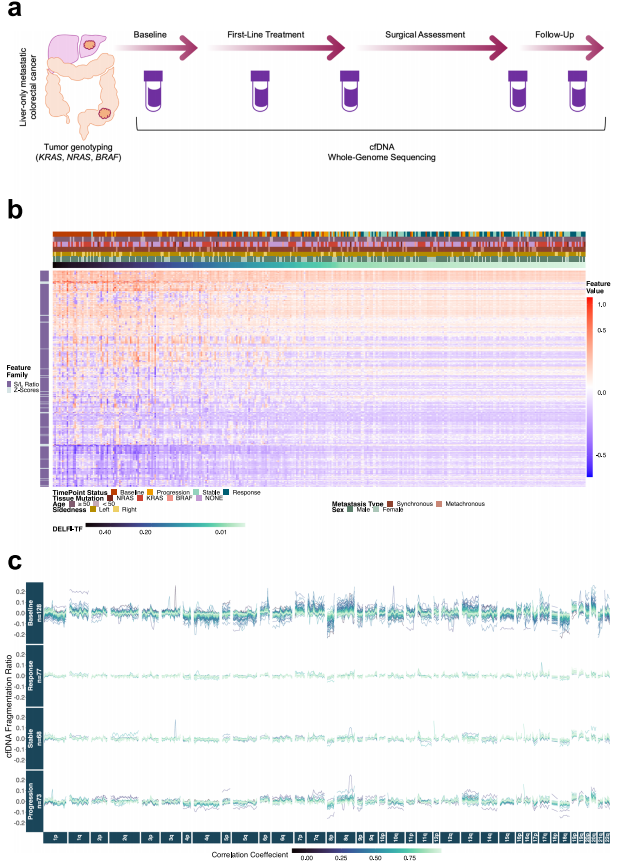
图1. DELFI-TF可作为一种不依赖突变的肿瘤监测方法
DELFI-TF准确反映ctDNA突变等位基因频率和拷贝数的变化
随后,研究团队在该大型队列中评估了来自相同样本的突变水平和全基因组片段化特征,以开发基于片段组学的方法来量化循环肿瘤部分(图2a)。对于来自RAS/BRAF突变肿瘤患者的所有血浆样本(n = 309),使用ddPCR、低覆盖率全基因组测序分别获取了cfDNA肿瘤负荷和片段组特征。将随机森林回归模型用于预测具有RAS/BRAF突变的纵向cfDNA样本的肿瘤特异性突变等位基因频率(MAF)。
研究团队使用DELFI-TF评估了mCRC患者的DELFI-TF评分,以及来自丹麦已有报道的筛查队列中的非癌症个体(图2b)。结果发现,mCRC患者队列基线样本的DELFI-TF评分中位数为25%,来自非癌症个体样本的DELFI-TF评分接近于零(0.09%)(图2b)。在开始治疗后的第一个时间点,DELFI-TF水平与基线样本相比显著降低,但仍显著高于非癌症样本。为了独立验证DELFI-TF方法,研究使用该模型分析了mCRC患者队列中RAS/BRAF野生型患者所有血浆样本的全基因组序列谱,在临床组中观察到相似的评分分布。
此外,研究数据还表明,在较低MAF水平时,DELFI-TF与MAF值仍然显著相关,但ichorCNA与MAF值不相关;即使在用ichorCNA方法无法检测到突变的情况下,DELFI-TF也能检测到ctDNA。对mCRC血浆中拷贝数改变的两个基因(MBD1和PLGC1)的分析显示,DELFI-TF或ddPCR肿瘤分数与cfDNA中这些区域的拷贝数比率之间存在高度相关性。以上结果表明,DELFI-TF能够通过检测cfDNA中癌症特异性突变或拷贝数畸变来准确捕获ctDNA片段。
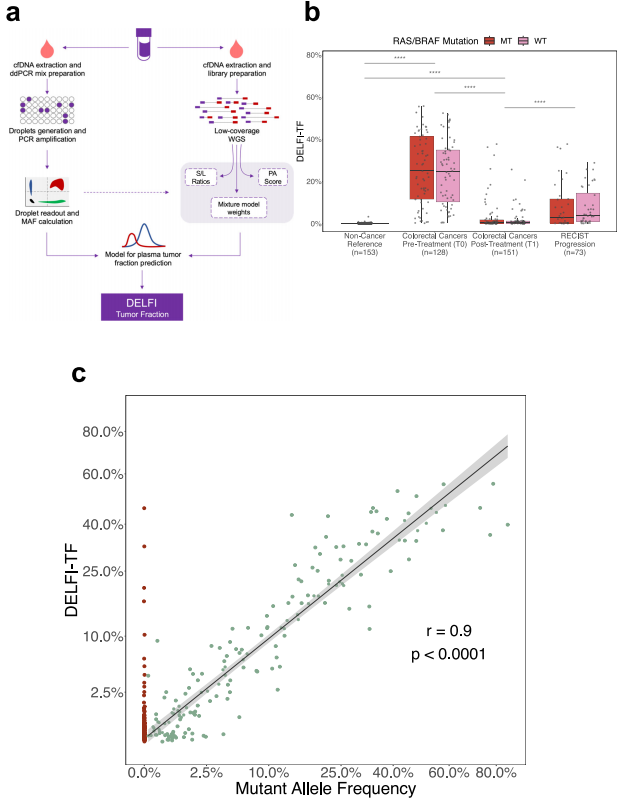
图2. DELFI-TF能够准确预测mCRC患者cfDNA肿瘤负荷
基线DELFI-TF与临床特征和结果的关系
接下来,研究比较了DELFI-TF获得的肿瘤负荷分子检测值与在mCRC队列中观察到的患者临床特征。结果表明,基线DELFI-TF和ddPCR检测到的MAF值预测了影像学评估的后续临床反应,完全缓解或部分缓解患者的DELFI-TF或MAF评分明显低于疾病进展或疾病稳定患者。与同步转移性疾病相比,异时性转移患者的DELFI-TF较低。
此外,基线时DELFI-TF值在第一个四分位数的患者比其他患者的中位总生存期(OS)和无进展生存期(PFS)更长。基于MAF分析的OS和PFS生存曲线与DELFI-TF非常相似。多变量分析模型也显示,基线时的DELFI-TF评分是预后的重要预测因子。
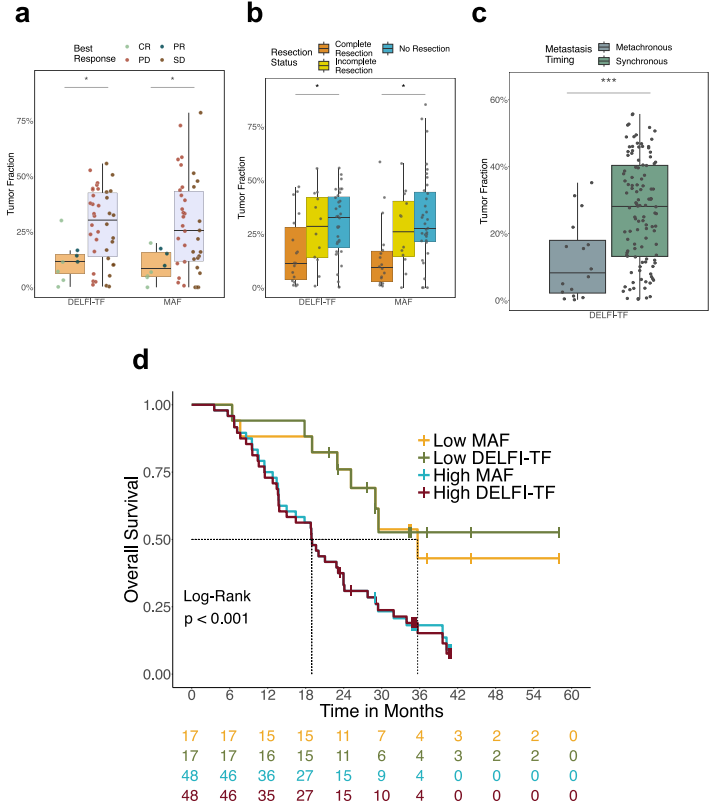
图3. DELFI-TF可作为疾病负荷、全身治疗反应和预后结果的非侵入性生物标志物
DELFI-TF在治疗过程中的动态变化和患者预后
最后,通过对治疗开始前DELFI-TF的分析,研究人员进一步探讨了该生物标志物的动态变化是否能反映治疗过程中的治疗反应。结果发现,在整个治疗过程中,DELFI-TF斜率低于中位数的患者有更高的客观放射反应率。在整个研究人群中,DELFI-TF斜率低于中位数的患者的PFS更长;在经历持久临床获益的患者中,客观缓解或病情稳定超过12个月。同样,DELFI-TF斜率低于中位数的患者OS也明显更长。
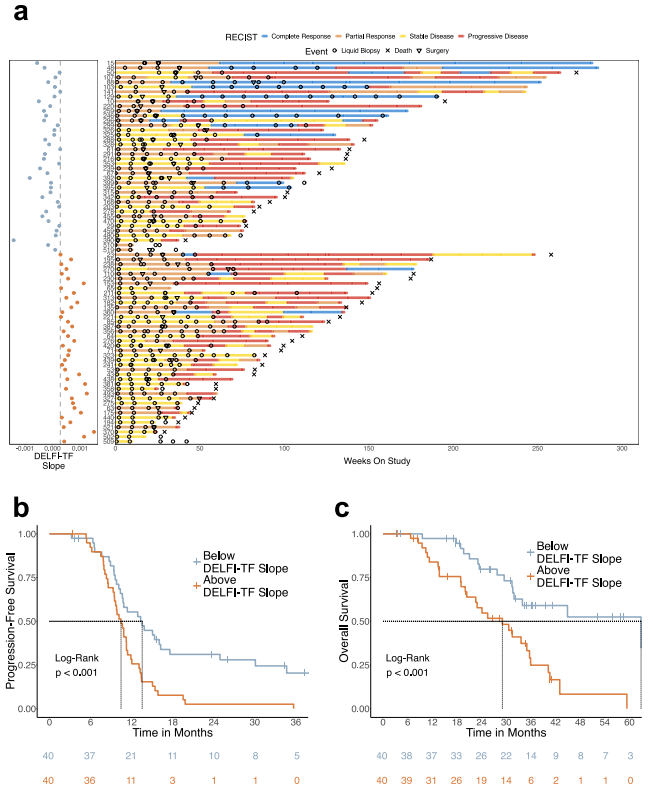
图4. DELFI-TF的动态变化与CRC患者的纵向临床结果相关
结 语
该研究报道了新方法DELFI-TF,这是一种旨在定量检测肿瘤负荷的片段组学方法,并证明了其在不需要检测肿瘤组织突变的情况下对癌症患者进行纵向疾病监测的潜力。研究结果表明,DELFI-TF在监测治疗方面比传统临床方法更敏感。在基线和治疗开始后,DELFI-TF预测PFS和OS优于影像学检查。DELFI-TF更准确地代表了MAF水平可能范围内的肿瘤负荷。
由于DELFI-TF不需要预先了解癌症基因突变的变化,因此它可以适用于来自其他癌症类型患者的样本。研究团队在肺癌中的验证分析和一项在晚期癌症患者(包括乳腺癌和其他癌症类型)中的免疫检查点阻断分析中强调了这种能力。使用DELFI-TF识别治疗反应或疾病进展可为调整患者的治疗方案和改善患者的预后提供科学指导。
论文原文
van ’t Erve, I., Alipanahi, B., Lumbard, K. et al. Cancer treatment monitoring using cell-free DNA fragmentomes. Nat Commun 15, 8801 (2024). https://www.nature.com/articles/s41467-024-53017-7
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言












#肿瘤负荷# #cfDNA#
27