主动脉瓣疾病、经导管主动脉瓣置换术和心力衰竭患者:最新进展综述
2025-01-03 我爱瓣膜 我爱瓣膜 发表于陕西省
心衰中主动脉瓣狭窄情况复杂,介绍了 TAVR 应用、不同类型 AS 治疗,及合并病、TAVR 前后要点,强调多手段管理,相关试验正探索最佳实践。
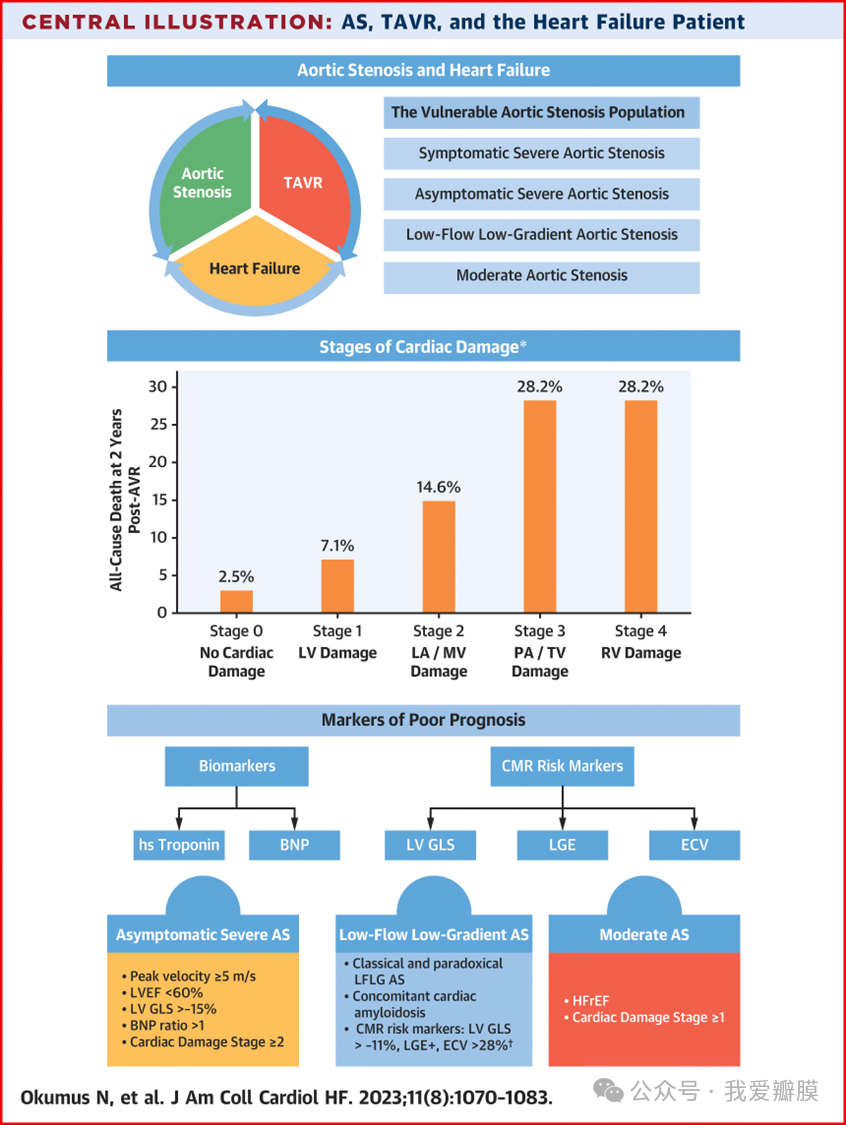
心力衰竭 (HF) 中同时存在的主动脉瓣狭窄 (AS) 与高死亡率和发病率相关。目前的指南建议对有严重症状的 AS 患者和左心室射血分数 <50% 的无症状 AS 患者以及其他心脏手术期间进行主动脉瓣置换术。经导管主动脉瓣置换术 (TAVR) 现已可用于治疗以前无法手术或手术风险高的严重 AS 患者。利用多模态成像技术越来越多地被认识到可以加强早期干预的理由,从而降低持续进展为晚期 HF 的风险。越来越多的数据支持在不同临床情况下进行 TAVR,尤其是无症状 AS 和中度 AS。然而,关于干预前后 HF 药物治疗的优势的信息有限。本综述旨在全面研究 HF 进展背景下的 AS 表型,同时探索 TAVR 在特定人群中不断发展的作用。
亮点
|
• |
对于出现症状或左心室功能障碍的严重 AS,建议采用 AVR。 |
||||
|
• |
TAVR 为不同患者群体的 AS 管理提供了新的见解。 |
||||
|
• |
正在进行的试验正在调查 TAVR 后使用 GDMT 的益处,以解决术后残留风险。 |
||||
|
• |
心脏损伤分期可确定脆弱患者中早期 AS 干预的 TAVR 候选人。 |
||||
心力衰竭 (HF) 和主动脉瓣狭窄 (AS) 同时发生是一种具有挑战性的临床情况,因为这些情况表现出双向因果关系。由于后负荷增加和代偿性心脏重塑的结合,患有 AS 的患者会患上 HF,这会带来很高的死亡风险。尽管前向阻抗增加,心输出量最初可以维持,但随后压力超负荷引起的左心室 (LV) 肥大会导致舒张充盈受损,最终导致每搏输出量减少。相反,患有 HF 的患者可能会发展为进行性 AS。这些患者的结果可能与患有孤立性瓣膜疾病的患者不同。冠状动脉疾病的共存会进一步影响结果。心脏成像技术的进步和经导管主动脉瓣置换术 (TAVR) 技术的广泛应用,为之前被认为手术风险高或无法手术的 AS 患者带来了一个改善预后的时代。从左心室肥大和功能障碍的初始阶段,到左心房损伤、肺动脉高压,最后到右心室功能障碍,瓣外损伤在 AS 进展中的重要性引发了关于无症状 AS 或有症状中度 AS 患者最佳治疗的讨论,包括早期主动脉瓣置换术 (AVR) 与药物治疗。我们回顾了 AS 心力衰竭患者治疗的当代数据和持续进展。
患者选择:确定适合 TAVR 的患者
TAVR 的当前适应症
2020 年 ACC/AHA(美国心脏病学会/美国心脏协会)指南推荐将 AVR 作为 I 类适应症,适用于左心室射血分数 (LVEF) <50% 的严重症状性 AS 和严重无症状 AS 患者(图 1)。与球囊瓣膜成形术等标准药物治疗相比,TAVR 在 1 年时具有显著的死亡率优势,已成为先前被认为无法手术的患者的可靠治疗选择。针对高危患者(平均 STS [胸外科医师协会] 评分范围为 7% 至 11%)以及随后针对中危和低危患者(平均 STS 评分范围为 2.9% 至 5.8%)进行的大量具有里程碑意义的试验均显示,SAVR 和 TAVR 之间的死亡率相似。值得注意的是,Siontis 等人在他们的荟萃分析中表明,在所有手术风险组中,TAVR 在 2 年全因死亡率和中风方面均优于 SAVR。
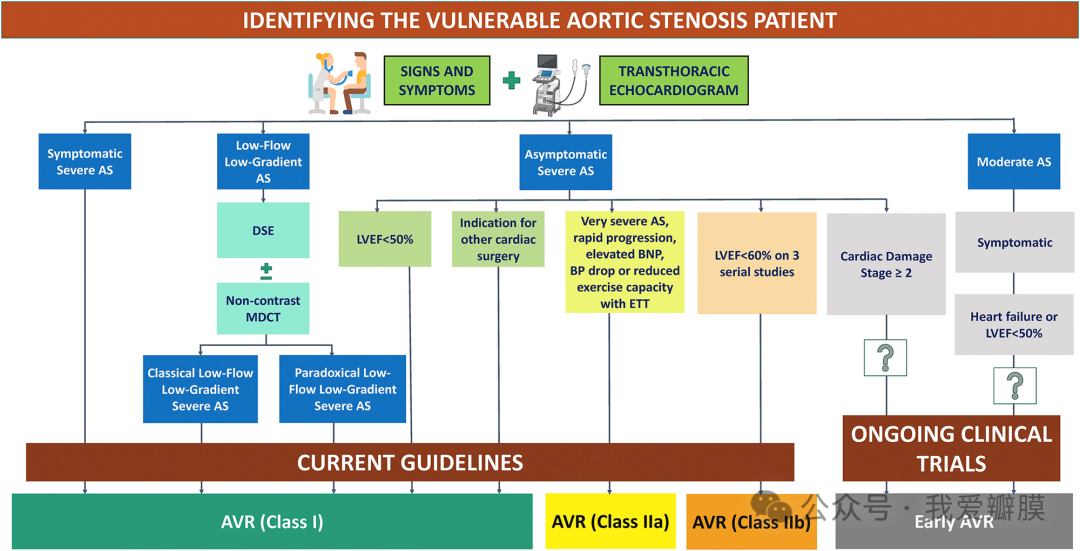
评估患有强直性脊柱炎的心力衰竭患者的诊断注意事项
根据心脏损伤程度对主动脉瓣狭窄 (AS) 进行分期分类。AVR = 主动脉瓣置换术;BNP = B 型利钠肽;BP =血压;DSE = 多巴酚丁胺负荷超声心动图;ETT = 运动平板试验;LVEF = 左心室射血分数;MDCT = 多层探测器计算机断层扫描。
由于缺乏大量低风险至中等风险患者接受 TAVR 的长期(7-8 年以上)数据,SAVR 仍然是 65 岁以下或预期寿命 ≥20 年的患者的首选干预措施。为了解决对 TAVR 瓣膜耐久性的担忧,Pibarot 等人显示,与 SAVR 相比,第三代 SAPIEN 3 球囊扩张瓣膜在 5 年时的结构性瓣膜恶化率相似。此外,NOTION(北欧主动脉瓣干预试验)的 8 年随访结果显示,与 TAVR 相比,SAVR 的结构性瓣膜恶化率更高(28.3% vs 13.9%;P = 0.0017)。低风险试验(尤其是新一代 TAVR 瓣膜)的短期至中期结果令人鼓舞PARTNER-3 2 年数据,以及最近发布的 3 年 Evolut 低风险数据),但仍然需要包括瓣中瓣 TAVR 和整体耐用性在内的扩展数据。
心脏损伤分期
目前的指南根据超声心动图检查结果、侵入性血流动力学检查结果、症状和左心室功能障碍对 AS 进行分类。重度 AS 的现行标准(平均压差 > 40 mm Hg、最大主动脉喷射速度 > 4.0 m/s 和主动脉瓣面积 < 1.0 cm 2)存在某些局限性。
首先,由于压力恢复现象,这些用于超声心动图和导管数据的值可能有所不同。
其次,根据 Gorlin 公式(以正常流速计算),40 mm Hg 的平均压差对应于 0.8 cm 2的主动脉面积,而 1 cm 2的主动脉瓣面积导致平均压差在 30 到 35 mm Hg 之间,因此当计算出的主动脉瓣面积在 0.8 到 1.0 cm 2之间时就会出现困境。
第三,多普勒速度指数截点 0.25 与平均梯度 50 毫米汞柱和主动脉瓣面积 0.8 平方厘米相关。鉴于定义严重 AS 的标准与这些指标之间存在差异,0.30 被认为是更合适的截点。
最后严重降低的动脉顺应性以及未控制的高血压也会改变 AS 评估期间的血流动力学测量。
一旦被认为严重,AS 将根据 HF 症状、LVEF 和手术风险进一步分期。Généreux 等人将心脏损伤分为 5 个阶段,并使用更广泛的超声心动图评估心脏重塑的程度和瓣膜反流、心房颤动和/或右心室功能障碍所反映的向后衰竭证据。心脏损伤的每个阶段,死亡率都会增加约 45 %。此外,这些阶段与 AVR 后 1 年随访中的心血管死亡和再入院独立相关,并且是独立于 STS 评分的最强死亡率预测因素之一。与没有变化或恶化的患者相比,TAVR 后基线阶段的改善也与堪萨斯城心肌病问卷总评分的显著改善相关(+26.8 [95% CI: 24.2-29.4]; P < 0.0001)。因此,在整体评估过程中应考虑基线心脏损伤。由于 50% 的 4 期患者仍处于同一阶段,且 28.2% 的 4 期患者在 TAVR 后 2 年死亡,因此对于无症状但有明显心脏损伤的患者或 AS 仍处于中度范围时是否应尽早进行 AVR,目前仍存在争议。

根据心脏损伤程度对 AS 进行心脏分层
根据心脏损伤程度对主动脉瓣狭窄进行分期分类。经 Généreux 等人许可转载。 LA = 左心房;LV = 左心室;RV = 右心室;
心肌纤维化是 AS 患者易患 HF 的指标
在接受 AVR 治疗的患者中,有三分之一的患者出现心肌纤维化,这与长期不良预后有关,与 AVR 后 LV 功能和症状的改善呈负相关。整体纵向应变、严重的 LV 肥大和心肌纤维化是无症状严重 AS 患者风险增加的指标。心脏磁共振是量化心肌纤维化的可靠方法,而整体纵向应变可作为评估这些患者的一种广泛使用的替代方法。因此,多模态成像可能有助于在不可逆的结构损伤之前识别出可从 AVR 中受益的患者。
低压差主动脉瓣置换术
低流量、低梯度 (LFLG) AS 定义为主动脉瓣面积 <1.0 cm 2且平均梯度 <40 mm Hg,且每搏输出量指数 <35 mL/m 2。Eleid 等人 的研究表明,每搏输出量指数 <43 mL/m 2时死亡率显著增加,随后死亡率的影响逐渐增加,且在每搏输出量指数低于 35 mL/m 2时更为显著。有趣的是,已提出针对性别的截断值(女性 <32 mL/m 2和男性<40 mL/m 2 )用于预测。也可以根据平均跨瓣流速来定义低流量,截断值为 <210 mL/ s。
低剂量多巴酚丁胺负荷超声心动图可以识别患有严重 AS 的 HF 患者,严重 AS 的定义是,在任何多巴酚丁胺剂量下,平均梯度 >40 毫米汞柱,主动脉瓣面积 <1 平方厘米。TOPAS登记处有 50% 的患者报告 LFLG AS 分级不一致,LVEF 低。对于 LFLG 患者,LVEF 降低或正常,当严重 AS 诊断不明确时,建议进行主动脉瓣钙化评分评估,Agatston 评分阈值截止值为女性 1,300,男性 2,000。
低流量是 AS 患者死亡率增加的独立危险因素。这些 LFLG 患者缺乏收缩储备(多巴酚丁胺负荷超声心动图检查时实际每搏输出量未能增加 20% 以上)是否与不良结果有关仍不清楚。在 LFLG 和 LVEF ≤40% 且未显示收缩储备的患者中,与保守治疗相比,SAVR 可提高 5 年生存率(54% vs 13%;P = 0.001),尽管手术死亡率为 22%。22相比之下,TOPAS-TAVI 注册研究显示,接受 TAVR 的经典 LFLG AS 患者预后良好,30 天生存率更高,2 年随访生存率更高,为 67.7%。TAVR 后,LVEF 平均增加 8.3%,与较低的基线 LVEF 和每搏输出量指数呈正相关。有趣的是,收缩血流储备与临床结果之间没有显著关联。
迄今为止,区分矛盾性 LFLG 与中度 AS 仍然具有挑战性。虽然矛盾性 LFLG AS 的预后比高梯度严重 AS 更差,但 TAVR 后两组的结果相似。此外,与 AVR 后的高梯度 AS 相比,这些患者的每搏输出量指数改善更大,N 端前 B 型利钠肽 (NT-proBNP) 显著减少,症状缓解。
目前的指南建议将 AVR 作为经典 LFLG AS 和矛盾性 LFLG AS 的 I 类适应症(如果 AVR 被认为是症状的潜在原因),但未指定干预措施的选择。经典 LFLG AS 可被视为伴有射血分数降低的 HF 的严重 AS,而矛盾性 LFLG AS 可被视为伴有射血分数保留的 HF 的 AS。考虑到这些脆弱的 HF 患者中其他合并症的发病率较高,TAVR 可能是一种更安全的选择,但需要进一步试验比较该人群中 SAVR 和 TAVR 的结果。
正常流量、低压差 AS 且 EF 保留很常见,是一类可能出现 HF 的异质性患者。这一现象目前首次被作为一个独特类别纳入欧洲心脏病学会/欧洲心胸外科协会 (ESC/EACTS) 心脏瓣膜病管理指南。对于正常流量、低压差患者,务必验证测量结果的准确性;计算跨瓣流速,因为尽管每搏输出量正常,但还是会导致低压差;仔细评估是否有症状;并使用多巴酚丁胺负荷超声心动图和多层探测器计算机断层扫描等其他方式来确定 AS 的严重程度。迄今为止,两项荟萃分析显示,正常流量、低压差 AS 与较差的预后相关,而 AVR 可显著改善预后。考虑到该组的异质性以及有限的数据,需要采用多学科多参数方法来确定 AVR 的益处。
中度主动脉瓣莫狭窄
中度 AS 的死亡风险高于无 AS 或轻度 AS,但仅略低于重度 AS。与 LVEF 正常的患者相比,患有 HF 和 LV 功能障碍的中度 AS 患者的死亡风险更高(每 100 人年 16.5 比 4.2)。此外,对于 LV 功能障碍患者,中度 AS 与死亡率和 HF 住院率增加有关。目前,SAVR 被推荐为接受其他适应症心脏手术的中度 AS 患者的 IIb 类适应症。在一小部分患者中,TAVR 与 LV 功能障碍的中度 AS 患者死亡率的改善有关,而在接受 SAVR 的患者中并未看到这种好处。鉴于最近的数据显示中度 AS 患者的死亡率增加,特别是当整体纵向应变受损、NT-proBNP 升高和瓣膜外心脏损伤等因素导致预后更差时,人们对对该人群进行早期干预的兴趣日益浓厚,特别是考虑到 TAVR 对广大患者的风险状况良好。正在进行的试验结果将为我们未来几年对这些患者的决策提供参考。
主动脉瓣关闭不全
在 70 至 83 岁的患者中,约 2% 患有中度或更严重的主动脉瓣关闭不全。无论症状如何,慢性 AR都可能因容量和压力超负荷而导致不良的、甚至不可逆的 LV 重塑。对于无症状或仅有轻微症状的 3 至 4 级 AI 患者,基于心脏磁共振的容积评估有助于确定 LV 收缩末期容积指数为 45 mL/m 2或更大以及主动脉瓣反流分数≥32% 是死亡和发生 HF 的风险标志物。目前,孤立性 AR的首选治疗方法是 SAVR。TAVR 很少用于孤立性 AR 患者,主要原因是在没有显著的原生主动脉瓣钙化的情况下瓣膜锚定存在相关挑战,常伴有主动脉根部和升主动脉扩张,以及收缩期跨瓣膜的每搏输出量增加。术后风险包括瓣膜位置不当、栓塞和严重瓣周漏。在 AR诊断后的 10 年随访中,HF 很常见(23 ± 4%),且与随后的过高死亡率(每年 10%-20%)相关。多达8 %的符合手术干预标准的 AR患者未接受治疗。因此,对于患有严重 AR且手术风险高的患者,需要一种可行且安全的经导管治疗方法。两种专用的经导管瓣膜正在接受用于治疗严重 AI 的研究。当前可用的 TAVR 设备已被用于治疗严重 AR。尽管最近对 911 名接受 TAVR 纯 AR治疗的患者的荟萃分析显示 30 天内全因死亡率较高 (9.5%),但与早期设备相比,使用新一代设备的成功率显著提高,术后并发症发生率降低。
观察性研究支持 TAVR 作为生物瓣膜手术失败后 AI 的治疗选择。与AS 的 TAVR 相比,孤立性 AR 的 TAVR 效果总体较差。通过仔细选择患者,结合术前计算机断层扫描成像、在部署过程中使用快速起搏以减少每搏输出量和瓣膜运动以及将装置尺寸增大 15% 至 20%,使用现有装置的 TAVR 可为不适合手术的候选人提供满意的结果。38需要进行随机对照试验来确定 TAVR 作为孤立性 AR的安全有效治疗选择。
HF-AS 患者的其他诊断和治疗注意事项
利钠肽
利钠肽升高的存在可以告知与 HF 相关的潜在心肌压力或损伤程度。AS 引起的压力超负荷会导致 LV 壁应力增加,从而引起利钠肽水平升高。研究表明,利钠肽可用于预测无症状重度 AS 患者的症状发作。 LV肥大的程度也与利钠肽水平相关,LV 质量指数增加 2 倍时,利钠肽水平增加 6 倍。它还可以作为预测 TAVR 后症状反应的有用预后标志物。低(<800 mg/L)和非常高(>10,000 ng/L)NT-proBNP 水平与 TAVR 后 1 年症状无改善相关,分别表明 HF 症状的其他原因或不可逆的心室损伤。
连续测量利钠肽可能有助于及早发现从代偿性左心室肥大到左心室失代偿的不良转变。49研究表明,利钠肽可预测 AVR 前后 AS 患者的死亡率。Clavel 等人表明,B 型利钠肽 (BNP) 比率(根据年龄特异性正常水平调整的 BNP 水平)的增量升高与 AS 患者的生存率呈负相关。在一项对 3,391 名接受 TAVR 的患者的研究中,发现出院时、TAVR 后 30 天和 1 年的利钠肽水平升高与死亡率和再住院率的增加独立相关。52因此,利钠肽可作为替代标记,帮助识别无症状重度 AS 患者、可能受益于干预的中度 AS 患者以及患有瓣周漏的 TAVR 接受者。
球囊主动脉瓣成形术
在TAVR时代之前,球囊主动脉瓣成形术是治疗手术风险高或过高的 AS 患者的重要手段。鉴于这些患者 TAVR 的良好结果,球囊主动脉瓣成形术的作用已经发生了变化。目前的指南建议将球囊主动脉瓣成形术作为危重患者 TAVR 或 SAVR 的桥梁。在一项前瞻性研究中, 100名重度 AS 患者(平均 STS 评分为 11.4%)接受球囊主动脉瓣成形术作为决策、确定性治疗或姑息治疗的桥梁,在 30 天的随访中死亡率为 6%。在接受确定性治疗的患者中,1 年死亡率为 11.1%。值得注意的是,在球囊主动脉瓣成形术后不适合接受确定性治疗的患者中,死亡率为 73.7%。因此,球囊主动脉瓣成形术在确定性治疗之前仍可能是一种有用的工具,可用于优化高风险患者的治疗方案,并有助于确定哪些患者在 TAVR 后症状可能会改善。
患有 AS 的特殊 HF 人群
心脏淀粉样变性和 AS
约 1/8 接受 TAVR 的 AS 患者同时患有心脏淀粉样变性。54转甲状腺素蛋白淀粉样变性是与 AS 相关的最常见的心脏淀粉样变性。轻链型心脏淀粉样变性是由浆细胞病引起的轻链积聚引起的,在 AS 患者中很少见。55腕管综合征、腰椎管狭窄症和不成比例的 HF 症状和升高的利钠肽水平病史,以及传导异常和与 LV 壁厚不成比例的低电压和/或经典或矛盾的 LFLG AS 的超声心动图证据,应怀疑潜在的转甲状腺素蛋白淀粉样变性。多巴酚丁胺负荷超声心动图通常用于评估 LFLG AS,由于无法增加转甲状腺素蛋白淀粉样变性患者的潜在心肌病导致的每搏输出量,因此可能显示不确定的结果。或者,可以考虑使用心脏计算机断层扫描量化主动脉瓣钙化负担来评估严重程度,尽管有报道称重度 AS 和心脏淀粉样变性患者的主动脉钙化评分低于阈值。55、56 AS和心脏淀粉样变性患者接受 AVR 后,死亡率和功能状态等结果较差。
规模较小但效力不足的研究表明,与 SAVR 相比,TAVR 的结果可能更好。TAVR 对心脏淀粉样变性患者既能有效缓解症状,又安全。57根据我们的经验,心脏淀粉样变性患者对快速起搏的耐受性较差,通常导致低血压,并且在植入后更需要正性肌力药物或机械循环支持。特别注意瓣膜的选择和植入技术可以帮助最大限度地减少快速起搏的需要。心脏团队应考虑提示 AVR 无效的情况,例如 LV 功能严重受损、整体纵向应变严重降低、限制性模式、多种合并症和虚弱。58预防传导和节律障碍、维持较高心率、在房性心律失常存在时进行抗凝、适当时使用利尿剂以及停用 β 受体阻滞剂和钙通道阻滞剂是心脏淀粉样变性患者医疗管理的关键组成部分。55在具有心脏淀粉样变性“危险信号”的 AS 患者中筛查心脏淀粉样变性将有助于尽早开始转甲状腺素蛋白稳定疗法,即他法米迪,从而延缓疾病进展。
肥厚性心肌病和 AS
伴有肥厚性心肌病的 AS 在治疗上面临独特的挑战。肥厚性心肌病患者接受 TAVR 可导致后负荷急剧下降,从而导致动态瓣下流出道阻塞和血流动力学崩溃。DiMeglio 等人 的研究表明,与未患肥厚性心肌病的患者相比,接受 TAVR 的肥厚性心肌病患者发生不良心血管事件、住院死亡率和心源性休克的几率更高。值得注意的是,在最初的心源性休克中幸存下来的患者在长期内预后良好。可能需要进行侵入性血流动力学研究来确定 AS 的严重程度和动态流出道阻塞的程度。应主要考虑手术心肌切除术和 SAVR,因为这可以对两个级别的阻塞进行确定性治疗。对于手术风险高的患者,建议采用酒精消融室间隔的替代方法,然后在 2 至 3 个月内重新评估梯度后进行 TAVR。我们的经验表明,合理的方法可能是初始联合进行酒精室间隔消融和球囊主动脉瓣成形术,以促进 LV 适应后负荷变化,然后在后期进行 TAVR。
二尖瓣主动脉瓣狭窄
患有严重 AS 的二尖瓣主动脉瓣患者表现出明显的 LV 重塑,这意味着与三尖瓣主动脉瓣患者相比,AVR 后 HF 入院率更高。尽管与 AVR 之前患有三尖瓣主动脉瓣的患者相比,二尖瓣狭窄患者的 LVEF 较低,但回顾性数据表明,两组的 AVR 后生存结果相似。识别有风险的患者(左心室质量较高、左心室整体纵向应变较低)可能有助于识别那些在左心室功能障碍发生之前需要早期干预的患者。二尖瓣AS 对 TAVR 提出了独特的技术挑战,因为其钙化更严重,通常延伸到左心室流出道和非圆形环。在中度和高度手术风险的患者中,瓣周漏和中风的发生率增加。观察性登记数据表明,接受 TAVR 治疗的二尖瓣和三尖瓣 AS 的低手术风险患者在 1 年时死亡率或中风率无显著差异。然而,由于缺乏随机数据,TAVR 在该患者群体中的效用仍不清楚。
HF-AS 患者合并心脏瓣膜疾病的 TAVR
二尖瓣反流是 HF-AS 中最常见的心脏瓣膜疾病。其患病率为 11.5% 至 36.8% 之间,并且与 AVR 后死亡率增加有关。一项系统评价显示,大约 50% 的至少有中度二尖瓣反流的患者在接受 TAVR 后二尖瓣反流严重程度有所改善。据报道,约 50% 的伴随二尖瓣反流患者为功能性二尖瓣反流,在 TAVR 后有所改善。与二尖瓣反流改善相关的因素包括左心室功能障碍、无心房颤动和肺动脉高压。一项登记研究调查了 TAVR 后持续存在严重二尖瓣反流的患者后续二尖瓣干预措施(主要是经导管边对边二尖瓣修复)的结果,3 年死亡率为 29%。虽然统计学上并不显著,但分期二尖瓣介入治疗与药物治疗相比,死亡率更低(57.5% vs 30.8%;P = 0.05)。
过去十年, TAVR 广泛使用而未同时治疗先前存在的严重二尖瓣反流,这增加了随后或同时进行二尖瓣反流经皮治疗的潜在需求。如果没有 LVEF 降低、功能性二尖瓣反流、无心房颤动或肺动脉高压等有利特征,则可以考虑同时进行 TAVR 和经皮二尖瓣介入治疗,因为二尖瓣反流严重程度改善的可能性较低。
严重二尖瓣狭窄是严重 AS 患者死亡率和 HF 住院率增加的独立风险因素。据报道,接受 TAVR 的患者中有 2.7% 患有此病。在同时患有 AS 和二尖瓣狭窄的情况下,首先治疗二尖瓣狭窄需要谨慎,因为这会导致严重的肺水肿,这是由于腔体较小、通过狭窄主动脉瓣的流量较低,导致 LV 的前负荷突然增加所致。鉴于长期死亡率高,对于不适合手术的患者,可以考虑在 TAVR 期间或之后进行经皮介入治疗。二尖瓣球囊瓣膜成形术是治疗风湿性二尖瓣狭窄的可行选择。然而,严重的二尖瓣环钙化是大多数二尖瓣狭窄患者的潜在病因。虽然案例研究和早期可行性研究已经报告了经导管二尖瓣植入术,但仍需要更大规模的研究。
11% 至 27% 接受 TAVR 的患者报告有严重三尖瓣反流。Généreux 等人显示在 2 年随访期结束时,包括中度至重度三尖瓣反流在内的 3 期心脏损伤的死亡率为 28.2%。在一项对 9 项研究的荟萃分析中,基线时中度至重度三尖瓣反流与 TAVR 后死亡率增加有关。值得注意的是,15% 至 60% 的病例在 TAVR 后三尖瓣反流得到改善。最近发表的 TRILUMINATE Pivotal(三尖瓣反流患者的经导管修复)试验测试了经导管边对边修复三尖瓣,结果显示重度三尖瓣反流患者的症状得到改善。对于严重三尖瓣反流且在 TAVR 后症状持续的患者,经导管修复可能是一种选择。正在进行的经皮三尖瓣介入试验将为该领域的死亡率和症状缓解提供重要见解。
HF-AS 患者考虑移植/LVAD 与 AVR
严重左心室功能障碍与严重主动脉瓣关闭不全共存,可能导致患者在选择 AVR 还是心脏移植时面临抉择。目前还没有一对一的比较研究来解决这个问题。数据表明,对于患有严重主动脉瓣关闭不全、严重左心室功能障碍且同时存在冠状动脉疾病(需要 3 次或更多次旁路移植术或有心肌梗死病史)的患者,心脏移植可能是一个合适的考虑因素。71相反,患有严重主动脉瓣关闭不全、严重左心室功能障碍且无冠状动脉疾病的患者,其预后与心脏移植相当或更好,其中一些患者可能通过 SAVR 实现左心室恢复。
LVAD 植入后 TAVR 用于 AI
在接受 LVAD 植入的晚期HF患者中,15% 至 52% 可能会随着时间的推移发展为 AI。72同时进行 LV 减压以及 AV 上方更高的恒定压力会导致跨瓣膜梯度增加、瓣膜接合处融合和进行性 AI。对于已有中度或更严重 AI 的患者,建议在植入 LVAD 时进行术中同期手术修复。 INTERMACS (当代左心室辅助装置支持期间的主动脉瓣关闭不全:INTERMACS 注册表分析)注册分析发现,该人群中中度至重度 AI 发展与血流动力学恶化、再入院和死亡的高风险相关。可以尝试采用指南指导的药物治疗 (GDMT) 和 LVAD 速度调整进行初步治疗;然而,最终可能需要通过 AV 关闭、修复或生物瓣膜置换来手术纠正轻度以上的 AI。来自全国住院患者样本的数据表明,与 SAVR 相比,在 LVAD 植入后接受 TAVR 的患者发生住院死亡、中风、短暂性脑缺血发作、心肌梗死、起搏器植入、需要开放式 AV 手术、血管并发症和心脏压塞的几率明显较低。这些患者使用 TAVR 可能会并发瓣膜血栓形成、关闭、栓塞和复发性瓣尖融合。
TAVR 前的预防和最佳医疗管理
TAVR 后一年内住院的最常见原因无疑是心力衰竭,尽管住院率与 TAVR 前相比显著降低。 TAVR后一年,39% 的患者仍然经历不良预后,尽管死亡率和生活质量随时间推移而下降。由于心脏重塑和功能障碍,AS 可驱动和诱发临床心力衰竭,即使在 AVR 后也可能不可逆,并显著增加死亡率和发病率。一项对 77,745 名患者的荟萃分析发现,糖尿病史、慢性肾病、AF、慢性肺部疾病和高 STS 评分是 TAVR 后心力衰竭住院率增加的风险因素。77积极管理合并症的风险可能会改善 TAVR 后的结果。基线左心室肥大的程度与 TAVR 后 5 年全因死亡、心血管死亡和再住院风险增加有关。
在 HF 中使用改善病情的 GDMT,包括抑制钠-葡萄糖协同转运蛋白 2 以及肾素-血管紧张素-醛固酮系统和 β-肾上腺素能系统,可能有助于解决这种残余风险,因为它可以在 AVR 前增强 LV 逆向重塑和恢复。在OCEAN-TAVI 登记研究中,对于有冠状动脉搭桥术病史、外周动脉疾病、BNP ≥400 pg/mL 和术后 LVEF <50% 的患者,术前使用 β 受体阻滞剂与 2 年心血管死亡率降低相关。TAVR 后,肺毛细血管楔压 >12 mm Hg 的患者发生心血管死亡和 HF 住院的风险更高。这支持在干预前使用利尿剂进行充分的液体管理。然而,TAVR 前使用袢利尿剂与 1 年死亡率增加趋势相关,并被认为是晚期 LV 重塑的高风险、虚弱患者的标志。
围手术期注意事项
强AS
出现心源性休克的 AS 患者在临床上面临挑战,因为目前还没有关于该主题的大型前瞻性试验。一项小型研究表明,使用硝普钠可改善血流动力学特征。在一项观察性研究中,主动脉内球囊泵被证明可以改善血流动力学特征,包括中心静脉压、全身血管阻力和心脏指数。在病例系列中也报告了成功使用其他机械支持设备,如 TandemHeart (LivaNova)、Impella (Abiomed) 和静脉动脉体外膜氧合。虽然这些治疗策略在严重 AS 心源性休克的初始管理中很重要,但关键步骤是治疗固定阻塞。随着专业知识的增加和广泛使用,TAVR 近年来已成为 AS 心源性休克的可行选择。在一项大型注册研究中,与患有严重 AS 的稳定高危患者相比,TAVR 在心源性休克的 AS 中的 30 天死亡率明显更高。休克程度(根据强心剂或机械支持装置需求确定)与死亡率独立相关。此外,与选择性 TAVR 相比,紧急 TAVR 的急性肾损伤和新透析发生率更高。值得注意的是,与紧急 TAVR 中的自膨胀瓣膜相比,球囊扩张瓣膜的预后更好。虽然 TAVR 正在成为心源性休克患者的一种有效且安全的选择,但考虑到高死亡率,重要的是要考虑其成本效益。作为替代方案,救援球囊主动脉瓣成形术在与 SAVR 或 TAVR 桥接时可能是一种合理的替代方案。
术后注意事项
TAVR 和 GDMT 后心力衰竭
如前所述,TAVR 后 1 年内 HF 再入院率很高(13.6% 至 24.1% 之间)。近五分之一的患者在出院后早期(<30 天)再入院。多次和晚期再入院(术后 > 30 天)的长期死亡率显著升高 2 倍。对全国再入院数据库的分析显示,与未再入院的患者相比,TAVR 后每位 30 天内 HF 再入院患者的护理费用高出 12,928 美元。这凸显了在 TAVR 后诊所识别高危患者和密切门诊随访的重要性,目的是优化容量状态和启动/继续适当的 GDMT。目前 HF 诊所广泛采用的 7 天内早期随访模式可以扩展到这一高危人群。接受 TAVR 后接受肾素-血管紧张素-醛固酮系统抑制剂治疗的患者 LV 体积和肥大消退,3 年心血管死亡率降低。93 2020年 ACC/AMA 指南支持对接受 TAVR 的患者启动肾素-血管紧张素-醛固酮系统抑制剂治疗的 2b 类建议。RASTAVI(经导管主动脉瓣植入后肾素-血管紧张素系统阻断对临床进展和心室重塑的益处;NCT03201185)试验是关于 TAVR 后使用肾素-血管紧张素-醛固酮系统抑制剂的情况,而 DapaTAVI(经导管主动脉瓣植入后达格列净;NCT04696185)试验是关于在接受 TAVR 且有高 HF 住院风险的患者中使用达格列净的情况,是该领域正在进行的试验。TAVR后充盈压升高的发生率也很高,需要适当增加利尿剂剂量,从而减少未来的 HF 事件。
瓣周漏和心力衰竭
尽管随着术前计算机断层扫描成像规划、设备改进和操作人员熟练程度的提高,TAVR 后瓣周漏的发生率已显著下降,但患病率仍然约为 3.4%。瓣膜部署后立即发现急性瓣周漏或轻度以上慢性瓣周漏对于避免 HF 和溶血等并发症至关重要。SAVR 或 TAVR 后出现中度至重度瓣周漏是死亡率和 HF 住院治疗的独立预后指标。2020 年 ACC/AHA 指南支持将瓣周漏的手术修复作为 I 类建议。1对于难治性溶血或临床 HF、手术风险高且解剖结构适合导管修复的患者,选择经皮修复是合理的。1根据临床情况,可以采用包括瓣中瓣 TAVR、球囊后扩张和使用 AMPLATZER 血管塞(Abbott Vascular)等封堵器等技术。96成功的瓣周漏封堵与临床结果的改善相关,包括 NYHA 功能分级和心血管死亡率。

同时存在 AS 和 HF 与高死亡率和发病率有关,而 TAVR 的出现为这一高度脆弱且经常得不到治疗的人群提供了先进的治疗选择。心脏团队模型将 HF 专家纳入结构团队,在 TAVR 之前和之后都提供了宝贵的专业知识。它认识到 TAVR 通常只是 HF 管理的开始,强调需要无缝过渡到 HF 临床护理,包括优化 GDMT、容量管理和考虑其他疗法。利用多模态成像技术和循环生物标志物来检测瓣膜外心脏损伤可以进行早期纠正,以减轻疾病进展为晚期 HF。几项正在进行的临床试验将有助于为管理这些患者提供最佳实践,特别是在 TAVR 后的 HF 药物治疗方面。整合新兴技术可能进一步有助于在 LV 重塑开始之前改善 AS 患者的诊断和管理并预防 HF。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言












#心力衰竭# #主动脉瓣狭窄#
19