消化道早癌的病理诊断问题与对策
12小时前 上海阿克曼病理 上海阿克曼病理 发表于陕西省
消化道早癌 “三早” 关键,WHO 与日本标准有别,内镜活检病理诊断存挑战,需规范管理,我国确诊率低,多模式筛查促提升。
癌症防治的唯一出路为“三早”,即:早期发现、早期诊断、早期治疗。世界卫生组织(WHO)明确指出:早期发现是提高癌症治疗生存率的关键。近年来,随着早期消化道肿瘤筛查及诊治指南共识的相继出台,消化道早癌已成为国内医学界关注的热点。
消化道是从口腔至肛门的连续性管道,依次为口腔、咽、食管、胃、小肠和大肠。消化管壁(除口腔和咽外)由内向外分为黏膜、黏膜下层、肌层及外膜四层。
早癌指的是癌细胞尚局限在黏膜的浅表层,无论浸润范围和淋巴结是否转移,都不受影响。早癌不同于癌症的早期症状,它往往没有任何早期症状,检出较困难。但随着病情的进展,临床症状较为突出,如上腹疼痛、食欲下降、乏力等,但此时疾病多已至晚期,预后较差,病死率较高。数据显示,早癌诊断率日本达到70%以上,韩国55%以上,而中国仅仅只有10%-15%左右。因此,早期诊断对降低消化道癌患者的病死率具有重要意义[1]。
目前传统的内镜活检是诊断早期癌以及癌前病变的重要手段,随着医疗技术的提高,电子内镜不断改进,相继出现了化学染色内镜、电子染色内镜、放大内镜(ME)、荧光内镜(FE)、超声内镜(EUS)、激光共聚焦显微内镜(CLE)等技术,明显提高了消化道早癌的检出率及准确率[2]。
消化道早癌的治疗也已经由外科手术逐渐被内镜下治疗所取代,内镜黏膜下剥离术(ESD)是在内镜下切除术(EMR)基础上发展而来的新技术,ESD通过内镜,在粘膜下注射的基础上利用几种特殊的高频电刀将病变所在黏膜剥离,可完整地切除病变,达到根治消化道肿瘤的效果。
ESD术已经逐渐成为消化道早癌及癌前病变的一线治疗方法,在临床中发挥了重要作用。ESD术治疗前需通过术前内镜活检评估病灶性质,而临床工作中发现术前活检病理与ESD术后病理常存在一定差异,病理与临床的诊断出现不相符的现象[3]。而这也是目前病理诊断过程中所面临的问题或困惑,如何提升疾病诊断质量对于病理医生来说任重而道远。
01 WHO标准与日本标准分类的 诊断差异
由于日本与西方国家在对消化道癌前病变与早期癌进行病理诊断时,所应用的标准存在较大差异,因此导致病理学家在开展交流沟通时存在混乱的情况。
为了将日本与西方国家关于消化道癌前病变与早期癌诊断标准所存在的分歧减少,1998年消化道早期肿瘤组织诊断会议在维也纳召开,在会议上对消化道癌前病变与早期癌进行诊断的 Vienna 分类进行制定。随后在2000年,通过开展会议进一步优化了Vienna分类。世界卫生组织所制定的胃肠道上皮性肿瘤分类与Vienna分类基本保持一致,WHO分类是基于Vienna分类发展而来,其是将西方制定的消化道早期癌病理诊断标准与日本制定的标准进行折中处理。
而在国内的内镜活检方面,临床学习的为日本标准,临床医生往往比较熟悉日本活检分类如何处理,而且ESD的临床处理标准和规范基本上都是参照日本标准,其病理也是基本依据日本的标准。病理则学习的是WHO标准,病理医生常按照WHO分类发报告,因此有必要对二者的诊断差异进行对比[4]。

-
【WHO】[5]无肿瘤性病变,对应【日本分类】Group1,非肿瘤性病变;
-
【WHO】不确定/不典型增生,对应【日本分类】Group2,不确定有无上皮内肿瘤/异型;
-
【WHO】低级别上皮内瘤变,对应【日本分类】Group3、4、5,可能是腺瘤,但也可能是日本分类的tub1/tub2(高分化型/中分化型);在实践过程中发现,一些炎症和萎缩肠化也有可能被诊断为低瘤。低瘤的诊断普遍比较乱,需要引起重视;
-
【WHO】高级别上皮内瘤变,对应【日本分类】Group4、5,大概率是癌,可能因标本小或病变太少而写高度疑似;
-
【WHO】癌,对应【日本分类】Group5,一定是癌。
-
【日本分类】[6]Group1,对应【WHO】无肿瘤性病变;
-
【日本分类】Group2,对应【WHO】不确定/不典型增生;
-
【日本分类】Group3(临床诊断腺瘤),对应【WHO】低级别上皮内瘤变;
-
【日本分类】Group4、5(临床诊断为癌),可能对应【WHO】低级别上皮内瘤变、高级别上皮内瘤变或癌。
了解两个诊断标准的异同点对于内镜医生和病理医生之间的沟通非常重要。目前WHO的腺瘤标准和日本的腺瘤定义有很大的不同,WHO的腺瘤定义为息肉样的肿瘤性异型增生,非浸润性肿瘤性胃上皮,包括低级别和高级别腺瘤(相当于大肠的腺瘤,分为低级别和高级别)。日本标准腺瘤的定义为界限清楚的良性上皮性病变,是以管状结构为主的上皮内非浸润性肿瘤,多显示为肠型的细胞浆,主要是小肠型,胃型腺瘤少见。
从定义来看两者概念差别不大,但随着日本内镜技术的发展,日本的腺瘤定义已经限定在一个较狭小的范围,仅指腺体结构非常一致,排列规则,细胞呈杆状,位于基底部,并且排列呈栅栏状。而且日本标准中只有腺瘤和腺癌,低级别上皮内瘤变和高级别上皮内瘤变在日本标准中是不存在的,真正的“低级别”不等于日本的腺瘤,一部分低级别相当于日本的tub1/tub2(高分化型/中分化型),真正的高级别上皮内瘤变几乎等同于腺癌了。
无论两者标准差异多大,对于肿瘤/非肿瘤的诊断标准是一致的,正确区别肿瘤性病变与非肿瘤性病变非常重要。
02 明确标准中的重要概念
WHO于2000年首次将上皮内瘤变(IN)应用到消化系统癌症的分类,指出IN属于胃肠道粘膜上皮的癌前病变,分为低级别(LGIN)和高级别上皮内瘤变(HGIN)。LGIN的异常改变仅局限于上皮的下半部,包括轻度和中度异型增生。HGIN的异常常常累及上皮的上半部甚至全层,但没突破基底膜,包括重度异型增生、原位癌、黏膜内癌,这类肿瘤不会转移。这意味着“上皮内瘤变”与“异型增生”是同义词,含义是相同的。
而在结直肠肿瘤诊断中对于那些组织学上已经具有癌的特征,但没有侵犯到黏膜下层的结直肠肿瘤性病变均归为高级别上皮内瘤变。WHO认为只有见到黏膜肌浸润并突破到黏膜下层才能诊断为癌。黏膜下层浸润与否是区分浸润性癌和高级别上皮内瘤变的重要标志。而在临床应用过程中,往往发现经活检诊断的上皮内瘤变术后病理证实是癌,这可能是内镜取材位置不精确或者取材深度较浅,无法钳取适宜深度的肌层组织等,而让病理医生在诊断的时候受到很大的局限性。
因此,内镜医生在内镜活检时结合超声内镜、放大镜等进行仔细观察。选择取材部位时应根据不同分型针对性取材,若发现可疑病灶应及时与病理医生沟通等,从而降低病变的误诊率及漏诊率。并且确保医院内临床医生和病理医生准确理解和把握标准的含义,在用词上达成一致和共识,让内镜医生正确理解病理报告、临床医生在处理病人时达成共识[7]。
03 胃肠镜活检标本病理诊断的规范化管理
胃肠镜活检标本由于取材量较少,病理诊断尤其针对恶性肿瘤的诊断具有挑战性,因为活检结果直接决定患者的后续手术治疗情况,漏诊/误诊均可能导致患者丧失功能器官。郑家垚等[8]在比较上消化道不同部位黏膜病变内镜黏膜下剥离术(ESD)术前胃镜活检病理与术后病理的差异发现,胃食管黏膜病变胃镜活检病理与ESD术后病理完全符合率为52.1%,国内外文献报道的活检病理与ESD术后病理符合率为44.1%-66.0%,部分病灶有轻判的可能(如下图1所示)。术前活检病理与ESD术后病理存在差异的原因可能包括:
(1)术前活检仅取材至病灶中的一小部分,对于较大大面积病灶未充分评估病灶最重处而活检,易导致活检病理轻判。
(2)活检病理的组织标本往往较小,活检组织深度不够,无法全面精确地评估病灶性质导致病理医师诊断偏向保守。
(3)不同病理诊断医师对于病灶性质评估也存在一定主观性及差异,且国际病理界有关食管及胃癌前病变和早期癌的病理诊断的诊断标准存在差异等。
图 1 消化道早癌术前胃镜活检与 ESD术后病理对比
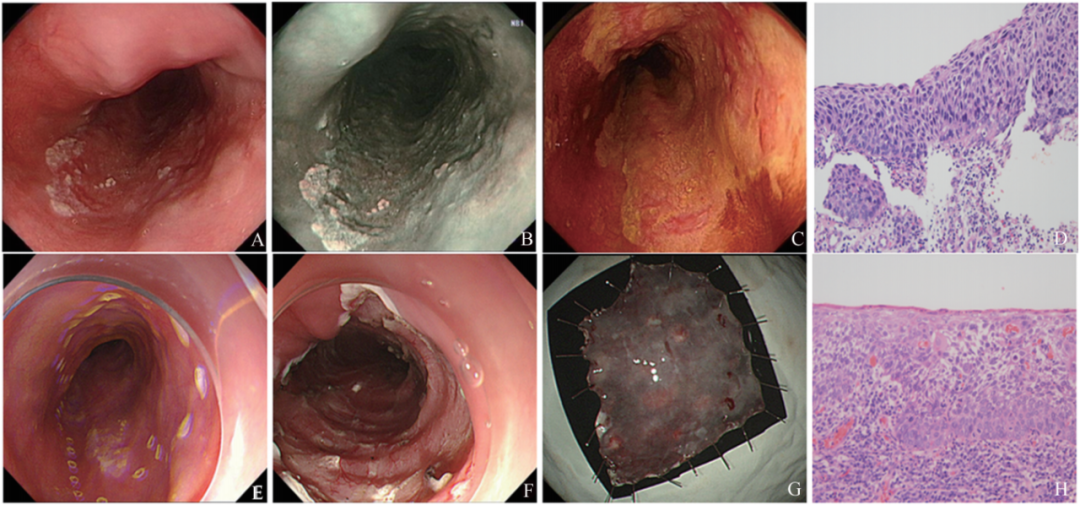
注: A:食管(距门齿 27-32 cm)白光下见一片状粗髓糜烂灶; B:NBI病背景呈茶褐色; C:碘染呈不染区,粉红征阳性; D:活检病理为 HGIN(放大 200 倍); E:ESD 术前行病灶标记; F:ESD 术后创面; G:ESD 剥离标本; H:ESD 术后病理示中分化状细胞癌,侵犯黏膜固有层(放大 200 倍)。
胃肠镜活检从消化内镜医生取材到病理诊断医生发出病理报告,中间涉及多个环节,每一环节都可能会影响最终诊断的准确性,胃肠镜活检的癌检出率不仅仅取决于病理科诊断医生的经验和诊断水平,也与临床取材及提供的内镜信息密切相关,因此,对于胃肠镜活检标本的病理诊断全过程采取规范化管理模式尤为重要。徐励等[9]通过以下四个方面来规范管理胃肠镜活检标本:
(1)建立信息化管理系统并完善临床信息:送检申请单需包括患者的基本信息,活检部位及取材数量,标本离体时间及浸入固定液时间,临床诊断,内镜所见,送检目的,既往胃肠镜及活检结果,注意事项和送检医生签名及送检日期。如果有取材困难、高度怀疑癌的病例,临床医生会在信息系统中有所提示,大大提高病理和临床对于癌的诊断吻合度及检出率。
(2)规范化取材及制片:胃肠镜活检标本组织量较少,所有工作人员必须严格遵守病理科的核对制度:标本接收核对、取材及记录核对、包埋核对、常规HE制片核对、诊断核对、切片档案管理核对、蜡块档案管理核对等专人负责制,避免出现人为原因导致的错误,从而保证此类标本的制片质量。
(3)消化病理亚专业规范化管理:成立消化系统亚专业小组,拓展诊断思维,共同学习提升诊断水平。
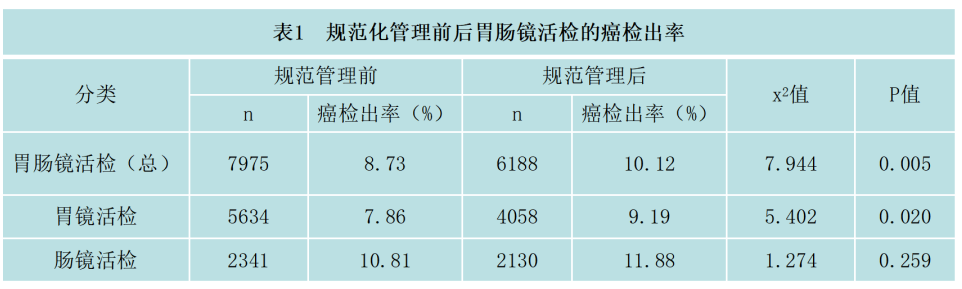
(4)临床病理及时反馈和沟通:消化内镜医生不断学习并掌握最新内镜技术,消化病理亚专业小组的医生也需要紧跟消化内镜医生的步伐,不断学习内镜知识,了解最新进展,促进消化系统疾病多学科讨论会议(MDT)的召开相互促进诊断质量的提高。徐励等统计学分析结果显示,消化内镜中癌的检出率10.12%相对于管理前(8.73%)也有大幅提高(如下表1所示)。
我国是消化道癌的高发病率国家,而消化道早癌的确诊率和日本、韩国、美国等发达国家相比,存在较大的差距。我国消化道早癌的确诊率低的原因较多,如消化道早癌筛查体系不尽完善,人们对消化道癌的预防知识以及早期检查意识淡薄,内镜检查及标准规范性不足,内镜医生或病理医生的经验水平存在明显的差异等。
目前,对于消化道早癌检出率的提高提出多模式结合的消化道早癌的筛查,如健康宣教,内镜检查规范化,综合精确评估病灶性质,降低内镜活检和术后病理的诊断差异性等,从而降低消化道癌的发病率以及死亡率。
*本文(包括图片)仅供行业交流学习用,不作为医疗诊断依据。
参考文献
[1] 李兆申,邹文斌.如何提高内镜下早期胃癌的诊断水平[J].胃肠病学和肝病学杂志,2016,l:601_604.
[2] 沙鹏.消化道早癌诊断的常用内镜及诊断进展[J].医疗装备,2018,31(6):200-201.
[3] 王玲.消化内镜检查及消化内镜黏膜下剥离术对消化道早癌的诊治效果观察[J].中国现代药物应用,2023,17(5):41-43.
[4] 王锡平.消化道癌前病变及早期癌如何实施病理诊断[J].保健科普与教育,2020,14:86.
[5] 《Digestive System Tumours》(WHO)
[6] 《胃癌 第2版》(日)深山正久&大仓康男
[7] Organization WH. World health organization classification of tumours of digestive system. Lyon:IARC Press,2010:1-55.
[8] 郑家垚,许炎钦,林旭.430例上消化道早期癌及癌前病变ESD术前活检与术后病理差异性分析[J].胃肠病学和肝病学杂志,2020,29(9):1026-1031.
[9] 徐励,曾智,詹娜,袁静萍.胃肠镜活检标本病理诊断的规范化管理[J].临床与实验病理学杂志,201935(6):734-736.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言


















#诊断标准# #规范化管理# #消化道早癌#
10