Circ Res 中山大学蔡卫斌/陈慧团队揭示糖尿病心肌病代谢-结构耦合调控新机制
2025-04-09 论道心血管 论道心血管 发表于陕西省
该研究从代谢联接心肌结构的视角,阐释了DCM的关键发病机制,为DCM的临床防治提供了新的靶点和思路。
糖尿病造成的心血管并发症发病率正逐年攀升,是全球重大的公共卫生挑战。糖尿病心肌病(Diabetic Cardiomyopathy, DCM)作为糖尿病致死性并发症,常进展为心力衰竭、心律失常以及心源性休克,甚至猝死,临床预后不良。然而,目前临床上的常规药物无法纠正DCM的进展,明确其关键发病机制和防治靶点迫在眉睫。
2025年4月7日,中山大学中山医学院蔡卫斌教授团队联合中山大学孙逸仙纪念医院陈慧教授团队,在心血管领域著名期刊Circulation Research发表了题为“Metabolic Coordination Structures Contribute to Diabetic Myocardial Dysfunction”的研究论文,该研究从代谢联接心肌结构的视角,阐释了DCM的关键发病机制,为DCM的临床防治提供了新的靶点和思路。

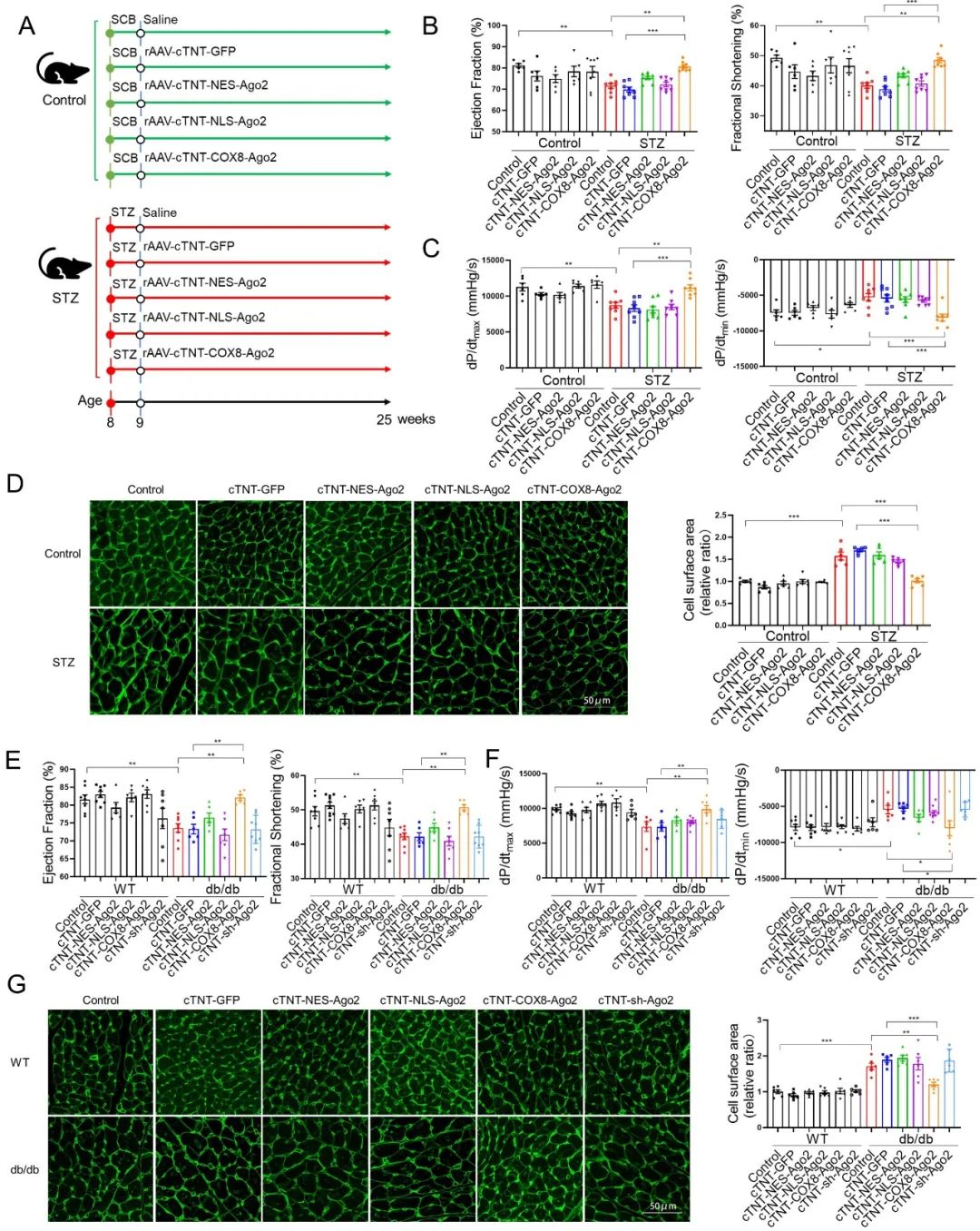
代谢紊乱和结构异常是DCM的核心病理特征。该团队通过多种技术手段(PET-CT、组织荧光成像、FIB-SEM和单细胞收缩力检测)充分证明DCM中糖脂代谢紊乱和超微结构异常及心肌细胞功能降低的现象,为研究代谢和结构耦联的内在逻辑提供了重要参考。
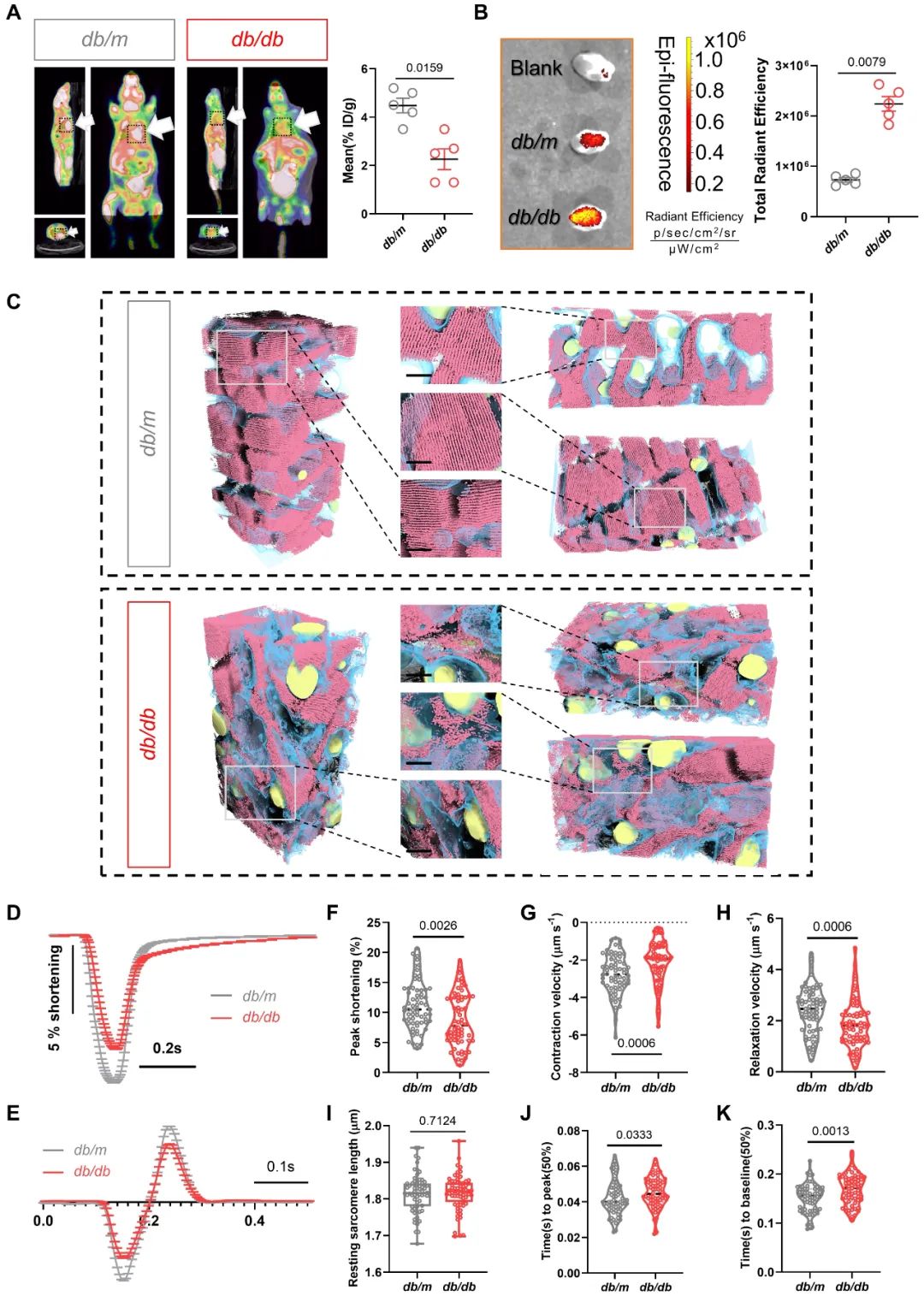
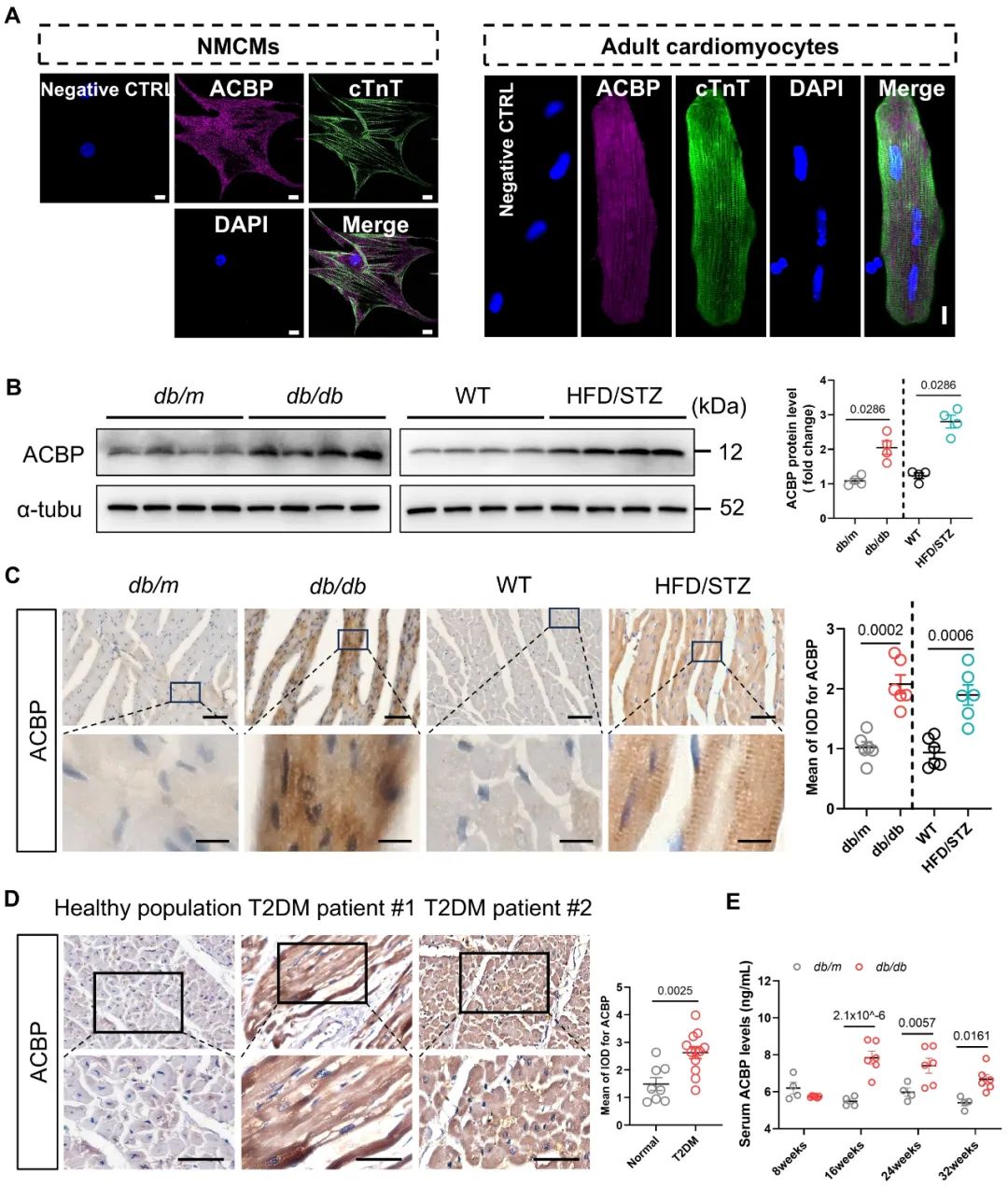
既往研究中,代谢和结构耦合在DCM中的作用机制鲜有涉及。该研究团队通过多维度研究体系(涵盖T2DM患者心肌标本、糖尿病模型小鼠及基因编辑动物),发现脂代谢关键分子酰基辅酶A结合蛋白(ACBP)在糖尿病心肌组织中表达上调,提示ACBP可能在DCM中发挥重要作用。
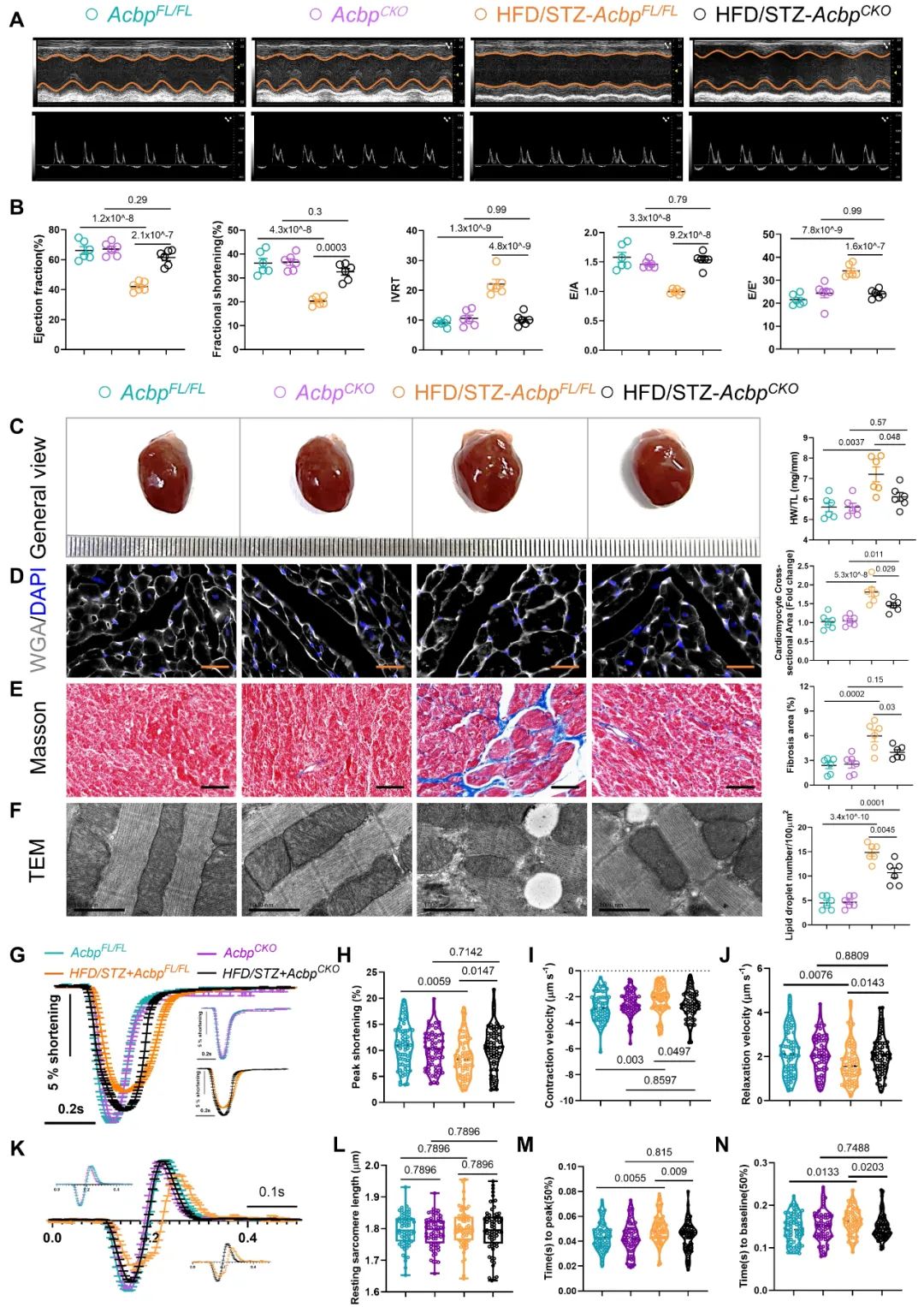
为了明确ACBP是否参与DCM,团队构建了心肌细胞特异性敲除Acbp的小鼠,并进行T2DM诱导。结果发现,心肌特异性敲除Acbp能显著改善T2DM小鼠的心脏功能和心肌重构,增强心肌细胞收缩力。
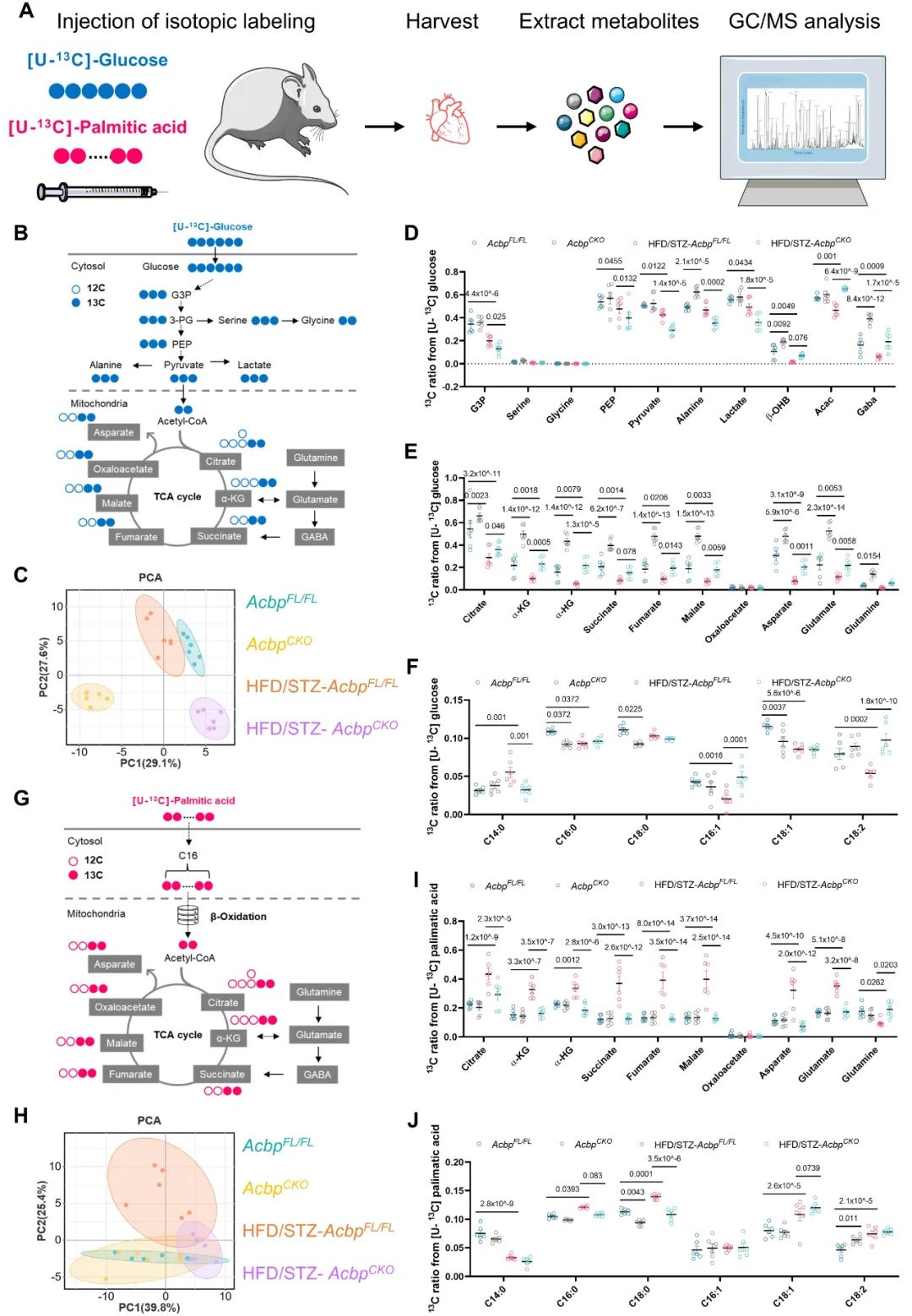
为了研究心肌特异性敲除Acbp改善T2DM小鼠心功能是否由于代谢改变所导致,团队利用13C标记的葡萄糖和棕榈酸进行了同位素代谢流示踪分析。实验结果表明,心肌特异性敲除Acbp显著抑制了脂肪酸代谢,同时增强了葡萄糖的利用,这表明糖尿病心肌底物代谢灵活性得到了一定程度的纠正。
为了进一步探究代谢和结构耦联的分子基础,团队通过免疫共沉淀联合质谱分析,结合系列实验发现,ACBP在糖尿病条件时与心肌骨架结构蛋白—心肌型肌球蛋白结合蛋白(MyBPC3)结合。然而,这种异常的代谢—结构相互作用会导致肌节收缩滑动的结构基础被破坏,让辅助肌动蛋白和肌球蛋白收缩滑动的MyBPC3无法正常桥接到细肌丝(肌动蛋白),引起横桥结构减少,导致心肌收缩力降低。
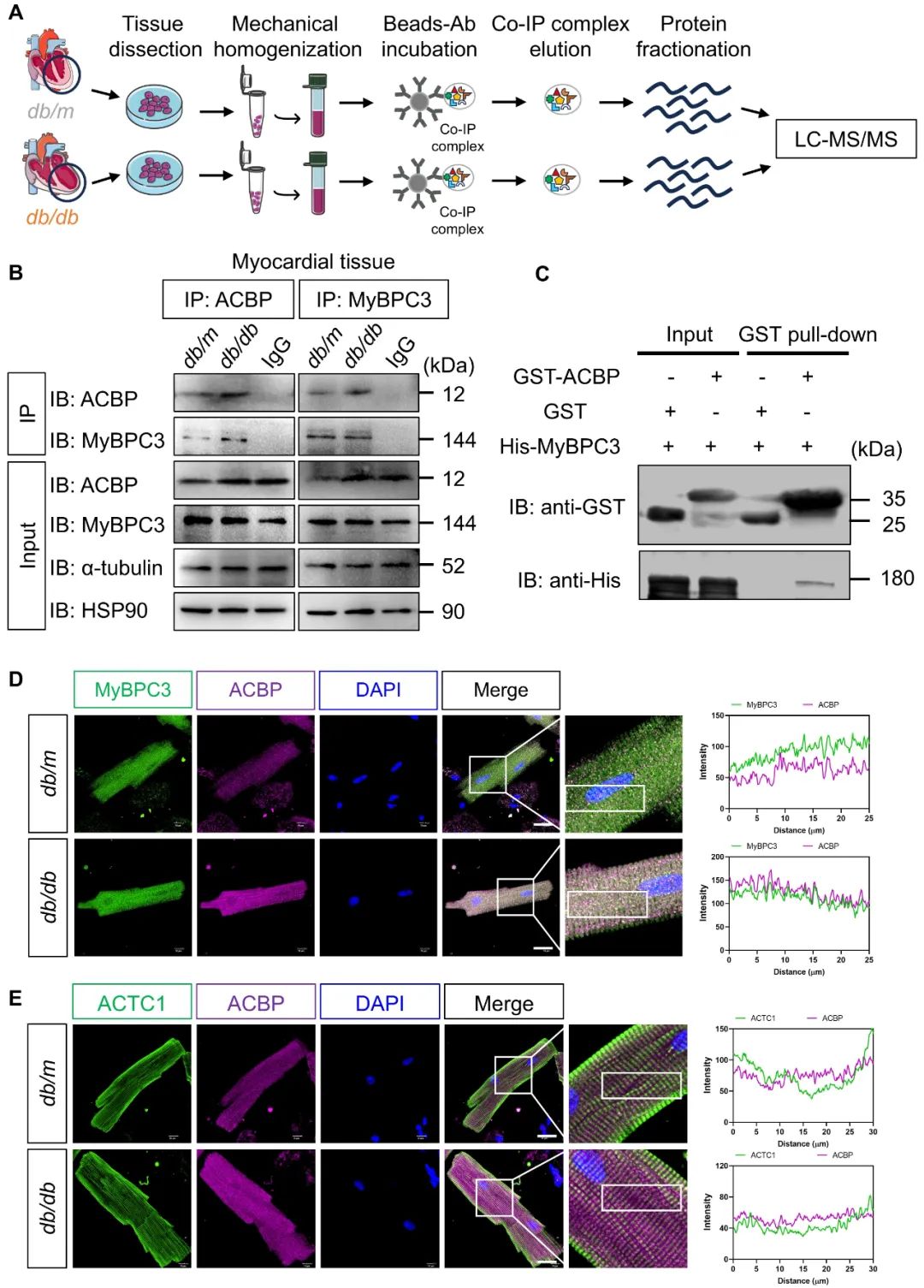
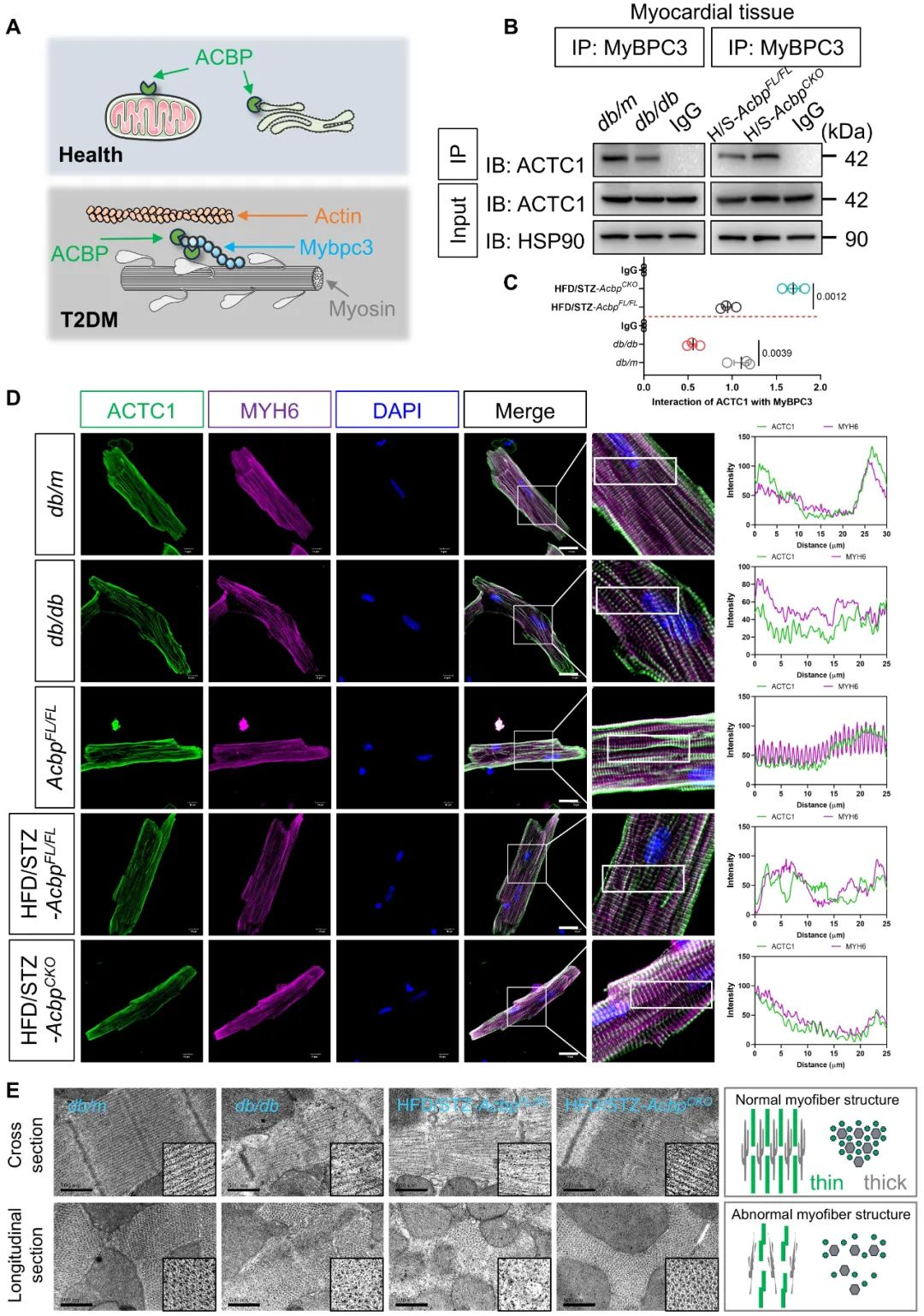
综上所述,本研究发现脂代谢关键分子酰基辅酶A结合蛋白(ACBP)在糖尿病心肌组织中表达上调。机制研究表明,ACBP可扰乱心肌底物代谢灵活性,同时抑制肌节收缩,加重DCM。值得注意的是,靶向干预ACBP可以同步实现心肌代谢重塑(调节底物代谢灵活性)和结构修复(解除ACBP-MyBPC3病理互作),有望成为改善DCM的潜在治疗靶点。该研究创新性提出ACBP可作为同时改善心肌代谢和结构异常的双效靶点,证实代谢—结构协调是DCM的重要发病机制,为探索其发病机制及设计新治疗策略提供了重要依据。

中山大学中山医学院、中山大学实验动物中心蔡卫斌教授、谭静副研究员和中山大学孙逸仙纪念医院生殖医学中心陈慧教授为论文的共同通讯作者。中山大学中山医学院2020级博士吴腾(现为中山大学孙逸仙纪念医院生殖医学中心博士后)和2019级博士黄统生为共同第一作者。该研究参加了美国心脏协会2023年度科学会议壁报交流,并在“第一届大湾区心血管研究与转化论坛”上进行主题报告。中山大学实验动物中心/广东省疾病模式动物工程技术研究中心、中山医学院代谢组平台黄蓬教授团队、生命科学学院电镜平台张勤奋副教授团队、中山医学院科研仪器平台等为本研究提供重要技术支撑。该研究得到了国家重点研发计划、国家自然科学基金项目和广东省基础与应用基础研究基金等项目资助。
蔡卫斌,中山大学三级教授、“逸仙优秀学者”、广东省特支计划领军人才,现任中山大学实验动物中心主任、广东省疾病模式动物工程技术研究中心主任,主要致力于“心肌损伤与修复”的基础研究和“疾病模式动物研发与标准化研究”,近年来在Circulation Research (2025)、Nature Communications (2023a, 2023b)、Cell Reports (2019, 2022)、Redox Biology (2024)、Theranostics (2020)等国际知名期刊发表研究论文。课题组研究方向成熟稳定,科研资源和研究条件优良,欢迎对心肌损伤与修复、疾病模式动物研发与标准化有兴趣的优秀人才加入。
原文链接:
https://www.ahajournals.org/doi/10.1161/CIRCRESAHA.124.326044

本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言














#糖尿病心肌病# #DCM#
15