徐万海院长:分子影像助力肿瘤的精准诊疗
23小时前 医悦汇 医悦汇 发表于陕西省
徐万海教授在乳腺肿瘤论坛报告指出,尽管手术技术进步,但肿瘤患者生存率改善不明显。分子影像技术可助力肿瘤精准诊疗,其团队研发多种分子探针,进行临床前评价与临床转化,还研发近红外膀胱镜。
编者按:近期,2025年南北汇·第七届乳腺肿瘤论坛在上海隆重召开。会议邀请了乳腺肿瘤领域的资深专家围绕前沿进展和热点话题展开精彩报告和讨论。本次会议上,哈尔滨医科大学附属第二医院院长徐万海教授发表了题为《分子影像助力肿瘤的精准诊疗》的主题报告。【医悦汇】特整理报告内容,以飨读者。
精准诊疗的困境
徐万海教授回顾了自身手术历程,20年前主要开展开放手术,十几年前转向腔镜手术,如今则专注于机器人手术。从开放手术到机器人手术,手术技术不断革新,精准度显著提升,患者受益良多,医生能够更加精准地实施治疗,精准切除病灶,术中出血量减少,术后恢复也更为迅速。
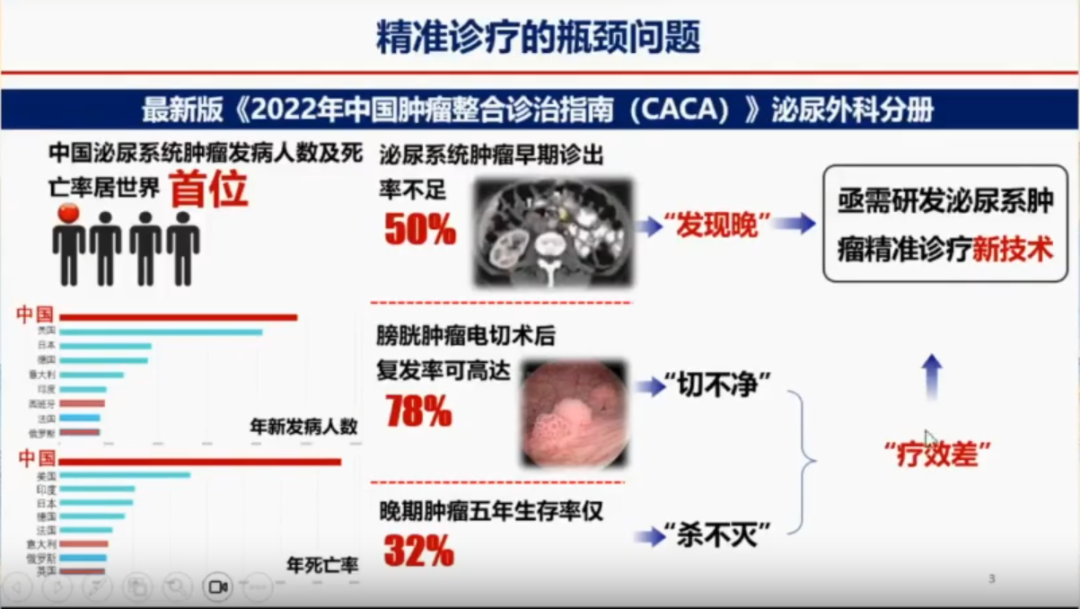
然而尽管手术技术不断进步,但肿瘤患者的总体生存率(OS)改善仍不明显。他以泌尿系统肿瘤为例,强调其死亡人数和发病人数均居世界前列。究其原因,一方面是早期诊断率较低(不足50%),许多患者确诊时已处于中晚期;另一方面是术后复发率较高,膀胱肿瘤电切后复发率可高达78%,即“切不净”,需要改进手术技术和方法,晚期肿瘤的五年生存率仅为32%,即“杀不灭”的问题,需要开发更有效的治疗手段。因此,徐教授认为,亟需研发泌尿系统肿瘤精准诊疗的新技术,以提高早期诊断率、减少复发率和提高晚期肿瘤的生存率。
分子影像技术的发展
从传统的X-RAY、CT、MRI等影像技术,到如今的分子影像技术,医学影像学已经从宏观解剖层面发展到微观分子层面。其中,PET(正电子发射断层显像)是分子影像技术的典型代表,而PSMA PET(前列腺特异性膜抗原PET)更是泌尿系统肿瘤精准诊断的典范。
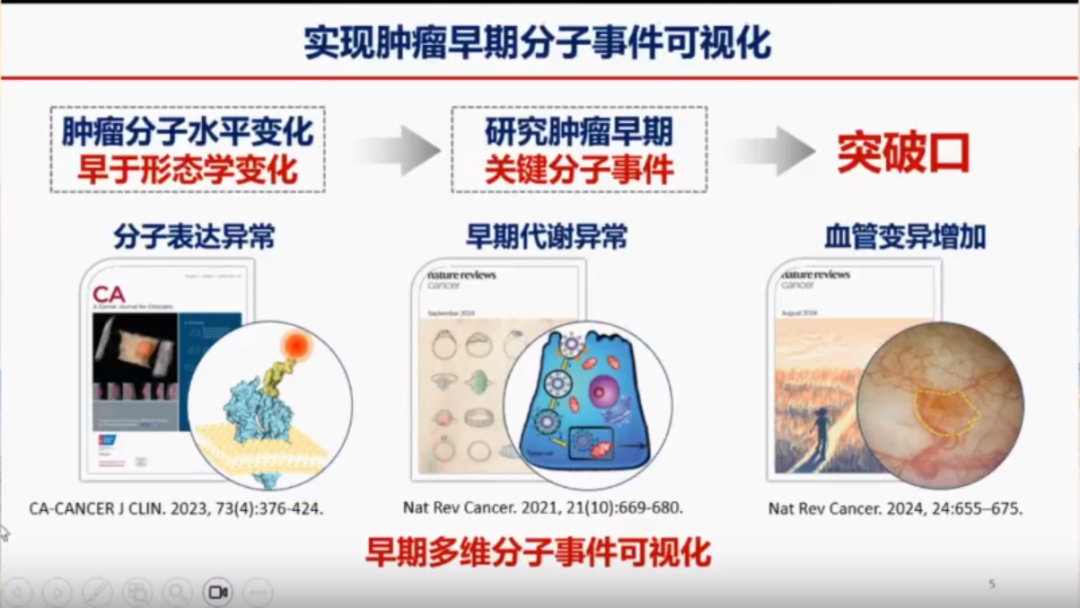
肿瘤的分子影像变化通常早于形态学变化,这使得分子影像技术能够更早地发现肿瘤病变,为早期诊断和治疗提供可能。随着ADC(抗体偶联药物)等新型药物的出现,研究肿瘤早期关键分子变化成为突破肿瘤诊断和治疗瓶颈的重要方向。分子影像技术通过标记病变部位的特异性分子,能够在合理状态下对肿瘤的分型变化及其生物行为进行定性和定量研究。
分子影像技术在肿瘤精准诊疗中的核心作用主要依赖于分子探针。分子探针是实现分子成像的关键,通过与细胞内的靶分子特异性结合,能够对体内病变进行标记和成像。然而,传统的分子探针存在特异性不强、富集量少、滞留时间短以及易受微环境干扰等问题。因此,尽管分子影像技术在临床应用中具有巨大潜力,但目前国内外仍未有一个探针能够完全实现精准靶向和长效成像。

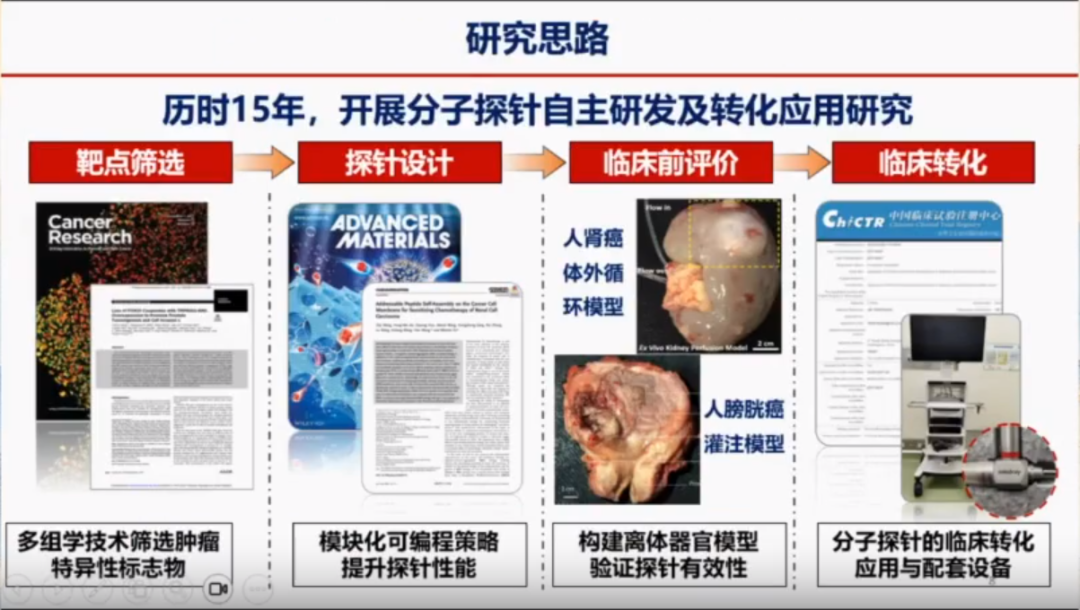
徐教授团队在过去15年中一直致力于靶点探针的研发、临床评估和转化工作。团队所在的实验室被国家卫健委批准成立为分子探针与靶向诊疗重点实验室,该实验室也为国家卫健委获批成立的分子探针与靶向诊疗重点实验室,致力于开展泌尿系肿瘤靶向诊疗领域原创性、探索性、前沿性和系统性的研究。通过多学科交叉,如分子影像、纳米医学和免疫学等,实验室致力于开发能够精准靶向肿瘤的分子探针。这些探针不仅能够用于肿瘤的早期诊断,还能在治疗过程中提供实时的分子水平信息,从而实现精准治疗。
靶点筛选
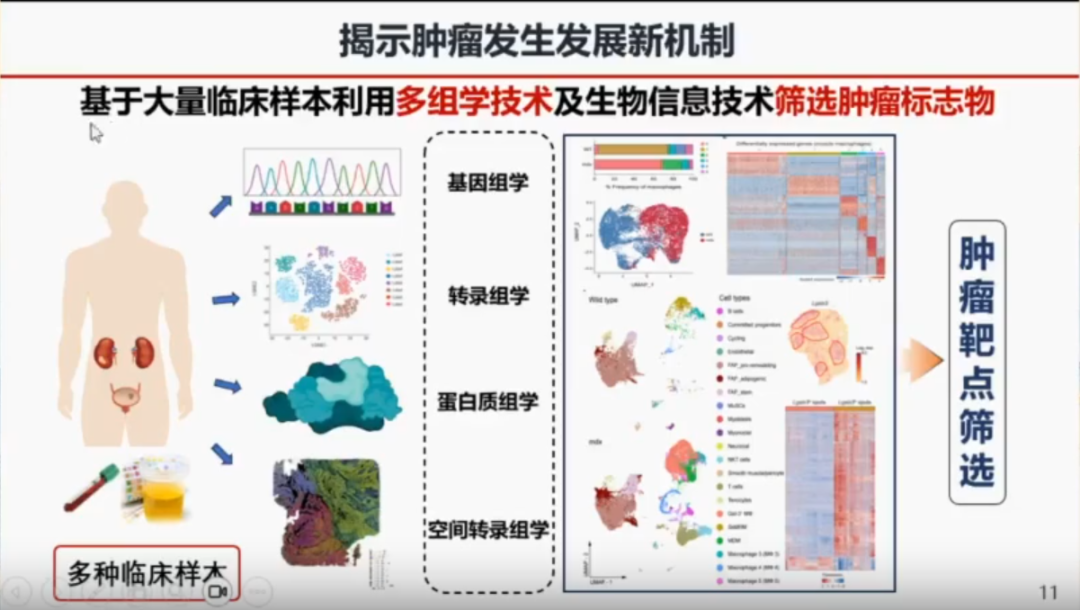
徐万海教授团队利用大量的临床数据库,通过基因组学、转录组学、蛋白组学和空间转录学,对生物的和信息学筛选肿瘤标志物。徐万海教授团队依托海量的临床数据库,综合运用基因组学、转录组学、蛋白组学以及空间转录组学等前沿技术,从生物学与信息学的双重维度对肿瘤标志物展开深入筛选。
探针设计
在这一研究基础上,团队又聚焦于探针的设计。此研究也为2021年科技部重点研发项目,徐万海教授团队则致力于构建模块化、可编程的分子探针体系。该体系涵盖靶向识别、原位响应、组装富集以及肿瘤成像/治疗四个关键步骤,由靶向模块、响应模块和组装模块协同组成。在肿瘤微环境(例如酸性环境、活性氧等)的刺激下,分子探针能够发生特异性响应,进而触发组装富集过程。经过组装富集后的分子探针,能够精准实现肿瘤的成像与治疗,为肿瘤的诊断与治疗提供了全新的思路与方法。
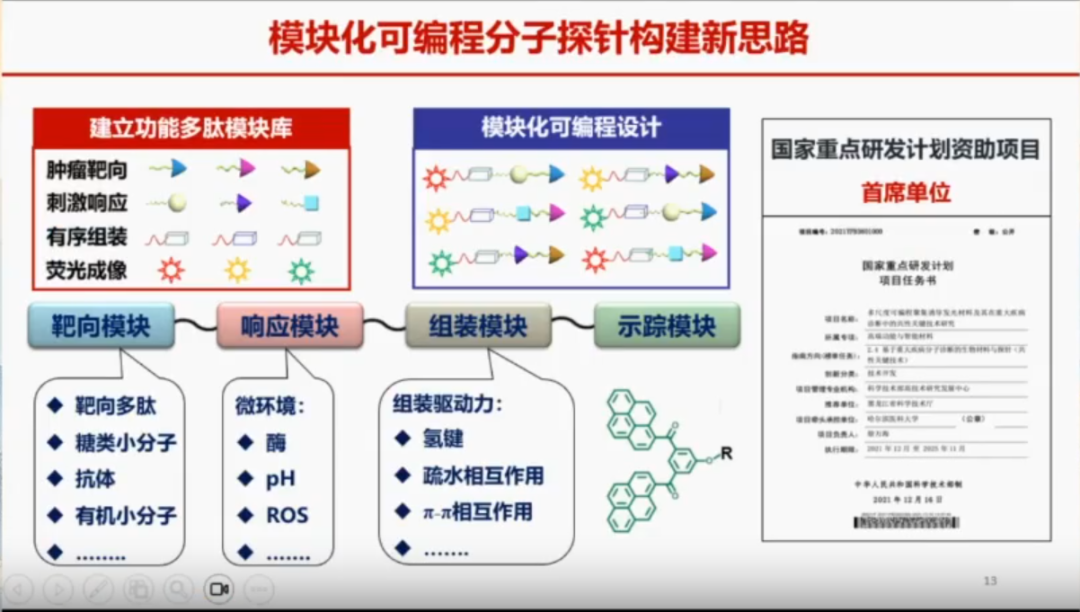
MMP-2响应型活体自组装分子探针
该技术采用MMP-2(基质金属蛋白酶-2)响应型分子探针,通过在肿瘤细胞表面的激活和自组装过程,显著增强信号。这种探针类似于“小牙签”,能够精准标记肿瘤细胞膜,进而在体内长效滞留,并将信噪比提高150%以上,从而精准识别肿瘤边界。在膀胱癌和肾癌等泌尿系统肿瘤中,该技术能够有效指导术中精准切除。
在手术过程中,这种“模块化、可编程”的分子探针可借助术中成像引导,帮助医生更精确地识别和切除肿瘤,从而降低术后复发风险。
相关研究成果已发表于《Bioactive Materials》(2022年,影响因子18.0)和《ACS Nano》(2020年,影响因子15.8)。

生物正交反应响应型活体自组装分子探针
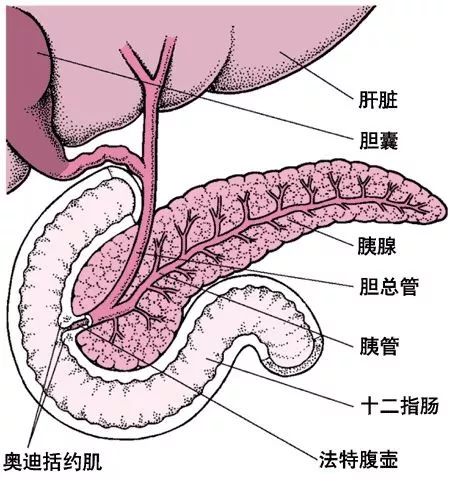
徐万海教授团队率先提出了“靶向-响应-组装”策略,通过生物正交反应构建分子探针的新理念。该探针进入膀胱后,可利用CD44v6靶向肽(TP)特异性识别膀胱癌细胞,结合细胞膜后在体内原位自组装成纤维肽网络,形成具有高度空间规整结构的纳米矩阵。这种结构能够显著增强荧光探针的光稳定性,使其在手术过程中抵抗周期性尿液冲洗和膀胱排空的影响,从而实现持久的荧光信号,为精确荧光成像和指导膀胱癌切除提供支持。
膀胱癌是实体瘤中复发率较高的癌症之一,复发率可高达50%~70%。其高复发率的原因之一在于手术后周围可能残留微小病变,导致术后一年左右复发。该探针能够精准发现微小肿瘤,为降低膀胱癌复发率提供了新的手段。相关研究成果已发表于《Advanced Materials》2023年(影响因子29.4)。
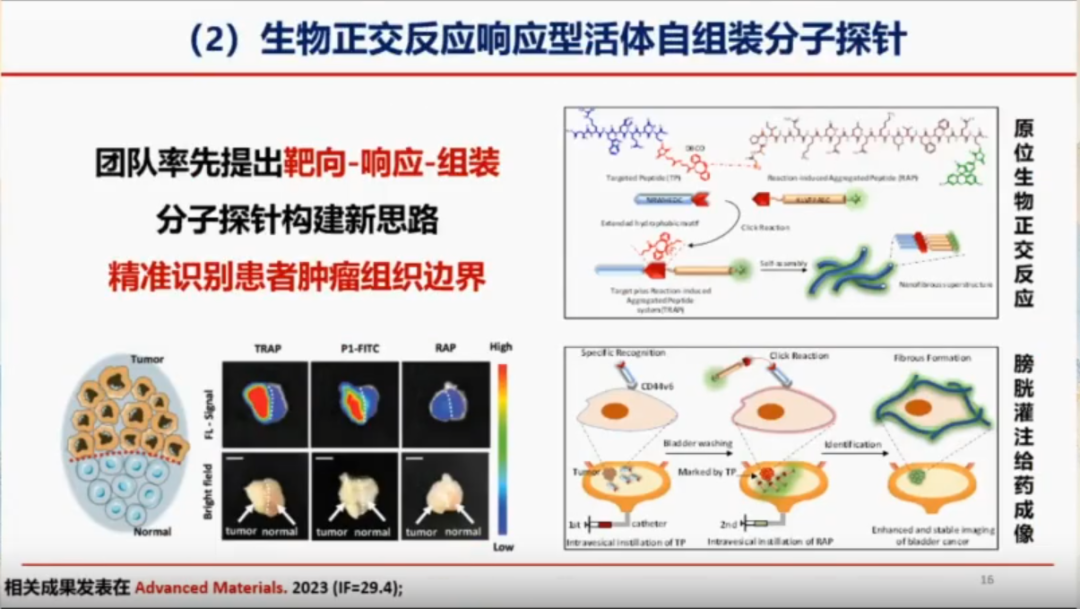
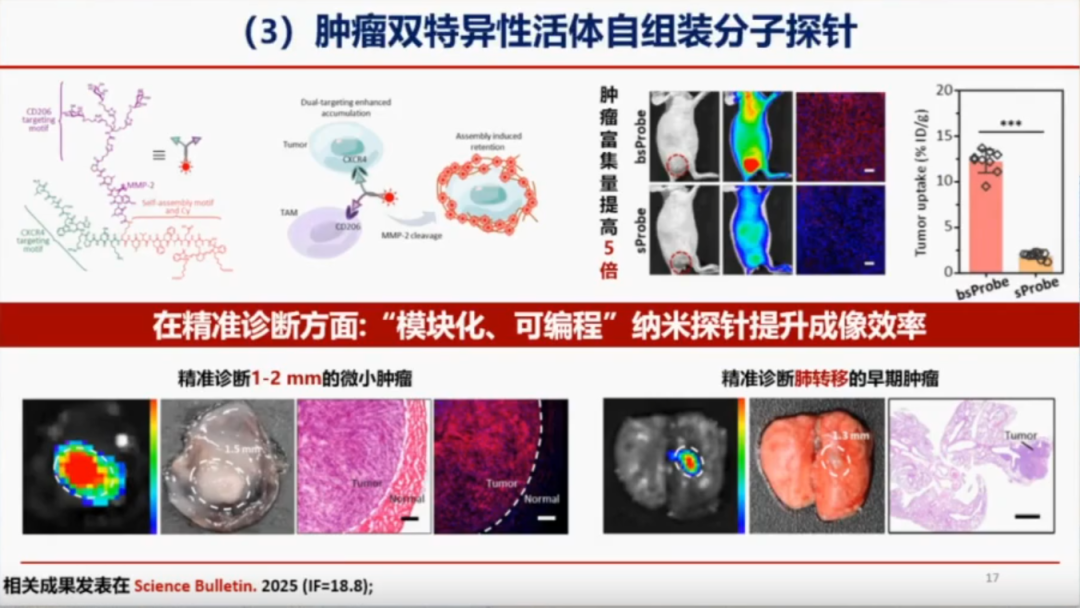
肿瘤双特异性活体自组装分子探针
为提升探针在体内的成像效果,徐教授团队开发了双靶向特异性探针。该探针利用特定的靶向分子(如抗体、肽等)精准识别肿瘤细胞表面的标志物,并在肿瘤细胞表面通过自组装形成特定结构,从而显著增强信号,提高成像信噪比。
通过将探针与免疫细胞(如巨噬细胞、CD206等)结合,团队实现了双靶点设计,使探针在肿瘤组织中的富集率提升了5倍,进而显著提高了肿瘤的精准诊断和治疗能力。例如,在小肾癌模型中,该探针能够检测到直径约1~2毫米的小肿瘤;在肾癌肺转移模型中,还能发现肺部直径仅为1.3毫米的小肿瘤。这种双靶点策略显著提高了癌症的诊断率。相关研究成果已发表于《Science Bulletin》2025年(影响因子18.8)。
临床前评价
由于人类与动物在生理解剖结构、组织代谢功能及刺激耐受能力等方面存在显著差异,现有动物模型的结果往往无法真实反映分子探针在人体内的有效性。例如,动物模型中肿瘤的生长速度、免疫微环境等与人类存在较大差异,这可能导致分子探针在动物实验中表现出良好的效果,但在人体内的效果却不尽如人意,因此,开发更接近人类生理条件的模型对于评估分子探针的有效性至关重要。
人源荷瘤膀胱癌模型的构建与应用
在临床实践中,外科医生在切除膀胱时,通常会先切断膀胱的动静脉,以减少术中出血。然而,为了保留膀胱功能并进行临床实验,可以在手术的最后一步切断膀胱动静脉后,迅速在体外对膀胱进行灌注,从而实现分子探针在离体膀胱内的精准治疗和可视化成像。这种体外灌注的方法能够在一定程度上模拟人体内的生理环境,帮助更准确地评估分子探针在人体内的表现。
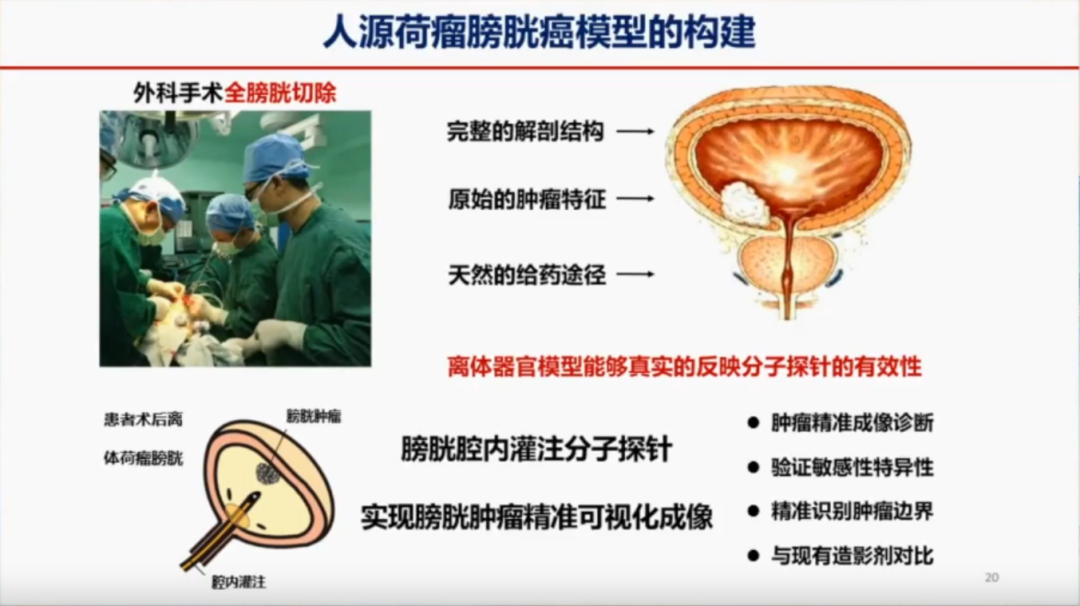
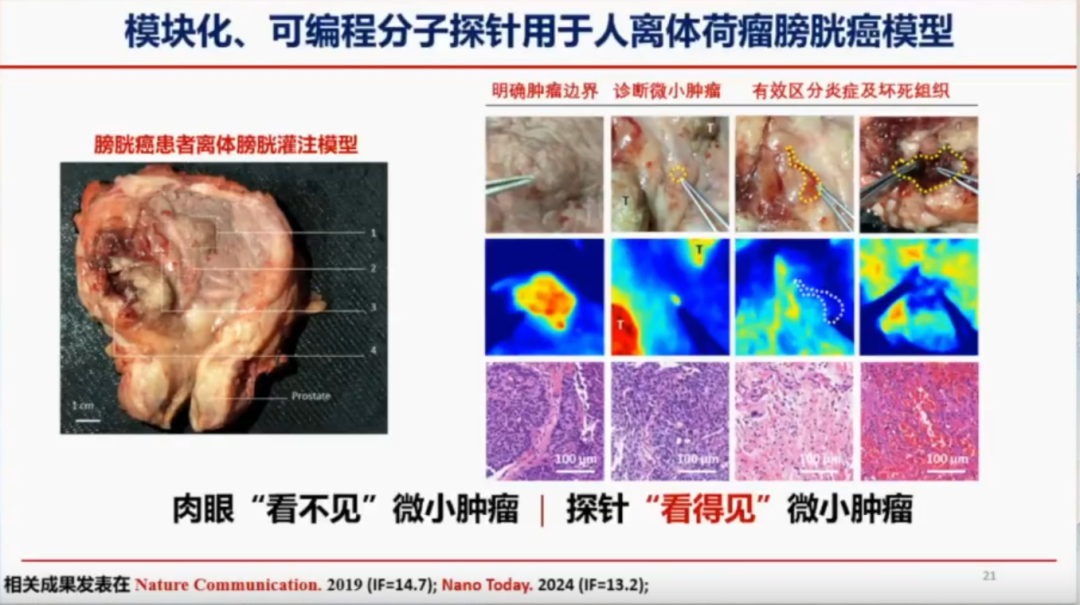
模块化、可编程分子探针用于人离体荷瘤膀胱癌模型
膀胱癌复发率高的一个重要原因是术中未能发现微小病变。在手术过程中,有些部位看似正常,但通过分子成像技术却能发现潜在的癌变区域。在模型中可以看到,原本认为正常的组织在成像后可能显示出异常信号,经过HE染色检测后被证实已经发生癌变。这表明,仅依靠肉眼判断可能会遗漏微小病变,而这些病变在术后可能发展为复发性癌症。而纳米探针的可以精确识别这些微小癌变区域,明确肿瘤边界,有效的区分炎症和坏死组织,从而降低膀胱癌的复发率。相关成果发表在《Nature Communication》2019年(影响因子IF=14.7)和《Nano Today》2024年(影响因子IF=13.2)。
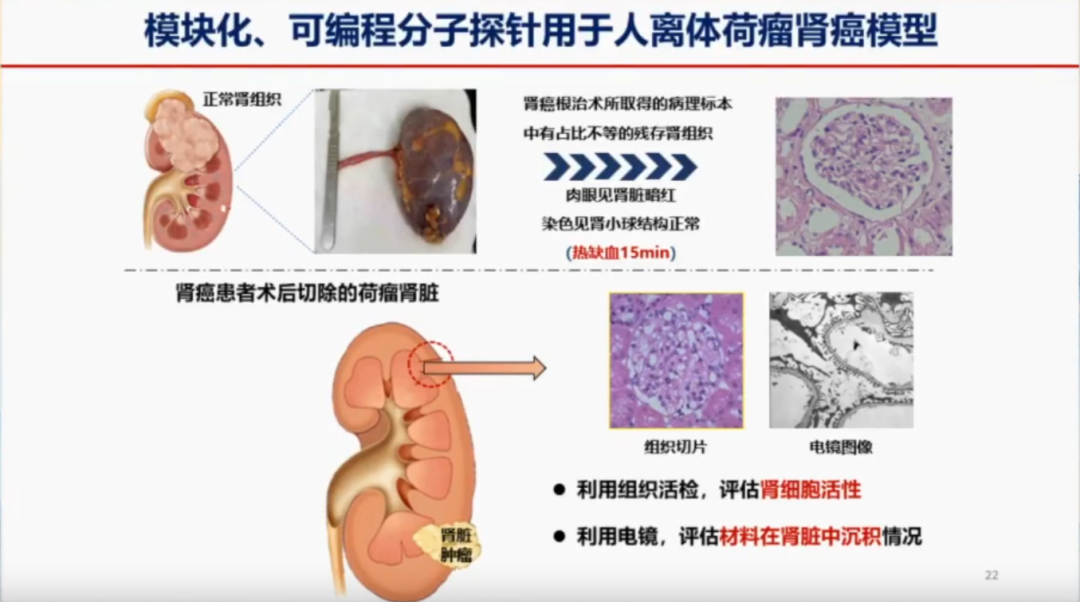
模块化、可编程分子探针在人离体荷瘤肾癌模型
为了解决纳米探针在临床应用中的安全性问题,尤其是其在人体内的潜在毒性,徐教授团队开展了模块化、可编程分子探针在人离体荷瘤肾癌模型的研究。团队通过构建体外肾脏模型,将肾脏取出后通过肾动脉注入探针,并观察其通过肾静脉和输尿管的排泄过程,以评估探针对肾脏的毒性。研究团队进一步利用电镜观察正常组织在注入生理盐水和探针后的变化,以评估肾细胞活性以及纳米材料在肾脏中的代谢情况,判断其是否会在肾脏中沉淀并对肾脏造成副作用。
这些研究是科技部重点研发项目的一部分,旨在突破纳米探针无法应用于人体的重大瓶颈问题。通过深入研究纳米探针在肾脏中的代谢和毒性机制,团队希望为纳米探针的临床应用提供更安全、有效的解决方案。
临床转化
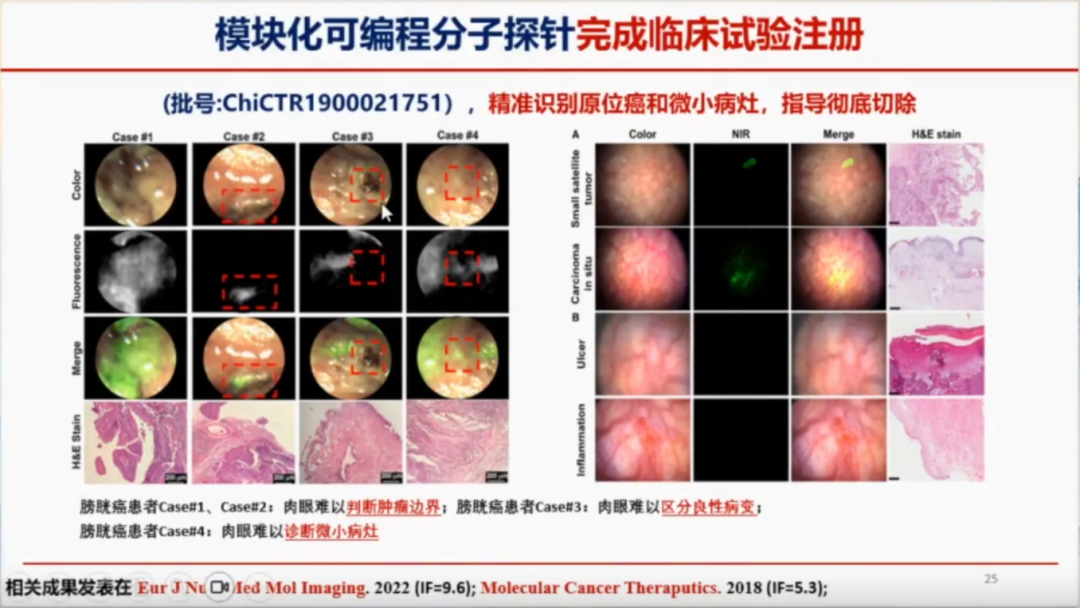
徐万海教授及其团队一直致力于临床转化研究。在膀胱肿瘤领域,他们自主研发了一种新型探针。将该探针注入膀胱后,通过观察其发光情况来判断组织是否发生癌变。一旦发现发光区域,团队通常会进一步进行 HE染色以确认诊断。在实验过程中,他们发现,使用近红外膀胱镜可以清晰地识别出膀胱内的病变部位。然而,当时无论是国内还是国外,都尚未有专门的膀胱镜可用于此类实验。
鉴于此,徐万海教授团队又在国内研发了一种近红外膀胱镜,用于精准识别微小癌、原位癌,并指导彻底切除病变组织。他们对整个膀胱的病理情况进行了全面分析,包括炎症溃疡、原位癌和肿瘤等。通过近红外成像技术,发现其成像效果与实际病理情况高度吻合。
此外,徐万海教授团队还在相关学术杂志上发表了关于模块化可变分子探针的研究成果。目前,他们的探针已经成功申报了IND(Investigational New Drug,新药临床试验申请)。
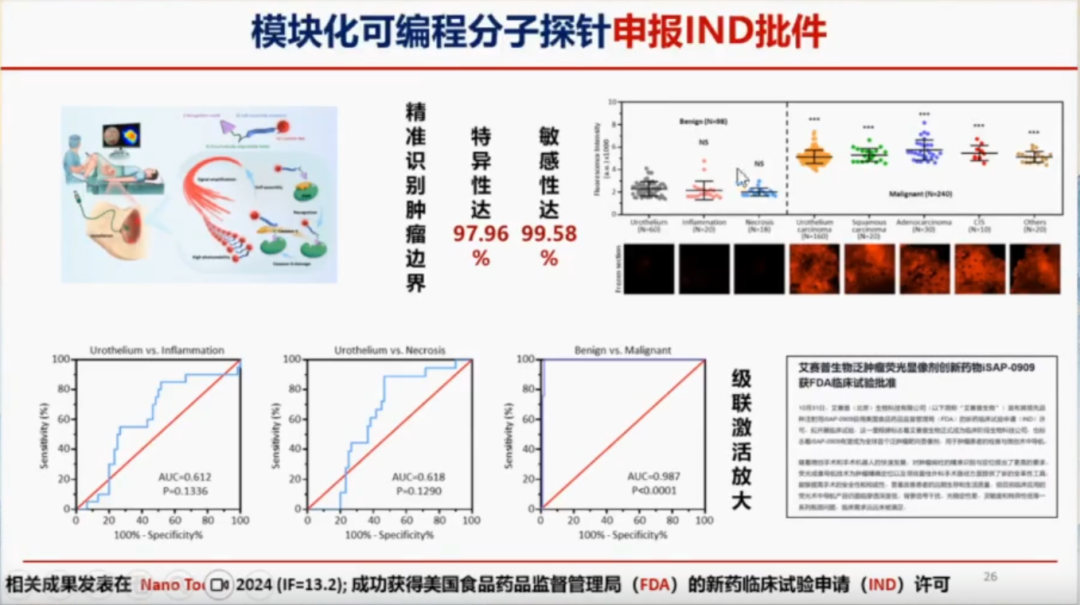
在动物实验中,他们发现,良性组织,无论是上皮组织、炎症组织还是坏死组织,均无成像表现;而恶性组织,包括原位癌、腺癌、鳞癌等,均能清晰成像。该研究成果发发表在《European Journal of Nuclear Medicine and Molecular Imaging》2022年(影响因子IF=9.6)和《Molecular Cancer Therapeutics》2018年(影响因子IF=5.3)。
2023年,徐万海教授当选为医工整合委员会的首任主委,致力于推动国内医工整合的交叉合作,团队成员遍布各地。在新设备研发方面,他们深知探针合成是关键,而设备研发则相对滞后。由于国内没有现成的近红外膀胱镜,徐万海教授团队与迈瑞合作,成功研发了国际首台近红外膀胱镜。这一成果填补了国内空白,为后续的临床试验奠定了基础。目前,该膀胱镜的样机已经完成,并开始申报临床试验等相关工作。


本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言












#分子影像# #肿瘤精准诊疗#
5