ACS Nano:四川大学李为民团队构建铂聚合物功能化氧化锰纳米粒增强肺癌化学免疫治疗效果
2025-01-15 iNature iNature 发表于陕西省
四川大学李为民团队开发了pH/氧化还原双重响应的DHP/MnO₂NP,可释放顺铂和Mn²⁺协同放大STING激活,体外诱导肿瘤细胞损伤等,体内激活STING增强抗癌效果,为癌症治疗提供新平台。
干扰素基因刺激剂(STING)通路在重塑免疫抑制性肿瘤微环境和启动抗肿瘤免疫方面表现出巨大潜力。然而,如何有效激活STING并避免全身给药后出现毒性副作用仍具有挑战性。
2025年1月7日,四川大学李为民唯一通讯在ACS Nano在线发表题为“Platinum(IV)-Backboned Polymer Prodrug-Functionalized Manganese Oxide Nanoparticles for Enhanced Lung Cancer Chemoimmunotherapy via Amplifying Stimulator of Interferon Genes Activation”的研究论文。开发了具有pH/氧化还原双重响应特性的铂(IV)主链聚合物前药包覆的氧化锰纳米颗粒(DHP/MnO2NP),可精确释放顺铂和Mn2+并协同放大STING激活。
体外实验中,作者证明了DHP/MnO2NP可有效诱导肿瘤细胞DNA损伤并渗入细胞质,与Mn2+协同促进STING激活并上调促炎细胞因子的表达。此外,DHP/MnO2NP可以选择性地释放顺铂和Mn2+介导肿瘤杀伤,同时降低对正常细胞的毒性。体内研究表面,DHP/MnO2NP通过激活STING和启动强大的抗肿瘤免疫来提高治疗效果。具体来说,DHP/MnO2NP使肿瘤相关巨噬细胞偏向促炎表型,相对于对照组,肿瘤中促炎细胞因子的表达上调高达99倍,CD8+ T细胞的浸润也显著增加。当STING信号被阻断时,DHP/MnO2NP的抗肿瘤作用和免疫刺激效果受到显著抑制。此外,DHP/MnO2NP具有增强肿瘤归巢和保留的优势,从而产生更强和更持久的抗癌效果。总体上,DHP/MnO2NP为增强癌症化学/免疫治疗提供了平台,并有望实现精准治疗。

免疫疗法在治疗肺癌方面前景广阔,尤其是对于晚期患者。免疫检查点抑制剂的临床应用将晚期非小细胞肺癌患者的5年生存率从5%提高到30%。然而,由于免疫抑制性肿瘤微环境,免疫治疗只对约20%的患者有效。研究表明,干扰素基因刺激物(STING)已成为重塑肿瘤免疫微环境的潜在靶点。STING是一种细胞质模式识别受体,充当细胞质DNA的免疫传感器。细胞质中与损伤相关的DNA首先被环状GMP-AMP合酶(cGAS)识别,然后催化2′,3′-环状GMP-AMP(cGAMP)的产生。cGAMP作为第二信使,可与STING结合并诱导干扰素调节因子3(IRF3)和核因子-κB(NF-κB)的转录激活,最终导致I型干扰素和其他促炎细胞因子的产生,从而启动有效的抗肿瘤免疫。基于此,已经开发了环二核苷酸(CDN)等STING激动剂,以在各种类型的癌症中诱导抗肿瘤免疫反应。临床前研究表明,STING激动剂在肿瘤治疗方面潜力巨大。然而,由于STING激动剂存在膜不渗透性和代谢不稳定等缺点,其有限的免疫刺激功效和不良毒性影响了临床应用。因此,迫切需要设计更有效的STING激动剂及其递送策略。
已知顺铂等化疗药物通过触发DNA损伤来诱导肿瘤细胞死亡,其中与损伤相关的DNA片段可泄漏到细胞质中并激活cGAS-STING信号通路。同时,Mn2+在细胞质DNA诱导的cGAS-STING激活中起放大作用。具体来说,Mn2+可以直接与cGAS结合以提高其酶活性和对细胞质DNA的敏感性,即使在低浓度DNA存在的情况下,cGAS也能催化cGAMP的产生。基于此,作者假设DNA损伤化疗药物与Mn2+的组合可能通过放大STING激活协同提高抗肿瘤疗效,实现化学免疫治疗协同作用。然而,这些化疗药物和Mn2+存在以下缺点:(1)半衰期短,瘤内积累不良导致生物利用度低;(2)非特异性摄取引起的全身毒性;(3)由于其药代动力学差异,时空协同作用有限。需要开发一种能够同时增加化疗药物和Mn2+在肿瘤部位的累积并降低全身毒性的递送策略。
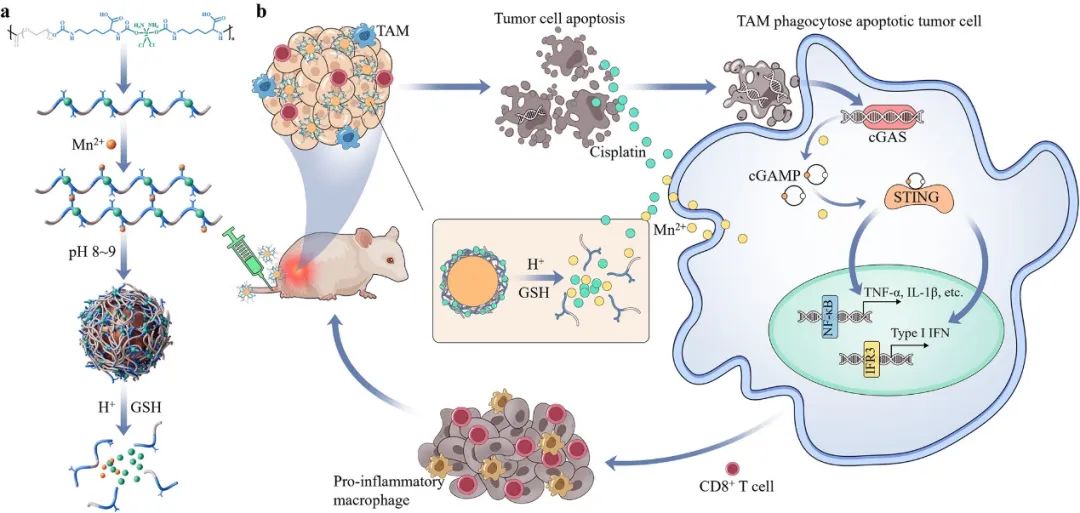
图1 pH/氧化还原双响应DHP/MnO2NP增强癌症化学免疫治疗示意图(摘自ACS Nano)
与生理环境(pH∼7.4)相比,肿瘤细胞外环境(pH∼6.5)和细胞内内体和溶酶体(pH4-6)的酸性更强,肿瘤细胞外环境(∼1mM)和细胞质(∼10mM)中谷胱甘肽(GSH)的浓度显著高于生理环境中的谷胱甘肽(GSH)浓度(∼0.1mM)。因此,肿瘤细胞外和细胞内响应性纳米药物因其改善肿瘤内蓄积、实现同步递送和避免全身毒性等优势而成为潜在的联合治疗平台。该研究开发了一种具有pH/氧化还原双重响应性的新型铂(IV)骨架前药包覆的氧化锰(MnO2)纳米颗粒(DHP/MnO2NP),以实现顺铂和Mn2+的结合。
DHP/MnO2NP可以在肿瘤微环境中精确释放顺铂和Mn2+,并协同放大STING活化,增强肿瘤化学免疫治疗效果。通过一锅法聚合和弱碱水解合成了富含羧基的铂(IV)骨架聚合物前药P(DHP-PEG)。随后,以P(DHP-PEG)为涂层,在弱碱性条件下制备二氧化锰纳米粒子。pH/氧化还原双重响应的DHP/MnO2NP具有以下优点,可以提高其抗癌功效,同时降低全身毒性:(1)通过增强的渗透性和滞留(EPR)效应增加肿瘤中的药物蓄积。(2)表面聚乙二醇化可以减少网状内皮系统的非特异性摄取,实现血液长循环,进一步增强肿瘤EPR效应,减少药物在正常器官中的蓄积,从而降低毒性。(3)肿瘤微环境(pH∼6.5,∼1mM GSH)响应性去聚乙二醇化和表面电荷由负转正可增强肿瘤细胞对DHP/MnO2NP的摄取。
参考消息:
https://pubs.acs.org/doi/10.1021/acsnano.4c15115
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言













#肺癌# #化学免疫治疗#
36