Nature 子刊:骨肉瘤潜在治疗靶点:RNA结合蛋白
2024-07-23 儿童肿瘤前沿 儿童肿瘤前沿 发表于上海
研究通过分析骨肉瘤细胞中 RNA 结合蛋白,发现其系统性变化,揭示其在骨肉瘤发生发展中的作用,包括对翻译抑制的敏感性及正反馈循环,为治疗提供潜在靶点。
骨肉瘤(OS)是常见于儿童和青少年的一种原发恶性骨肿瘤,具有强烈的转移倾向,对患者预后的限制很大。尽管多组学分析已证明OS具有极高的分子复杂性,但目前发现有前景的治疗靶点仍十分有限。
对OS基因组图谱的广泛研究表明其基因组具高度不稳定性,存在有大量结构变异,然而基因组异常不能完全反映癌症的致病性。转录后基因调控因其在癌症分子机制中发挥的作用逐渐受到重视。RNA结合蛋白(RBPs)通过控制RNA代谢的各个方面控制转录后基因调控,RBPs的改变与肿瘤发展的每一个标志都有关联。越来越多研究显示RBPs具有作为肿瘤治疗靶点的潜力,但它们在OS中的作用尚未被研究。
近日,由 Andreas E. Kulozik和 Matthias W. Hentze 团队发表于 Nature Communications 题为 Systematic analysis of RNA-binding proteins identifies targetable therapeutic vulnerabilities in osteosarcoma 的文章, 通过捕获RNA互作组并联用多组学技术,确定了骨肉瘤细胞中RBP的系统性变化,发现了侵袭性骨肉瘤细胞对翻译抑制的敏感性,并提出RBP IGF2BP3和转录因子Myc的正反馈循环通过影响细胞翻译和骨肉瘤细胞的活性,从而影响骨肉瘤的发生发展。

为确定OS患者来源的细胞和正常细胞的RNA相互作用,研究团队首先通过增强的RNA互作组捕获法eRIC (enhanced RNA Interactome Capture)来捕获OS及其正常间充质细胞(MSC)和成骨细胞(OB)的RNA相互作用(过程如下图1所示)。
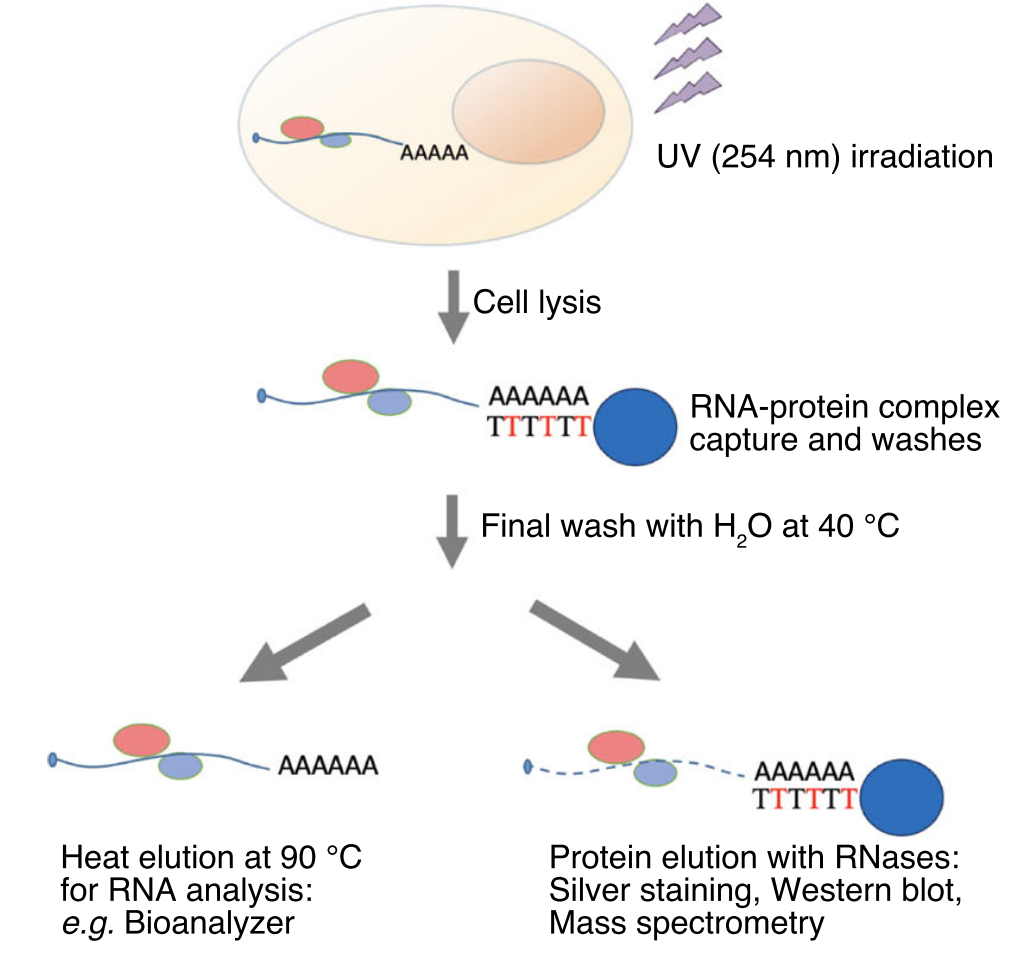
图1 由eRIC捕获RNA互作组的示意图(红色的”T”代表LNA胸腺嘧啶核苷)
结果显示,从所有研究的细胞(OS、OB、MSCs)中共鉴定出593个RBPs,其中583个RBPs是所有研究细胞所共有的(下图2所示),33个RBPs仅在骨/间充质细胞-RNA互作体中出现。总体而言,OS与非恶性的骨/间充质细胞间的RNA相互作用显示出很大的重叠,但同时也表现出显著的数量差异,这些差异特征化了骨肉瘤的肿瘤特异性RNA互作体。
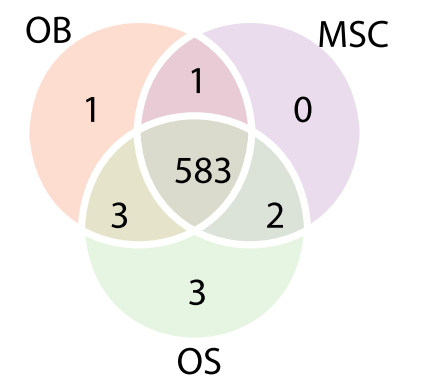
图2 Venn图显示了在OB、MSC和OS的RNA互作中发现的RBP的重叠情况
研究者对OS和它们的正常对应物(OB/MSCs)的RNA互作进行比较分析,结果显示,与成骨细胞相比,骨肉瘤的RNA互作体与间充质干细胞(MSCs)更为相似(下图3所示),表明骨肉瘤可能起源于骨发育早期的细胞系。研究者发现有几个蛋白质已被证明在其他类型的癌症中发挥潜在的肿瘤抑制作用,包括ANXA731、RBMX32和HDLBP35等。此外,mRNA的异常剪接在OS中也发挥一定的作用。
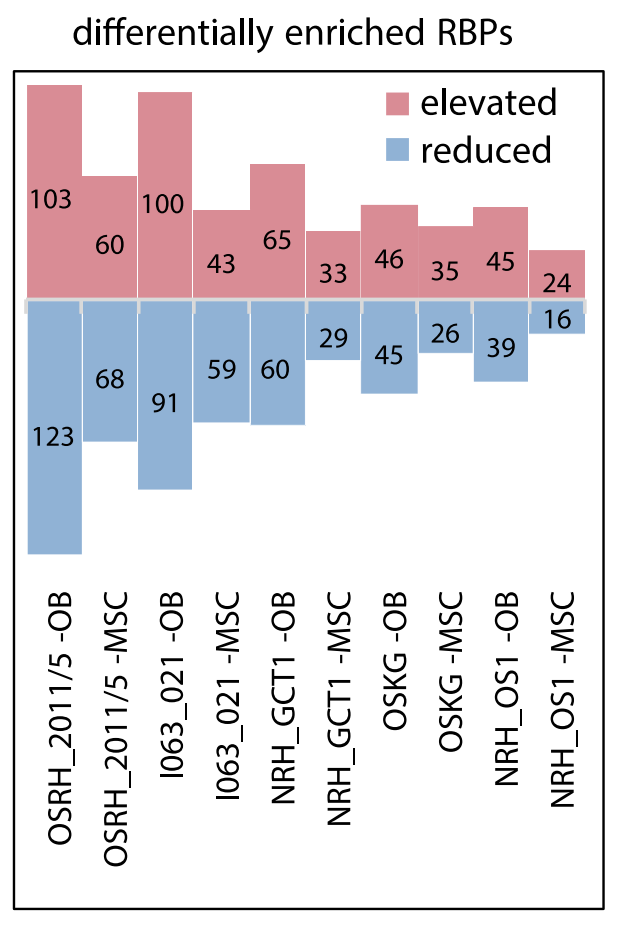
图3 条形图显示与OB相比OS显著改变的RBP的数量(上升的和减少的RBP数量分别用粉色和蓝色表示)
进一步的GO分析显示,细胞质翻译相关蛋白,包括核糖体蛋白、翻译起始和翻译终止因子在更具侵袭性的OS中升高更明显(图4b),表明OS细胞中的整体翻译更活跃。另外,与OB相比,线粒体翻译相关蛋白(已知其在维持干细胞干性中发挥重要作用)在MSCs的互作组和全蛋白组中表达更为丰富(图4a)。此外,还有几种具有不同RNA结合活性的翻译相关RBPs主要通过RNA修饰来调节选择性RNA的稳定性和翻译过程,如IGF2BP家族蛋白(IGF2BP1和IGF2BP3),及Y-box蛋白(YBX1和YBX3)(图4b),大多数与肿瘤发生有关,通常作为癌症的标志之一。其中,IGF2BP3被发现是RNA互作组中含量最丰富的RBP。
此外,研究者发现在更具临床侵袭性的OS中,参与RNA翻译和代谢的RBPs的富集可能为这些骨肉瘤提供了更多以翻译和RNA代谢为中心的基因表达程序(图4c、d)。总之,在骨肉瘤中,致癌基因翻译相关的RBPs的表达都得到了增强,尤其是发展为多灶骨、肝和纵隔转移的更具侵袭性的骨肉瘤。
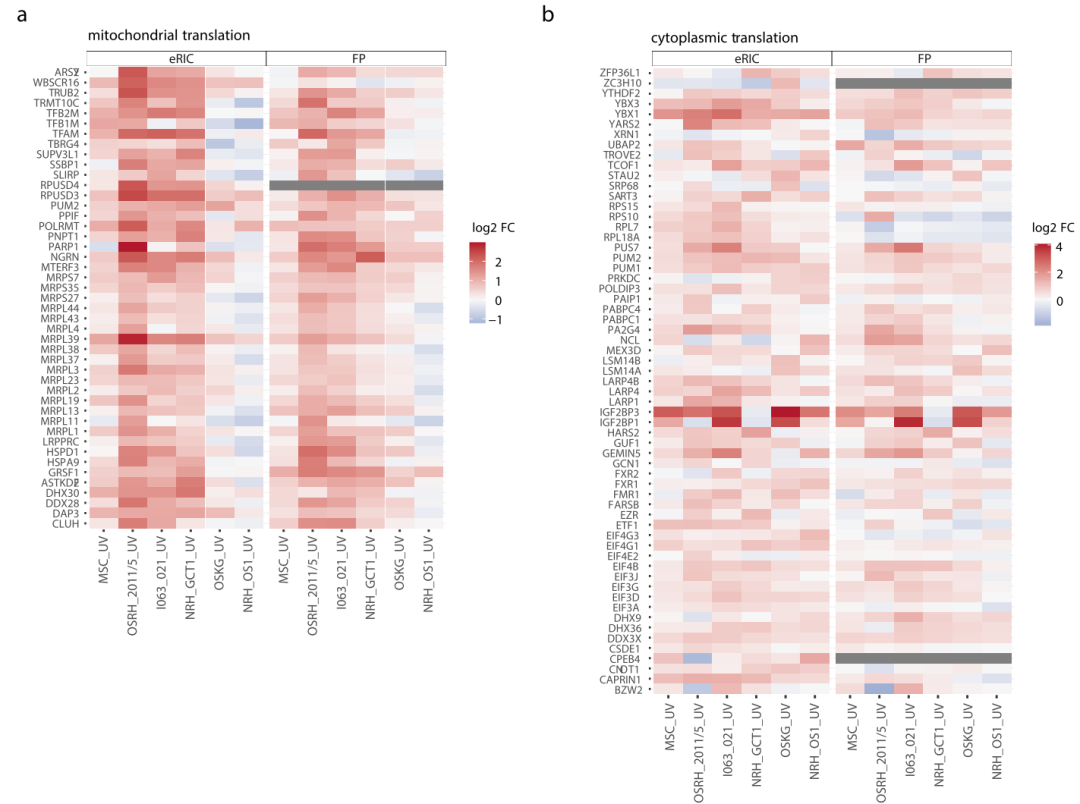
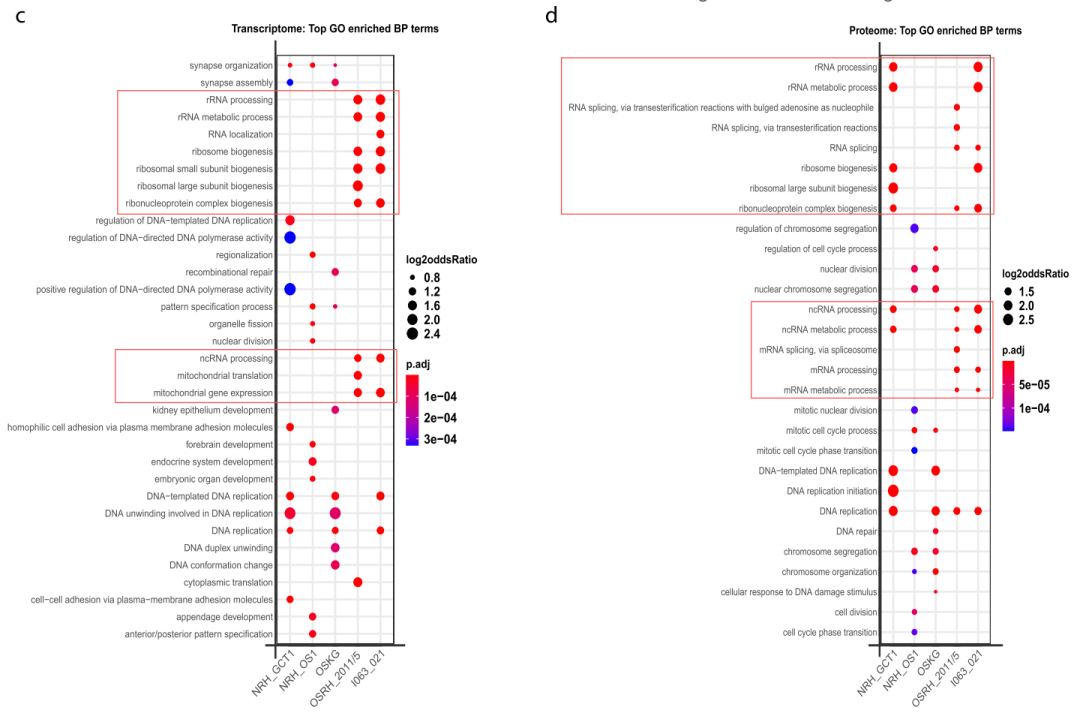
图4 热图显示线粒体相关蛋白(a)和细胞质翻译相关蛋白(b)的相对RBP丰度,比较了肉瘤和成骨细胞在RNA互作组和全蛋白质组中的差异;GO分析显示与成骨细胞相比,OS在转录组(c)和蛋白组(d)中显著上调的基因
通过使用代谢标记测量全蛋白质合成,研究者发现与侵袭性较弱的OS相比,临床侵袭性骨肉瘤显示出更高的蛋白质合成水平,且更容易受到翻译的抑制。因此,研究者使用高三尖杉酯碱(HHT),一种FDA已批准用于治疗慢性粒细胞白血病的翻译抑制剂,来进一步探究OS对翻译抑制的响应情况。结果显示HHT能有效抑制OS细胞的蛋白质合成,且以剂量依赖的方式降低细胞活力,其中在降低“翻译饥饿”OS细胞的活性方面更有效(图5)。总之,研究者发现骨肉瘤的RNA互作组在不同肿瘤间存在异质性,更具侵袭性的肿瘤表现出对翻译抑制的高度敏感性。
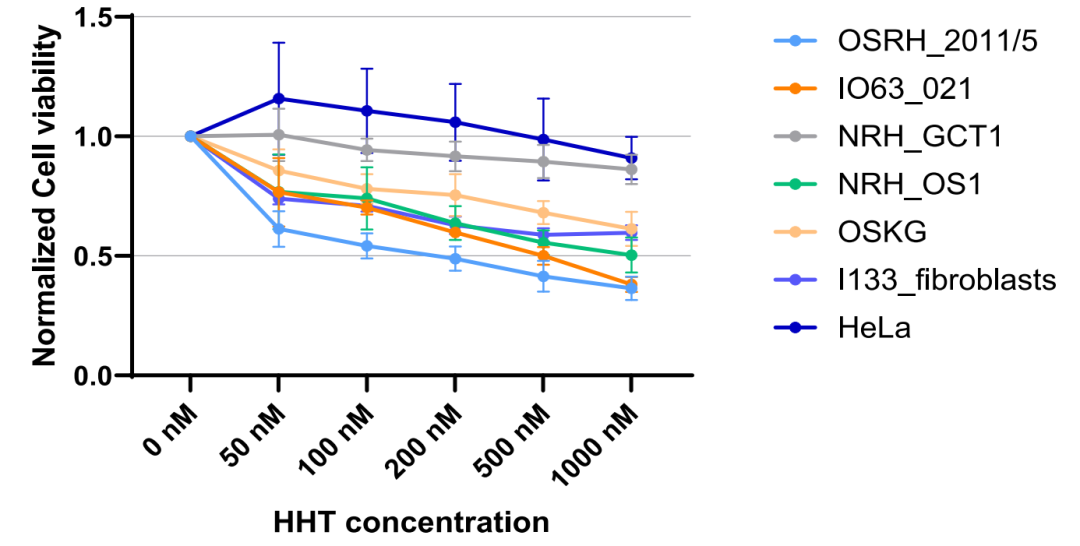
图5 用Celltitre-Glo比色法测定HHT(0-1000 nm)处理24小时后的细胞存活率
此外,研究者先前已证实IGF2BP3是侵袭性骨肉瘤RNA互作体中富集最多的RBP,其高水平表达与OS的转移相关,并受转录因子Myc的调控。通过一系列细胞和蛋白水平的实验验证,研究团队提出了IGF2BP3和Myc之间的正反馈循环,这在具高度活跃翻译特征的骨肉瘤中构成一种致癌特征。IGF2BP3能够增强Myc mRNA的稳定性和翻译,而Myc则能够增强IGF2BP3 mRNA的转录(图6),这一循环能够影响骨肉瘤细胞的翻译和生存能力。并且,此前已有研究证实IGF2BP3和Myc之间的正反馈环路可促进神经母细胞瘤细胞的增殖。
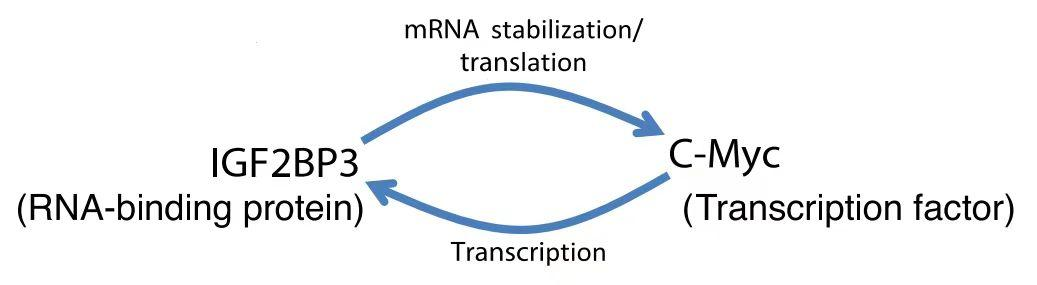
图6 示意图描绘了IGF2BP3和Myc之间的正反馈环(其中IGF2BP3增强了c-Myc mRNAs的稳定和翻译,而c-Myc促进了IGF2BP3 mRNA的转录,导致两种蛋白的表达增加)
最后,研究人员还发现了一些在OS中特异性变化的RBPs,这些RBPs可能成为个性化治疗的潜在靶点。例如,PARP1在骨肉瘤中的RNA结合活性显著增强,这可能解释了为什么PARP抑制剂在某些骨肉瘤细胞中表现出更强的抑制效果,即使这些细胞并不缺乏同源重组修复能力(PARP抑制剂目前已成为针对同源重组修复缺陷的肿瘤细胞的一种有前途的治疗策略)。
综上所述,研究团队通过深入分析骨肉瘤中的RNA结合蛋白,揭示了它们在OS发生、发展中的重要作用,为基于RNA生物学的理论基础针对性地开发新的治疗策略提供了潜在的靶点。通过对RNA互作体的系统性研究,不仅增进了研究者对OS分子机制的理解,还识别出潜在的新型治疗方案,特别是针对那些具有高度活跃翻译的特征的OS。未来可通过靶向RBP以干预IGF2BP3和Myc之间的正反馈回路进行深入研究,以提高骨肉瘤患者的治疗效果和生存质量。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言


















#骨肉瘤# #RNA结合蛋白# #治疗靶点#
101