新辅助早期乳腺癌:组织WES+血液ctDNA定制panel监测复发,特异性100%,超一年提前预警
2025-03-22 苏州绘真医学 苏州绘真医学 发表于陕西省
研究评估高灵敏度tumor-informed的ctDNA检测在EBC患者NAT中的应用,发现基线ctDNA检出率高,其动态变化与复发相关,术后或随访时检测到ctDNA阳性预测值100%。
循环肿瘤DNA(ctDNA)是一种新兴的用于早期乳腺癌(EBC)治疗的生物标志物。本研究试图在一个接受新辅助治疗(NAT)的真实世界患者队列中评估一种高灵敏度的基于肿瘤信息(tumor-informed)的ctDNA检测方法,以评估其临床有效性并探索预后结果。在基线时,77.2%(88/114)的参与者检测到了ctDNA,其中18/88(20.5%)的基线估计变异等位基因频率(eVAF)<0.01%。在NAT中期检测到持续存在的ctDNA与所有参与者的疾病复发相关,在HER2阴性疾病的患者中达到了统计学显著水平。分层分析表明,在NAT中期检测到的ctDNA提高了残余癌症负荷(RCB)评分对疾病复发的预后准确性。术后或随访期间检测到ctDNA对疾病复发具有100%的阳性预测值,中位提前期为374天(范围:13-1010天)。这些数据表明,具有高分析灵敏度的检测方法可以改善EBC患者的基线ctDNA检测。在真实世界队列中重现ctDNA动态与预后之间的关联的能力,支持进一步的研究。有必要开展纳入ctDNA检测的前瞻性试验,以评估和开发ctDNA指导的治疗策略的临床应用价值。
研究背景
在那些具备常规筛查项目的地区,大多数乳腺癌在局限于乳房内(不论是否累及局部区域淋巴结)的早期阶段就得以确诊(即早期乳腺癌,EBC)。许多被诊断为早期乳腺癌的患者会接受新辅助全身治疗(NAT),通常是以多药联合化疗的形式,可能会联合或不联合靶向治疗,且是基于常规临床和病理因素,按照风险适应性策略来实施的。术前化疗可通过影像学和病理评估来评估肿瘤反应。接受这种治疗后达到病理完全缓解(pCR)与良好的预后相关,而通过如残余癌症负荷(RCB)等量表衡量得出的残余疾病水平越高,则与复发风险增加相关。虽然通过病理评估的残余疾病情况可为后续辅助全身治疗的实施提供依据,但目前尚无用于早期识别对治疗反应欠佳或较差的癌症的标准生物标志物,而这类生物标志物本可以帮助医生决定是否升级治疗方案或改变治疗策略。此外,尽管在随访过程中检测到的ctDNA与接受根治性治疗的患者的复发相关,但必须明确单个检测方法的特点,以开发其临床应用价值。
液体活检能够识别、定量并表征外周血中源自肿瘤的DNA片段(即循环肿瘤DNA,ctDNA)。在许多癌症中,ctDNA水平的变化(ctDNA动态变化)与治疗反应相关;在接受根治性治疗后检测到ctDNA与疾病复发相关。目前存在多种ctDNA检测方法,它们在技术手段和灵敏度水平上各不相同。明确相关检测方法的临床有效性和预后评估能力,对于了解其潜在的临床应用价值、在未来临床试验中的定位以及常规患者护理中的应用都非常重要。为了解决这一问题,研究者试图评估一种高灵敏度(检测限,LoD 95%:0.001%)的tumor-informed检测方法的特点。研究者评估了一个接受标准NAT的大型真实世界早期乳腺癌(所有受体亚型)患者队列。在此,研究者展示的数据包括评估基线时的检测灵敏度、新辅助治疗期间ctDNA动态变化的评估、探索其与临床结局的关系,以及评估在辅助治疗阶段对ctDNA的连续监测以预测疾病复发的情况。
研究方法
从标准诊断活检和/或有残留病变的手术切除中获得的福尔马林固定石蜡包埋(FFPE)肿瘤组织被确定,以满足检测方法开发的要求。进行病理审查以评估肿瘤总体细胞含量,并确保有足够的组织用于提取基因组DNA(gDNA),目标是使肿瘤含量达到20%-80%。所有存档组织都被提取 DNA 并进行全外显子测序(WES)。在基线、治疗期间、围手术期以及与常规标准临床就诊相关的随访期间采集系列血液样本。手术后,根据主治医生的决定,大约每 6-12 个月采集一次血液样本。每个时间点大约 4 毫升的血浆和 1.5 毫升的基线血沉棕黄层分别用于提取游离 DNA(cfDNA)和对照基因组 DNA。
基线时间点定义为在开始新辅助治疗之前的任何时间采集的样本。术前时间点定义为在化疗完成后、手术前采集的样本。术后时间点定义为在参与者乳腺癌根治性手术后 60 天内采集的样本。辅助治疗或随访时间点定义为在参与者初次手术后 60 天以上采集的样本,无论是否已开始辅助治疗。
无复发生存期(RFI)定义为从浸润性乳腺癌的病理诊断到浸润性乳腺癌局部或远处复发,或发生新的原发性浸润性乳腺癌的时间。在最后一次随访时未出现复发的参与者在其最后一次随访日期进行截尾处理。第二周期(C2)前样本定义为在新辅助治疗第二周期之前采集的样本。新辅助治疗中期样本定义为在预先确定的新辅助治疗中途点之前采集的样本 [即多西他赛和环磷酰胺治疗方案的第 3 周期前;蒽环类和紫杉类治疗方案的第 5 周期前]。
研究结果
队列确定和检测指标:
从2016年10月至2021年1月招募的142名参与者被确定用于分析(图1)。11名参与者因缺乏足够的基线肿瘤组织用于提取基因组DNA(gDNA)和进行全外显子测序(WES,检测要求)而被排除。在93%(122/131)的参与者中成功生成了检测结果(图1)。有3名已设计好检测panel的参与者在治疗过程早期(手术前)被发现发生了转移性疾病,因此被排除在主要分析之外。119名参与者有可评估的数据,并被纳入主要队列进行分析(表1)。
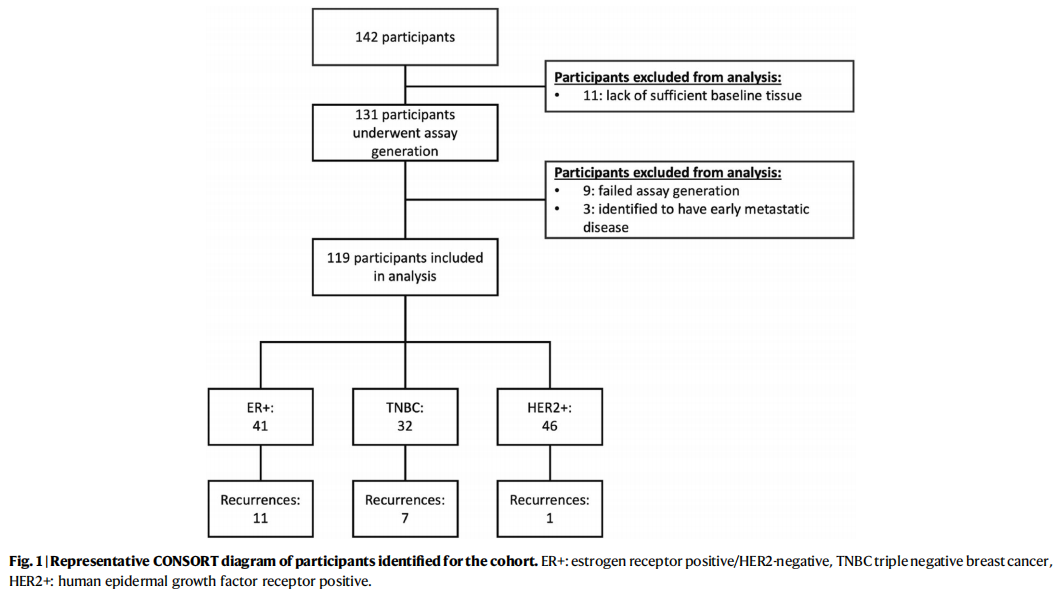
图1
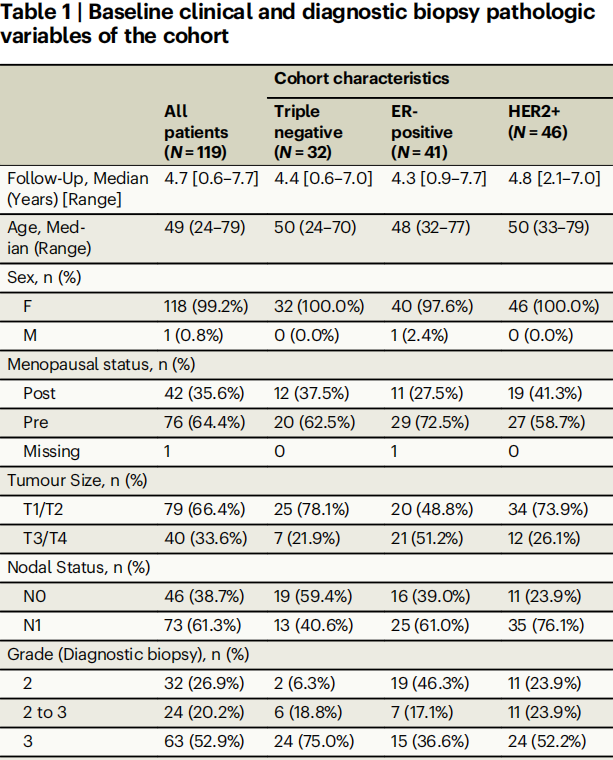
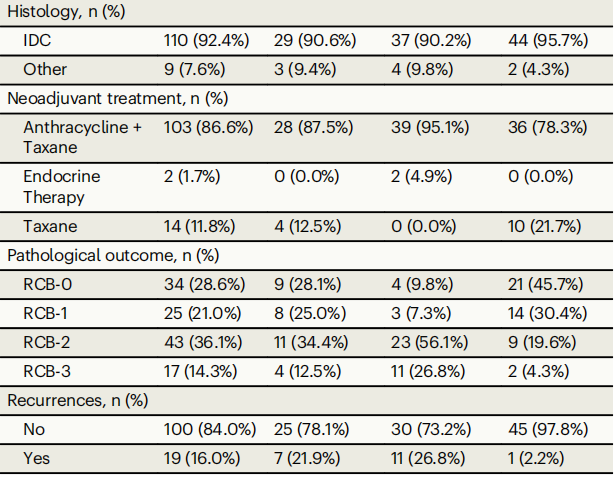
表1
纳入分析的119名参与者的WES覆盖度中位数为246x(范围:21x–711x)。基于此,为每位参与者设计了个性化的检测panels,每个panel的变异位点中位数为48个(范围:22–53)。在这些识别出的变异位点中,中位数为39个(范围:8–49)通过了检测panel的质量控制指标,其中包括排除在血沉棕黄层中检测到的变异位点。这些最终确定的检测panels被用于评估从每个血浆时间点提取的cfDNA中是否存在ctDNA。
队列特征:
在纳入主要分析的119名参与者中,118名是女性,64.4%为绝经前女性(表1)。诊断时的中位年龄为49岁(表1;范围:24–79岁)。在这119名参与者中,46名(38.7%)为HER2+,41名(34.4%)为ER+/HER2-,32名(26.9%)为三阴性乳腺癌(TNBC)。119名参与者中有103名(86.6%)接受了以蒽环类和紫杉类药物为基础的序贯新辅助化疗,其中大多数人先接受了剂量密集型阿霉素+环磷酰胺治疗,随后接受了剂量密集型紫杉醇治疗,部分患者联合或不联合抗HER2抗体治疗(表1)。从诊断开始的中位临床随访时间为4.7年(范围:0.6–7.7年)。截至数据截止日期,已发生19例复发(1例局部复发,18例远处复发)(11例ER+,7例TNBC,1例HER2+)(图1)。
临床特征和基线ctDNA检测:
总共对681个单独的血浆时间点(中位数:每位参与者6个,范围:1–12个)进行了ctDNA存在情况的评估。在所有时间点中,24%(163/681)检测到了ctDNA,其中37%(61/163)的eVAF低于0.01%,5%(9/163)低于0.001%(图2A)。
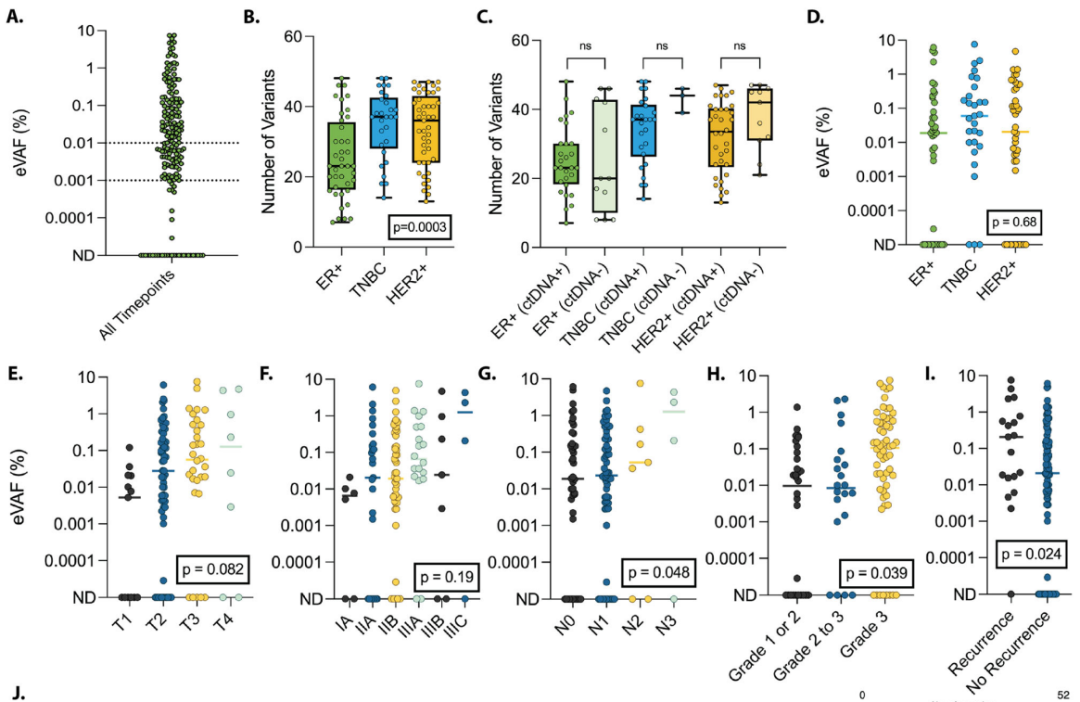
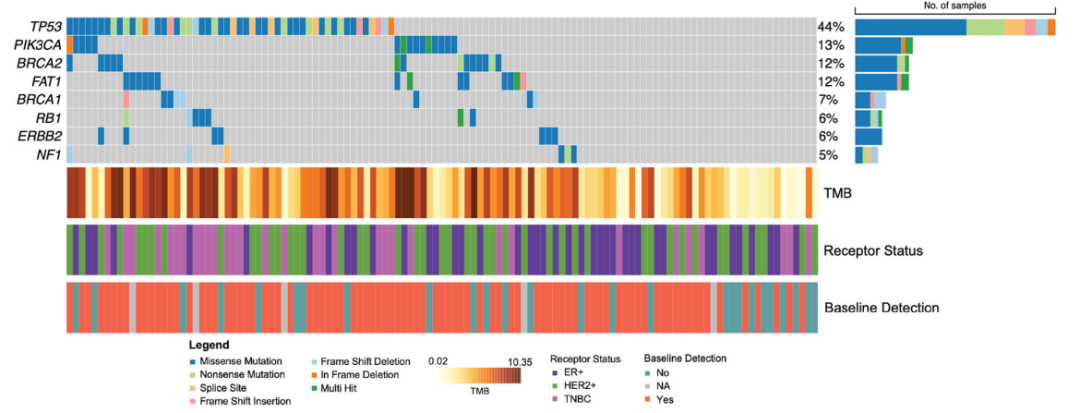

图2
与TNBC(n = 37,范围:14-48)或HER2+(n = 36,范围:13-47)患者相比,ER+患者(n = 23,范围:7-48)的panel中发现的变异较少(图2B,p = 0.0003)。尽管如此,肿瘤突变负荷(TMB,mut/Mb)在基线ctDNA检测状态方面没有差异,在ER+和HER2+亚型之间也没有差异。TNBC患者的TMB较低,基线时未检测到ctDNA,但由于病例数量较少,该分析存在局限性。在各亚型中,根据受体亚型划分,基线时检测到或未检测到ctDNA的患者组,其每个检测panel的变异位点数量没有差异(图2C)。
基线时ctDNA的总体检出率为77.2%(88/114)(表2);不同受体亚型的基线检出率有所不同:ER+患者为70.0%(28/40),TNBC患者为89.7%(26/29),HER2+患者为75.6% [34/45;HER2+/ER−:13/15(87.0%)和HER2+/ER+:21/30(70.0%)](表2,p = 0.15)。在检测到ctDNA的基线样本中,eVAF的中位数为0.0823%(图2D;范围:2.90×10-5至7.5%),其中18/88(20.5%)的患者基线eVAF低于0.01%,且这在不同临床受体亚型之间没有差异(图2D,p = 0.68)。
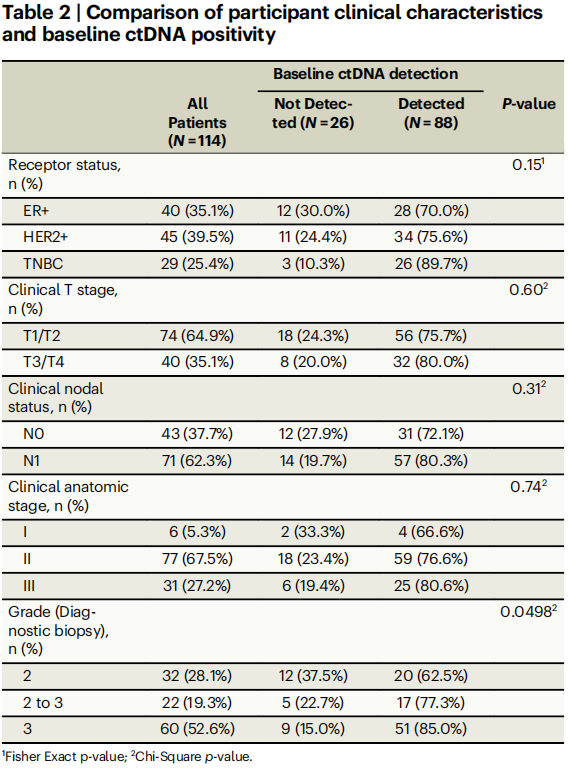
表2
基线ctDNA检测与临床肿瘤大小(表2,p = 0.60)、淋巴结受累情况(表2,p = 0.31)以及解剖学分期(表2,AJCC第八版;p = 0.74)均无关,但与诊断性活检所评估的较高Nottingham分级显著相关(表2,p = 0.0498)。基线eVAF与肿瘤大小(T分期;图2E,p = 0.082)和解剖学分期(AJCC第八版;补充图2F,p = 0.19)之间存在不显著的关联。临床淋巴结状态(N分期;图2G,p = 0.048)和诊断性活检所测量的Nottingham分级(图2H,p = 0.039)与基线时较高的eVAF相关。
除了一名患者(18/19,94.7%;低级别ER+)外,所有出现临床复发的患者在基线时都检测到了ctDNA。出现临床复发的患者的基线eVAF高于未复发的患者(图2I;p = 0.024)。
使用仅针对肿瘤的筛选策略评估了乳腺癌常见突变基因的变异情况(图2J)。常见乳腺癌基因突变的存在与基线时ctDNA的检测无关,包括TP53基因(n = 52;p = 0.20)、PIK3CA基因(n = 15;p = 1.0)和BRCA2基因(n = 14;p = 1.0)。
与治疗相关的ctDNA变化和临床结局:
基线时检测到ctDNA与较短的无复发生存期(RFI)相关(图3A;HR:2.89,95%CI:1.003–8.31,p = 0.049),尽管其灵敏度较高,但预测价值较低;基线未检测到ctDNA的患者3年无复发生存率为96.2%,而基线检测到ctDNA的患者为83.4%。在按受体亚型进行的探索性分析中,这种关联存在,但在ER+ EBC患者中无统计学意义(HR:3.03,95% CI:0.87–10.62,p = 0.083)。由于TNBC和HER2+亚组分别具有较高的基线灵敏度和缺乏复发事件,未对其进行分析。在大多数患者开始NAT后观察到ctDNA清除(第2周期前(C2)、NAT中期、术前、术后和随访)。
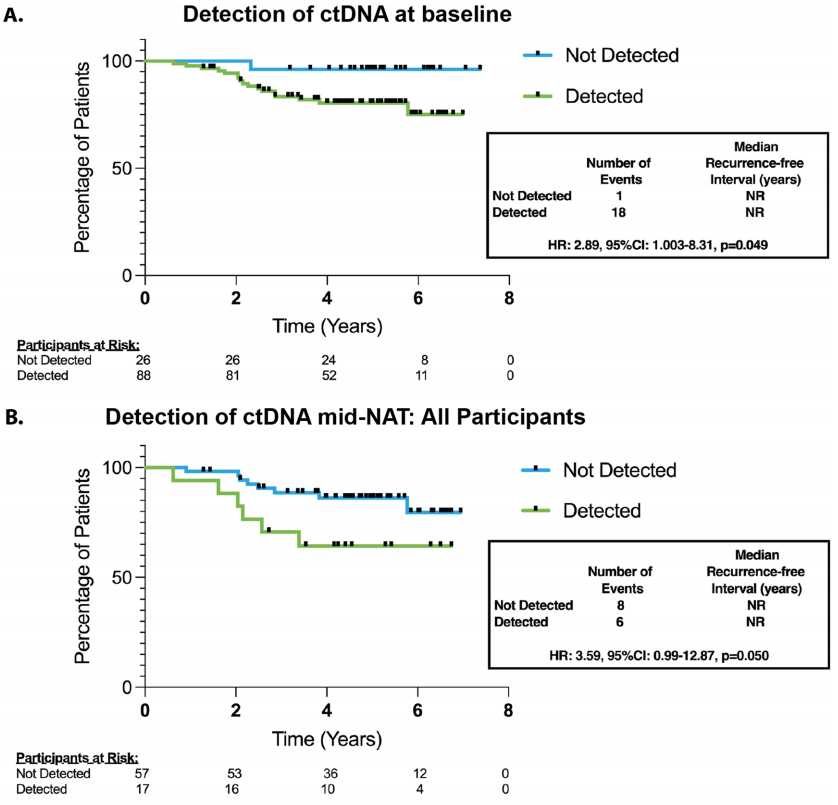
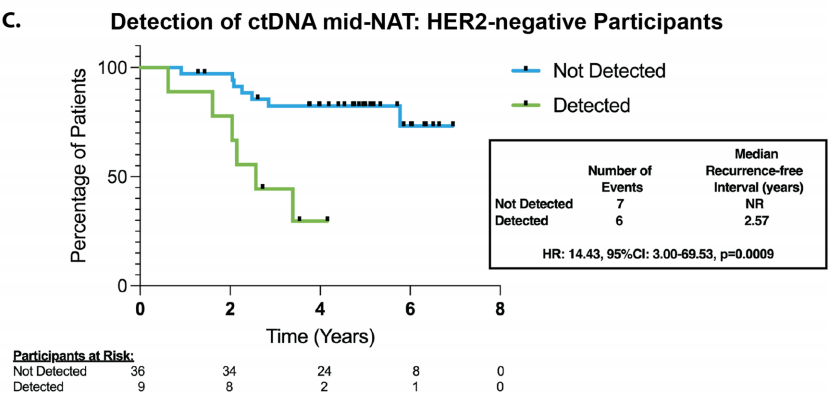

图3
评估治疗相关ctDNA清除率与疾病复发之间的关系;接受新辅助内分泌治疗的患者(n = 2,均未在基线时检测到ctDNA)被排除在这些分析之外。大多数患者早期就出现了ctDNA清除。在所有患者中,C2前持续检测到ctDNA与复发风险增加无关(HR:1.13,95%CI:0.44–2.96,p = 0.80)。然而,NAT中期持续检测到ctDNA与所有患者较差的RFI相关,14名可评估患者中有6名出现疾病复发(图3B;HR:3.59,95%CI:0.99–12.87,p = 0.050)。NAT中期ctDNA清除并不能预测残余疾病,但所有检测到ctDNA的患者手术标本中都有残余疾病(p = 0.36)。虽然NAT中期检测确定了一个高风险人群,但临床复发的阳性预测值(PPV)仅为35%(灵敏度:43%,特异性:81%)。在仅使用手术前收集的时间点进行的时间依赖性Cox回归分析中,持续检测到ctDNA与疾病复发显著相关(p = 0.001)。在NAT后半程给予抗HER2治疗可能是HER2+和HER2-患者之间的一个混杂因素。在NAT中期检测到ctDNA的患者中,47%(8/17)为HER2+,其中没有患者随后出现临床复发,而在数据截止时,67%(6/9)的HER2-患者出现了疾病复发。在排除HER2+患者的分析中,NAT中期检测到ctDNA与较差的RFI相关(图3C;HR:14.43,95% CI:3.00–69.53,p = 0.0009),PPV为67%(灵敏度:46%,特异性:91%)。无论ER状态如何,这种关联都存在。
根据RCB分层的治疗相关ctDNA变化和临床结局:
已知手术时存在残余浸润性疾病与较高的复发风险相关。在这个队列中,RCB状态对RFI具有预后意义(p = 0.0014)。为了考虑这一点,研究者使用分层分析评估了治疗相关的ctDNA变化与结局之间的关系,同时考虑了有或无残余疾病患者中的影响。
当按RCB分层时,NAT中期ctDNA检测与整个队列较差的RFI相关(图4A,p = 0.011),在HER2-疾病患者中也是如此(图4B,p = 0.0016)。RCB组之间NAT中期ctDNA阳性率相似(NAT中期检测到ctDNA vs. 未检测到ctDNA:RCB-1组:18% vs. 82%,RCB-2组:19% vs. 81%,RCB-3组:23% vs. 77%)。没有ER+或TNBC且RCB-0疾病的患者在NAT中期检测到ctDNA;截至数据截止时,这些患者中没有出现临床复发。在按受体亚型进行的分层亚组分析中,ER+(p = 0.084)和TNBC(p = 0.017)患者中,残余疾病与NAT中期ctDNA检测之间的关联仍然存在。
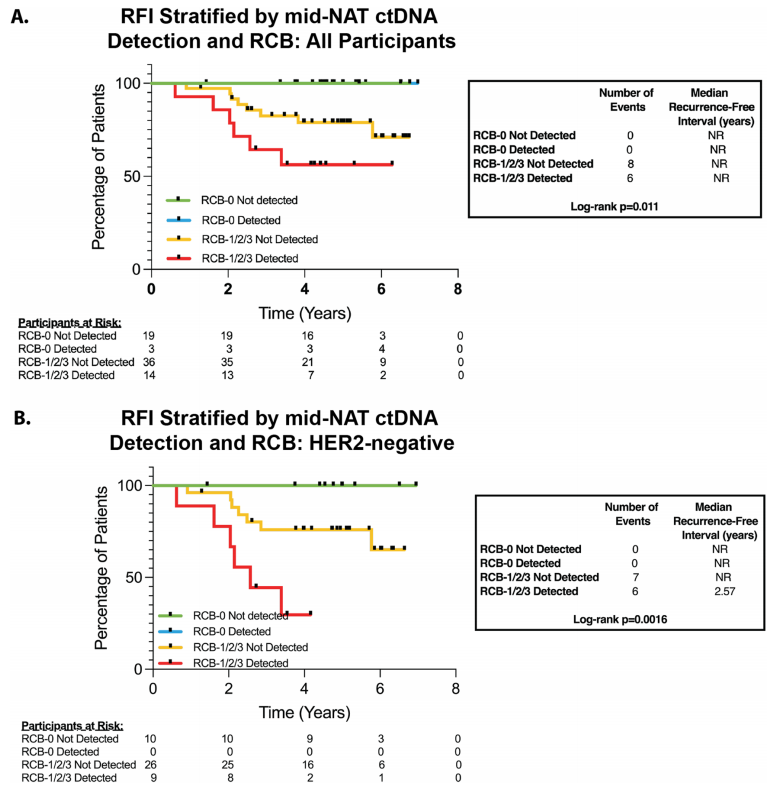

图4
由于HER2+队列中复发数量有限(仅1例复发,怀疑为新的原发性肿瘤,如下所述),未对该队列中ctDNA动态变化与复发之间的关联进行探索。
标志性的术后及随访ctDNA检测与临床结局:
提供了按受体亚型划分的代表性泳道图,展示了每个纵向收集的血浆时间点的ctDNA状态(图5A–C)。很少有患者(5/119,4.2%)在围手术期时间点检测到ctDNA;然而,所有检测到ctDNA的患者都存在残余疾病。手术后,两名患者(ER+)在术后时间点检测到ctDNA,这两名患者随后都出现了临床复发(图5A)。在术前时间点(NAT后)检测到ctDNA的三名患者中,有两名随后出现了临床复发(图5A、B)。没有HER2+疾病的患者在围手术期时间点检测到ctDNA(图5C)。
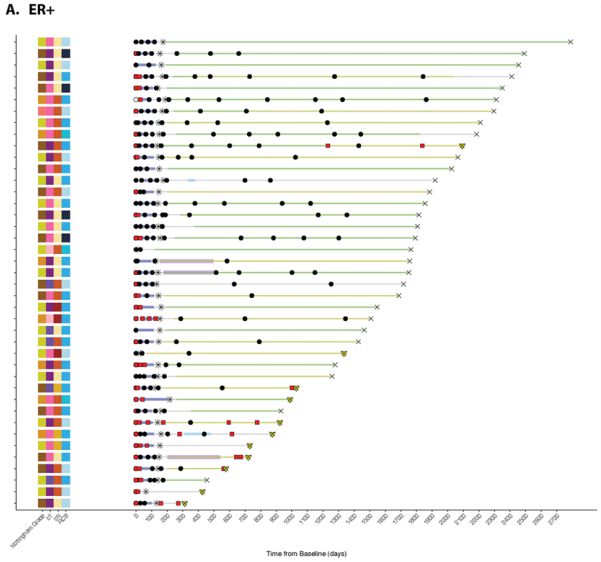
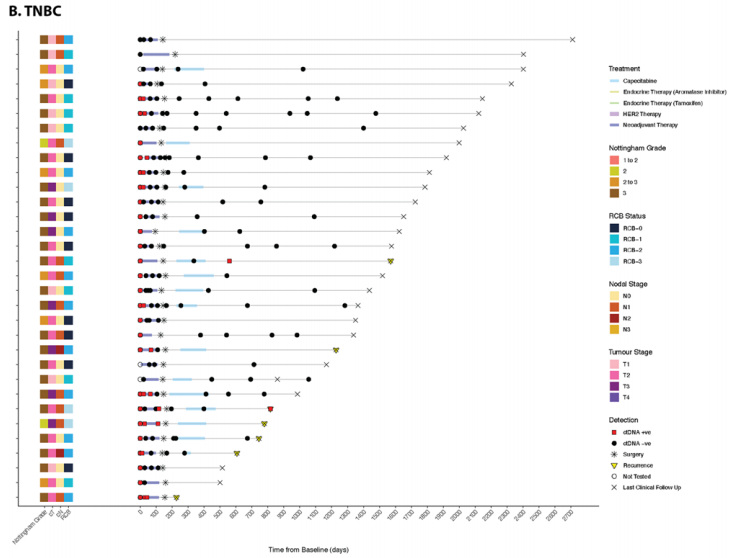
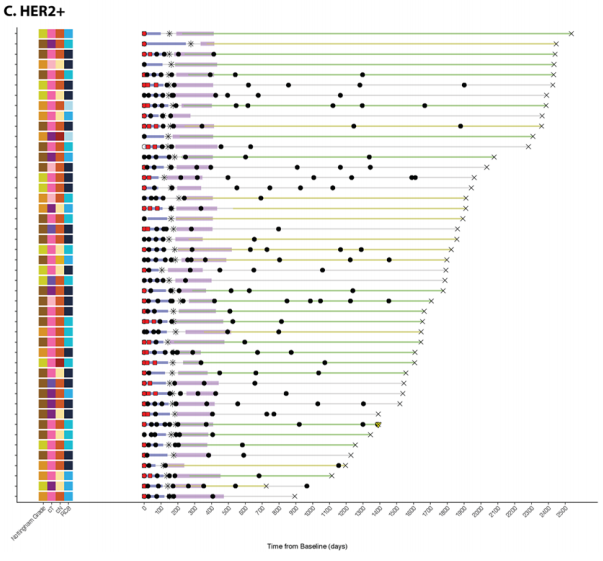

图5
在19名疾病复发的患者中,12名有可评估的术后和辅助随访样本。在二元分析中,术后或随访期间任何时候检测到ctDNA都与疾病复发相关(图6;HR:35.7,95%CI:4.30–297;p < 0.0001)。当使用时间依赖性Cox回归进行分析时,考虑到收集频率的差异,仅纳入术后和随访时间点(p < 0.0001)或纳入本研究中分析的所有时间点(p < 0.0001),这种相关性仍然显著。所有在术后或随访期间检测到ctDNA的患者随后都出现了临床复发。1例基线时未检测到ctDNA的参与者(ER+,低级别)在完成确定性手术后约3.5年、在辅助内分泌治疗期间发生了临床复发,而在临床随访中该患者从未检测到ctDNA(图5A)。术后或随访期间检测到ctDNA时复发的PPV为100%(灵敏度:75%,特异性:100%,阴性预测值:96%)。
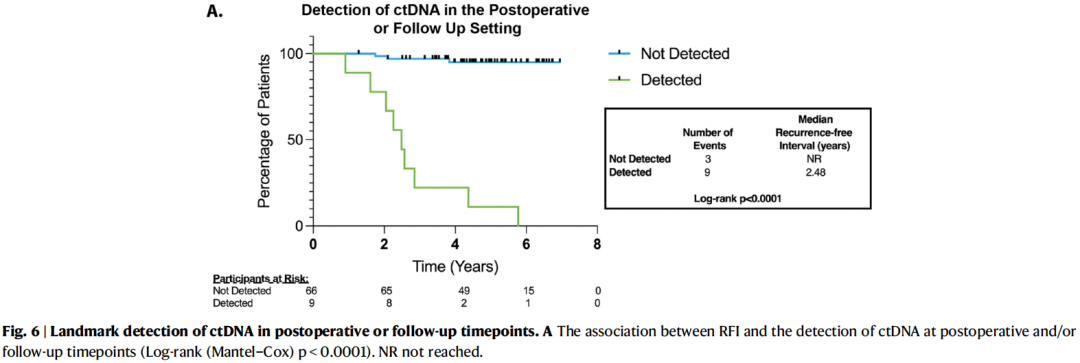
图6
提前期评估与临床复发:
在12名患者中有8名患者可评估从ctDNA检测到临床复发的提前期;其中1名患者在复发时检测到ctDNA。从检测到ctDNA到临床复发的中位提前期为374天(表3;范围:13–1010天)。在复发前最近的时间点检测结果为阴性的4名患者中,1名出现同侧HER2+局部复发(2级,pT1a),且ER状态改变,提示为新的原发性肿瘤。另一名TNBC患者在复发前72天检测到肿瘤来源的变异位点,但检测结果低于高置信度判定阈值(eVAF:2.71 × 10−5)。该患者被诊断出有一个无症状的单发性亚厘米肺部结节(经病理证实)。第三名和第四名患者在最后一次采集样本和复发之间间隔约一年,这限制了对结果的解释(表3)。
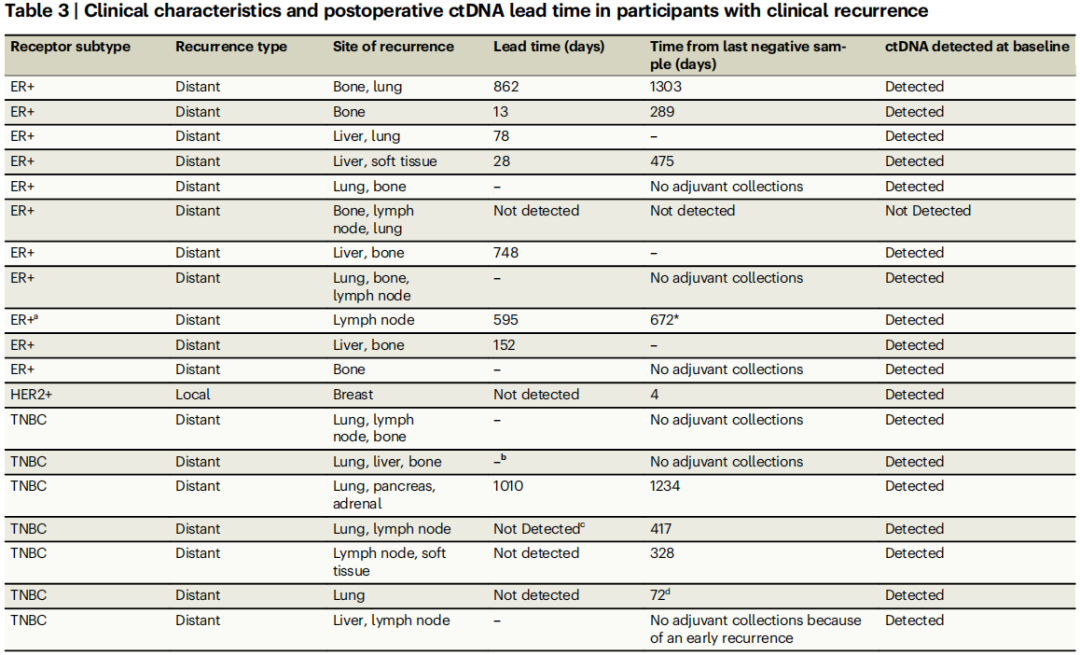
表3
对于在辅助治疗阶段出现复发且进行了系列样本采集的参与者,eVAF值会随时间上升,在临近临床复发时达到最高值(图7A–C)。无论是在开始辅助卡培他滨治疗后(活检时为低ER,切除标本显示为TNBC;图7A),还是在开始内分泌治疗后(ER阳性肿瘤;图7B、C),参与者的ctDNA均出现了清除现象。有一名参与者(图7D)在NAT期间早期就出现了ctDNA清除,但随后在术前检测到了ctDNA,从新辅助治疗结束到确定性手术之间没有延迟。术后检测时间点结果为阴性,但后来在出现转移性复发时检测到了ctDNA(表3)。
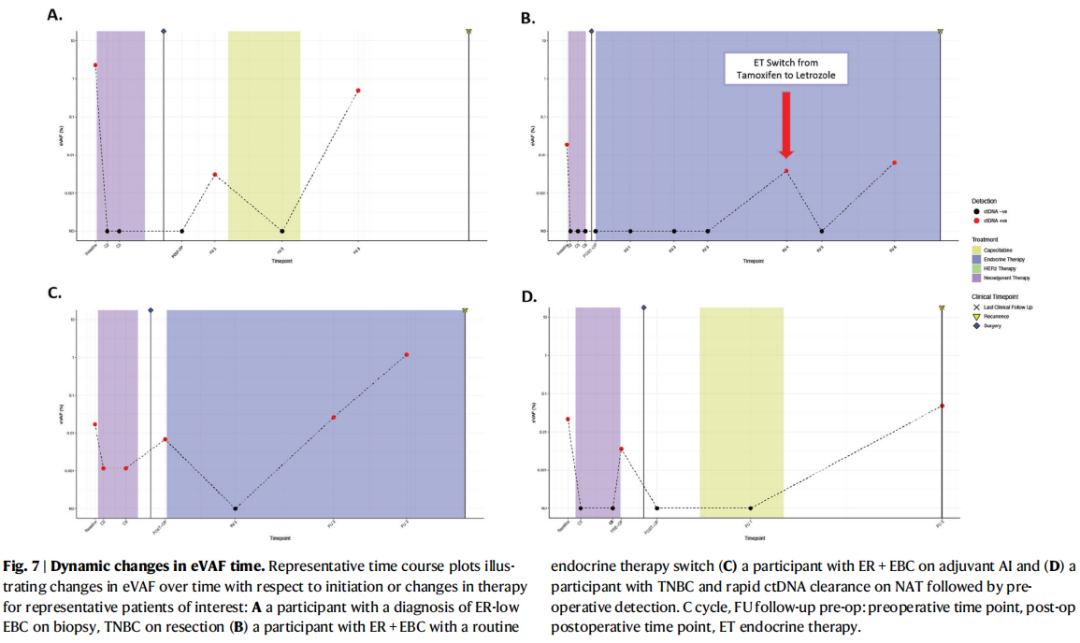
图7
讨 论
新辅助治疗(通常为化疗)是高危EBC患者的标准治疗方案,高危EBC的定义为具有侵袭性的疾病生物学特征(如三阴性乳腺癌、HER2+乳腺癌),或疾病负荷与生物学特征相结合(ER阳性/HER2-乳腺癌)。虽然通过手术时残留疾病的程度来衡量对NAT的反应,有助于指导风险分层并为辅助全身治疗提供参考,但这些评估在个体层面上并不精确。灵敏且特异的ctDNA检测方法为制定更具个性化的治疗方案提供了可能。在新辅助治疗阶段,关于tumor-informed检测方法的最大规模研究主要是在采用非标准治疗的临床试验中进行的。这里所描述的真实世界队列代表了一个具有临床相关性的人群,且具有几个关键特征。大多数参与者接受了标准的蒽环类-紫杉类联合治疗(±抗HER2治疗),未使用试验性药物,并且按照当时的真实世界治疗实践(在引入化疗免疫治疗作为TNBC的标准治疗之前),先给予蒽环类药物,后给予紫杉类药物。此外,大多数检测是使用来自存档诊断组织芯的有限材料成功进行的,在极少数情况下,使用的是治疗开始时未指定用于研究的手术标本中的残留病变材料。尽管存在组织样本的限制,但131名患者中只有9名(7%)因技术原因被排除在外,并且通过WES实现了足够的测序深度。
前瞻性采集血浆样本和记录临床结局,使得能够在新辅助治疗和辅助治疗的时间进程中对该检测方法进行回顾性评估,包括对术前阶段动态变化的全面评估以及这些变化与RCB状态的关系。在中位随访期为4.7年的时间里,119名参与者中有19名(16.0%)出现了复发,这反映了所纳入人群的临床风险。这段随访期能够对早期变化和临床结局进行特征分析,以及对辅助治疗阶段的ctDNA检测进行评估。
基线ctDNA检测结果与先前的报告一致,即基于WES的tumor-informed检测方法的检出率因乳腺癌亚型而异;在ER阳性肿瘤中检出率较低,在TNBC中最高,这被认为反映了细胞更新率和疾病生物学特征。值得注意的是,与iSPY2试验的要求不同,本研究的ER阳性参与者队列并不局限于高基因组风险人群(如通过MammaPrint检测所定义的)。这可能更准确地反映了使用该检测方法在ER阳性早期乳腺癌中基线ctDNA的检出率,因为通常只有20-35%的ER阳性乳腺癌通过MammaPrint检测被归类为高基因组风险。在大多数地区,患者通常是根据临床病理因素而非基因组风险来常规选择进行新辅助治疗的。
使用更灵敏的研究检测方法,可能在cfDNA中肿瘤成分较低的患者中检测到基线ctDNA。ctDNA检测与临床结局之间的关系应结合检测方法的分析特性来考虑。在这个队列中可以说明这一点,尽管不同受体亚型的TMB没有差异,但与其他受体亚型相比,ER阳性参与者中为ctDNA检测panel选择的变异更少(通过锁定检测流程)。值得注意的是,基线时TNBC且未检测到ctDNA的患者TMB较低,这表明可能存在生物学关联。在那些基线时未检测到ctDNA的患者中,每个检测panel选择的变异数量没有显著差异,因此不太可能是由于变异选择而遗漏了ctDNA。相反,ctDNA可能以极低的水平存在或没有主动释放(图2C)。在该队列的所有时间点中,37%(61/163)的阳性样本中ctDNA的eVAF低于0.01%,这突显了在具有标准临床风险的真实世界队列中,需要高灵敏度的ctDNA检测方法来捕捉预后和/或预测动态变化。评估辅助治疗阶段ctDNA的III期ZEST试验提前终止,该试验使用了技术灵敏度较低(95%检测限:0.01%)的检测方法,这表明早期的检测方法可能不适用于临床干预策略。评估数百或数千个肿瘤特异性变异的新型ctDNA检测方法可能会进一步提高在这种情况下的检测灵敏度。评估此类检测方法的检出率和其他参数,对于评估基于ctDNA的策略在开发过程中的潜在临床优势至关重要。
在这个队列中有一个有趣的发现,即几乎所有出现复发的参与者在基线时都检测到了ctDNA,只有一个例外。这个例外是一名患有低级别ER阳性早期乳腺癌的参与者,该患者接受了新辅助内分泌治疗;未检测到ctDNA可能是由于这种肿瘤的细胞更新率低以及ctDNA释放量极少。使用具有这种灵敏度水平的检测方法检测ctDNA,可能反映了常规临床变量未捕捉到的内在疾病生物学特征,ctDNA的释放可作为与个体临床风险相关的额外替代指标。几乎在所有最终复发的参与者中都能检测到ctDNA,这突显了在用于监测复发风险的ctDNA检测方法中,高技术灵敏度的重要性。然而,使用更高技术灵敏度的检测方法在基线时检测到ctDNA与临床结局之间的关联尚不清楚。这些发现需要在更同质的患者队列中进一步研究。
对整个队列以及单独对HER2阴性疾病患者进行了ctDNA动态分析,这是考虑到在新辅助治疗后半期使用紫杉类药物联合抗HER2抗体的标准治疗方案。这种方法认识到靶向治疗可能会影响HER2阳性疾病患者的治疗反应和ctDNA动态变化。有趣的是,HER2阳性参与者在新辅助治疗中期ctDNA阳性率较高,且没有出现临床复发。正如现代治疗所观察到的那样,HER2阳性参与者的总体结局非常好。当排除HER2阳性参与者后,新辅助治疗中期ctDNA检测对预后的价值以及与临床复发的相关性得到了改善;在HER2阴性疾病患者中,新辅助治疗中期检测到ctDNA的患者比未检测到ctDNA的患者更有可能出现疾病复发。虽然在新辅助治疗期间没有人出现临床进展性疾病,但持续检测到ctDNA可能是治疗耐药性疾病和肿瘤持续存在的早期标志,这可能导致无法根除微转移灶并最终复发。几乎所有新辅助治疗中期检测到ctDNA的HER2阴性疾病患者随后都出现了临床复发(67%,6/9),而新辅助治疗中期未检测到ctDNA的患者的复发率为14.5%(8/55)。这些数据表明,在设计前瞻性分析以评估临床效用时,未来的分析应同时考虑亚型和靶向治疗的纳入情况。虽然不能识别所有随后复发的患者,但识别出复发风险最高的患者可能有助于更有针对性地加强治疗。对于有残留疾病的患者进行辅助治疗升级是一种常见的治疗策略,但尽管如此,只有少数接受治疗的患者受益,而所有患者都要承受与治疗相关的毒性。将治疗期间的ctDNA监测纳入乳腺癌试验设计并进行验证,可能有助于更好地选择患者、改善结局并降低毒性,就像在其他实体瘤中所看到的那样。
分层分析探讨了病理pCR(即RCB-0)、残留疾病(RCB-1、2、3)、复发之间的关系,以及ctDNA检测是否能为标准风险分层提供额外信息。虽然非pCR状态与RFI相关,但它提供的是一个概率估计,而不是对个体风险的精确识别。由于研究中的事件数量有限,进行分层分析是因为缺乏足够的统计效力进行多变量分析。尽管如此,新辅助治疗中期ctDNA检测识别出了残留疾病患者中风险最高的人群,这表明其在病理结果之外具有额外的作用。在HER2阴性早期乳腺癌中,没有RCB-0疾病患者在新辅助治疗中期检测到ctDNA,也没有人出现临床复发。然而,新辅助治疗中期ctDNA检测的灵敏度不足以识别那些在手术时随后出现残留疾病的患者。许多新辅助治疗中期未检测到ctDNA的患者存在残留疾病,但所有新辅助治疗中期检测到ctDNA的患者最终都出现了RCB-2/3疾病。
辅助治疗是以预防的方式进行的,无法确定其对个体患者的疗效。相比之下,围手术期和辅助治疗阶段的ctDNA检测与即将发生的复发风险密切相关,中位提前期为374天。新冠疫情期间的操作变化,如样本采集时间的不固定,可能影响了检测的提前期。尽管如此,ctDNA检测的阳性预测值(PPV)为100%,灵敏度为75%,特异性为100%,这强调了该检测方法在预测复发方面的特异性。在三名复发但未检测到ctDNA的参与者中,两名存在技术因素(例如,在大约1年内未进行样本采集,可能是新的原发性肿瘤)限制了对结果的解释,而第三名患者出现了小体积复发,检测到的肿瘤来源变异水平较低(低于检测方法的阳性阈值)。尽管存在这些问题,但当考虑使用ctDNA监测来指导挽救性强化治疗时,该检测方法100%的特异性是一个重要因素。然而,大多数复发的参与者在术后即刻并未检测到ctDNA,而是在随访期间检测到的,这表明单一的标志性时间点可能不足以指导辅助治疗。在设计前瞻性试验时,有必要仔细评估检测方法的性能和是否适合预期目的,在干预风险和检测方法特性之间取得平衡。
本研究存在一些局限性。招募和样本采集发生在新冠疫情期间,由于努力减少医院就诊次数,这影响了样本采集的时间,特别是在围手术期和随访阶段。因此,当在该中心之外进行临床检测时,一些研究样本被遗漏了。此外,尽管ctDNA结果来自锁定的检测方法,其中包括对胚系变异的过滤,但由于缺乏匹配的胚系样本(图2J),研究者对描述肿瘤体细胞特征的突变分析受到了限制。尽管使用了仅针对肿瘤的过滤策略,但这可能导致某些变异的频率高于预期。此外,虽然该研究评估了一个大的队列,但亚型特异性分析受到样本量较小的限制,特别是HER2阳性组中复发的数量较少,这反映了现代治疗的良好预后。这限制了对ctDNA动态变化和临床结局的解释,以及对提前期的评估。需要进一步针对高危HER2阳性人群进行研究。该队列的回顾性、单中心性质是另一个局限性,因为新辅助治疗的选择和临床随访可能存在差异,并影响结果的普遍性。尽管大多数接受新辅助治疗的患者都被邀请参与研究,但并非所有人都参与了。最后,在所有情况下,通过专家进行病理审查来选择治疗前的活检组织可能并不都可行,这可能会限制tumor-informed检测方法的应用,因为在这种情况下可能无法获取适合提取基因组DNA的组织样本。
总之,在一个真实世界的早期乳腺癌患者队列中,一种高灵敏度、tumor-informed的ctDNA检测方法在新辅助治疗开始前的很大一部分参与者中成功检测到了基线ctDNA。基线时未检测到ctDNA与良好的结局相关。此外,治疗期间的ctDNA检测与临床结局相关,特别是在HER2阴性早期乳腺癌中。使用该检测方法进行辅助治疗阶段的ctDNA监测,对临床复发的阳性预测值为100%,且具有潜在的临床意义提前期,对ER阳性疾病患者更有利。有必要进行纳入该检测方法的ctDNA评估的前瞻性试验,以评估ctDNA指导治疗策略的临床效用。
参考文献:
Elliott MJ, Echelard P, Pipinikas C, Main S, Fuentes Antrás J, Dou A, Veitch Z, Amir E, Nadler MB, Meti N, Atenafu E, Shah E, Yu C, Campbell N, Ventura R, Siu LL, Bedard PL, Berman HK, Cescon DW. Longitudinal evaluation of circulating tumor DNA in patients undergoing neoadjuvant therapy for early breast cancer using a tumor-informed assay. Nat Commun. 2025 Feb 21;16(1):1837. doi: 10.1038/s41467-025-56658-4. PMID: 39984446; PMCID: PMC11845481.


本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言














#早期乳腺癌# #循环肿瘤DNA#
5