【综述】| 聚力分型精准,引领诊疗变革——乳腺癌精准诊疗新模式
2025-01-01 中国癌症杂志 中国癌症杂志 发表于陕西省
本文将系统性回顾乳腺癌治疗理念演变和“分型精准”治疗模式发展历程,并对“分型精准”治疗的未来趋势进行展望,以期为乳腺癌综合诊疗水平的提升提供借鉴。
[摘要] 乳腺癌是全球女性中发病率最高的恶性肿瘤,发病率逐年上升。乳腺癌的治疗经历了数次变革,从最初单一的外科手术,发展至全身治疗,进而至近年的分型治疗。临床上,乳腺癌根据激素受体(hormone receptor,HR)和人表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)的表达被细分为腔面型、HER2阳性型和三阴性乳腺癌(triple-negative breast cancer,TNBC),并分别采取内分泌治疗、抗HER2靶向治疗和化疗。然而,分型治疗策略不够个体化,仍有约30%的患者面临治疗耐药和复发转移。HER2阳性乳腺癌患者的总生存率不断提高,而TNBC和腔面型晚期乳腺癌患者的生存改善不显著。为克服“分类不够彻底,治疗不够精准”的临床瓶颈,“分型精准”治疗应运而生。“分型精准”治疗是指在现有分型基础上进一步亚分型,并找到特定靶点开展精准治疗,具有“人群广覆盖,治疗高特异” 的特点。复旦大学附属肿瘤医院乳腺癌多学科团队历时10年,建立中国乳腺癌多组学图谱(Chinese Breast Cancer Genome Atlas,CBCGA),并深入解析TNBC的分子生物学特征,建立了与临床疗效密切相关的TNBC“复旦分型”:腔面雄激素受体型(luminal androgen receptor subtype,LAR),可用抗HER2和细胞周期蛋白依赖性激酶CDK4/6抑制剂靶向治疗;免疫调节型(immunomodulatory subtype,IM),适合免疫治疗;基底样免疫抑制型(basal-like immune-suppressed subtype, BLIS),可使用铂类或多腺苷二磷酸核糖聚合酶[poly (ADP-ribose) polymerase,PARP]抑制剂等DNA损伤药物;间充质型(mesenchymal-like subtype,MES),可使用抗肿瘤干细胞、抗血管生成治疗。项目组后续将“分型精准”模式推广至人数最多、占比最高、复发风险可持续数十年的乳腺癌亚型—腔面型乳腺癌中,将腔面型乳腺癌分为4个分子亚型并提出相应精准治疗策略:经典腔面型(SNF1),对内分泌治疗敏感;免疫型(SNF2),可开展免疫治疗;增殖型(SNF3),可通过阻滞细胞周期治疗;受体酪氨酸激酶驱动型(SNF4),可靶向受体酪氨酸激酶治疗。团队正在开展Ⅲ期随机对照临床试验,以进一步验证“分型精准”治疗策略,并推广“分型精准”复旦经验,带动整体乳腺癌疗效提升。展望未来,借助人工智能等新兴诊断工具,以及各个亚型靶向标志物和靶向药物的更新迭代,乳腺癌“分型精准”治疗有望进一步优化和推广,改善患者预后,引领乳腺癌治疗方式的新变革。
[关键词] 乳腺癌;治疗变革;“分型精准”治疗;“复旦分型”
[Abstract] Breast cancer is the most common malignant tumor among women worldwide, with incidence rates rising annually. The treatment of breast cancer has undergone significant transformations, evolving from an initial reliance on a single surgical approach to the incorporation of systemic therapy, and more recently, to subtype-specific therapy. Clinically, breast cancer is classified into luminal, HER2-positive, and triple-negative breast cancer (TNBC) based on the expression of hormone receptor (HR) and human epidermal growth factor receptor 2 (HER2), with corresponding treatments including endocrine therapy, anti-HER2 targeted therapy, and chemotherapy. However, the current subtype-based treatment strategies lack personalization, with approximately 30% of patients still facing resistance and relapse. While the overall survival rate of patients with HER2-positive breast cancer has been steadily increasing, significant survival improvements have not been observed in patients with triple-negative and luminal breast cancer. To overcome the clinical bottleneck of “incomplete classification and imprecise treatment”, the concept of “subtype-precise” therapy has emerged. This innovative approach involves further subclassification of existing subtypes to identify specific targets for precision treatment, characterized by broad population coverage and high specificity. Over the past decade, the multidisciplinary team at Fudan University Shanghai Cancer Center has established a comprehensive molecular portrait of Chinese Breast Cancer Genome Atlas (CBCGA). They deeply analyzed the molecular characteristics of TNBC, leading to the development of a “Fudan subtype” closely related to clinical outcomes: luminal androgen receptor subtype (LAR), which can be targeted with anti-HER2 and CDK4/6 inhibitors; the immunomodulatory subtype (IM), suitable for immunotherapy; basal-like immune-suppressed subtype (BLIS), which can be treated with platinum-based drugs or poly (ADP-ribose) polymerase (PARP) inhibitors; and mesenchymal-like subtype (MES), which can be treated with anti-cancer stem cell and anti-angiogenic therapies. The team then extended the concept of “subtype-precise” to luminal breast cancer, the subtype with the largest number, the highest proportion and the risk of recurrence for decades. They divided it into four molecular subtypes and proposing corresponding precision treatment strategies: canonical luminal subtype (SNF1), sensitive to endocrine therapy; immunogenic subtype (SNF2), amenable to immunotherapy; proliferative subtype (SNF3), treatable by CDK4/6 inhibitors; and receptor tyrosine kinase-driven subtype (SNF4), targetable with tyrosine kinase inhibitors. The team is currently conducting phase Ⅲ randomized controlled trials to further validate the “subtype-precise” therapy and promote the “subtype-precise” Fudan experience to enhance overall breast cancer treatment efficacy. Looking forward, the integration of emerging diagnostic tools, such as artificial intelligence, coupled with the continuous update of subtype-specific targets and targeted therapies, is expected to further refine and expand “subtype-precise” therapy. This approach holds great promises for enhancing patient prognosis and leading a new revolution in breast cancer treatment.
[Key words] Breast cancer; Treatment transformation; “Subtype-precise” therapy; “Fudan subtype”
乳腺癌是全球女性中发病率最高的恶性肿瘤,严重危害女性的生命健康[1]。随着治疗理念的革新和治疗手段的快速发展,根据分子分型选择治疗方案已成为乳腺癌治疗的共识。基于激素受体(hormone receptor,HR)及人表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)的表达情况,乳腺癌被划分为腔面型、HER2阳性型和三阴性乳腺癌(triple-negative breast cancer,TNBC),并分别给予内分泌治疗、抗HER2靶向治疗和化疗。内分泌治疗方案经过不断优化,已从最初的内分泌治疗时代进入到如今的内分泌联合细胞周期蛋白依赖性激酶(cyclin-dependent kinase,CDK)抑制剂治疗时代。抗HER2靶向辅助治疗能够显著改善HER2阳性乳腺癌患者的预后,并在新辅助治疗及HER2低表达乳腺癌患者治疗中取得了积极进展。化疗作为延长患者生存的基础治疗手段,其地位依旧不可动摇。
然而,乳腺癌的高度异质性使得传统分型体系存在局限,仍有约30%的患者面临治疗耐药和复发转移[2]。如何根据患者的疾病特征制订更加精准和个体化的治疗方案,以改善患者预后,是乳腺癌治疗领域亟待攻克的难题。复旦大学附属肿瘤医院乳腺肿瘤多学科诊疗团队(下称“团队”)基于既往10年的研究基础,创新性提出 “分型精准”治疗模式。该模式在传统乳腺癌分型的基础上进一步细化,通过识别更精细的分子分型,针对各个分型的特异靶点开展精准靶向治疗,进一步提升疗效。本文将系统性回顾乳腺癌治疗理念演变和“分型精准”治疗模式发展历程(图1),并对“分型精准”治疗的未来趋势进行展望,以期为乳腺癌综合诊疗水平的提升提供借鉴。
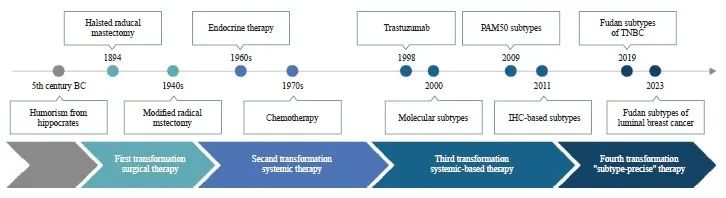
图1 乳腺癌治疗的4次变革
Fig. 1 Four transformations in breast cancer treatment
BC: Before Christ; IHC: Immunohistochemistry.
1 乳腺癌治疗理念演变
1.1 第1次变革:外科治疗
乳腺癌作为极早被认识的恶性肿瘤之一,其治疗手段长期处于探索阶段。早在公元前16世纪,古埃及人便记录了乳腺肿瘤的存在,但认为其没有治愈方法,肿块切除可作为缓解患者局部痛苦的姑息性治疗手段[3]。公元前5世纪,希波克拉底提出“体液学说”,将乳腺癌归因于血液、黏液、黄胆和黑胆4种体液的不平衡。1757年,法国医师Le Dran[4]提出乳腺癌是一种“局部起源的局部疾病”,外科切除可治愈乳腺癌。1867年,英国外科医师Moore[5]提出乳腺癌外科手术原则,主张切除整个乳房及乳房皮肤、周围淋巴、脂肪、胸部肌肉和可能有癌细胞转移的腋窝淋巴结,以降低复发风险。1894年,William Stewart Halsted创立乳腺癌根治术,即Halsted根治术,该手术包括广泛切除皮肤和乳腺组织、下方胸大肌、胸小肌以及Ⅰ~Ⅲ级腋窝淋巴结,成为乳腺癌外科治疗的金标准。Halsted根治术成功将乳腺癌的术后3年局部复发率由当时的51.82%降低至6.00%(3/50)[6]。随后,外科手术技术不断进步,改良根治术、扩大根治术、保乳根治术及乳房重建术等新型术式相继出现,这些术式在有效地降低局部复发风险的同时,更加重视患者的生活质量。目前,外科手术依然是早期乳腺癌患者治疗的基础手段。
1.2 第2次变革:全身治疗
尽管外科手术能够有效地降低乳腺癌患者的局部复发风险,但术后远处转移的问题依旧存在,患者仍面临死亡威胁。1966年,Fisher 等[7]研究发现乳腺癌在早期即可同时发生淋巴结和血液转移,首次提出“乳腺癌是全身性疾病”的理论。据此,Fisher教授认为患者在手术后应序贯接受全身系统治疗以降低转移风险,而已发生远处转移的患者则难以从局部手术中真正获益。在这一创新理论支持下,美国乳腺与肠道外科辅助治疗研究组(The National Surgical Adjuvant Breast and Bowel Project,NSABP)和早期乳腺癌试验协作组(Early Breast Cancer Trialists Collabrative Group,EBCTCG)开展了一系列临床试验研究。1976年,经过27个月随访证实,CMF(环磷酰胺,甲氨蝶呤,5-氟尿嘧啶)化疗方案可显著降低乳腺癌患者的术后复发转移率(CMF化疗 vs 单纯外科手术:5.3% vs 24%),由此确立了辅助化疗在乳腺癌全身治疗中的地位[8]。1998年,EBCTCG的meta分析[9]指出,CMF或含蒽环类药物的辅助化疗方案使得50岁以下的早期乳腺癌患者的10年生存率提高了7%~11%。全身治疗的提出和发展,标志着乳腺癌治疗的第2次重大变革,再次大幅提高了患者的生存率。
1.3 第3次变革:分型治疗
乳腺癌的全身治疗最初采取“一刀切” 模式,忽视了肿瘤之间的特征差异。2000年, Perou等[10]正式提出“乳腺癌是异质性疾病”,通过基因芯片检测建立乳腺癌分子分型,首次将乳腺癌明确区分为管腔样(luminal-like)型、HER2过表达型、基底样(basal-like)型和正常样(normal-like)型,针对luminal-like型采取内分泌治疗,针对HER2过表达型采取抗HER2靶向治疗,针对basal-like型采取化疗,开启了根据肿瘤的内在分子生物学特征进行治疗的“分型治疗”新模式。为了使分子分型更容易应用于临床,2011年St. Gallen国际乳腺癌大会达成共识,采用雌激素受体(estrogen receptor,ER)、孕激素受体(progesterone receptor,PR)、HER2和Ki-67增殖指数4个标志物的免疫组织化学染色结果来判断乳腺癌的分子分型[11]。这一共识极大地推动了分型治疗理念的普及,分型治疗迅速成为乳腺癌治疗的新标准,标志着乳腺癌治疗的第3次重大变革。
2 乳腺癌治疗的挑战
尽管乳腺癌分型治疗模式取得了显著成效,但分型治疗的发展却并不平衡。真实世界研究显示,HER2阳性晚期乳腺癌患者的总生存率不断提高,由2008年的39.1个月(95% CI:36.2~46.5)延长至2013年的58.0个月(95% CI:52.0~68.4),而TNBC和腔面型晚期乳腺癌患者的生存改善并不显著[12]。回顾乳腺癌分型治疗的进程,靶向药物的快速发展推动着HER2阳性乳腺癌疗效的不断提升。从单克隆抗体、小分子酪氨酸激酶抑制剂(tyrosine kinase inhibitor,TKI),再到多种单克隆抗体联用以及不断迭代的抗体药物偶联物(antibody-drug conjugate,ADC),抗HER2靶向药物已成为肿瘤靶向治疗的标杆[13]。
然而,不同于HER2阳性乳腺癌中相对统一的关键靶点,TNBC及腔面型乳腺癌患者间的异质性更加显著,传统“一刀切”式的化疗或内分泌治疗已经遇到了瓶颈。一些新兴的治疗手段,如免疫治疗、CDK4/6抑制剂、AKT抑制剂等,也只能使部分患者获益[14]。2011年,Lehmann等[15]根据微阵列测序首次将TNBC分为6种分子亚型,即基底细胞样型1(BL1)、基底细胞样型2(BL2)、免疫调节型(immunomodulatory subtype,IM)、间充质型(mesenchymal-like subtype,MES)、间充质干细胞样型和腔面雄激素受体型(luminal androgen receptor subtype,LAR),并在2016年简化为4分型(BL1、BL2、MES和LAR)[16]。2015年, Burstein等[17]基于mRNA和DNA测序,提出了Burstein分型,即basal-like免疫抑制型(basal-like immune-suppressed subtype,BLIS)、基底细胞样免疫激活型、MES和LAR。2016年,团队基于mRNA-lncRNA表达谱,首次建立了中国人群的TNBC分子分型,包括BLIS、IM、MES和 LAR[18]。以上研究初步探索了针对TNBC进一步分型的科学性和可行性,但分子分型对应的治疗方式仍未确定,临床价值有待探讨。而针对腔面型乳腺癌,国际上尚无公认的分子分型。因此,如何细化现有分型体系,给予特定患者亚群更为针对性的靶向治疗,克服“分类不够彻底,治疗不够精准”的局限,是提升TNBC及腔面型乳腺癌治疗效果的关键。
3 第4次变革:“分型精准”治疗
3.1 “分型精准”治疗提出:从中国乳腺癌多组学图谱(Chinese Breast Cancer Genome Atlas, CBCGA)出发
多年来,团队致力于治疗技术的革新和多学科融合的实践,不断提升乳腺癌诊治水平。近年来本院收治的可手术乳腺癌患者的5年总生存率达到93.6%,在国际上处于领先地位,已超过美国同期水平。在诊疗过程中,团队发现现有治疗的主要临床数据多来自于高加索裔人群,而亚裔人群的临床病理学特征和治疗靶点研究相对缺乏。为此,历经10年布局,团队利用高通量技术,整合基因组、转录组、蛋白质组、代谢组及影像组等多维度数据,绘制了目前全球规模最大、维度最全、随访时间最长的CBCGA[19]。团队发现不同PAM50分型的中国患者存在独特的多组学特征。在管腔A(Luminal A)亚型中,中国患者的AKT1突变率远高于高加索裔患者(12.1% vs 4.4%),提示靶向AKT治疗的更大获益。在管腔B(Luminal B)亚型中,WWP1扩增是潜在的驱动事件。HER2富集(HER2-enriched)亚型的中国患者在HR阳性、HER2阳性乳腺癌患者中占比远高于该亚型的高加索裔患者(40% vs 15%),可为在HR阳性、HER2阳性乳腺癌患者中优先推荐双靶向治疗提供依据。此外,basal-like型对铁死亡促进剂更为敏感。CBCGA全面揭示了亚裔乳腺癌患者的分子生物学特征,并鉴定了亚型特异性治疗新靶标,可为确立适合中国人群的精准治疗策略提供关键参考。
基于CBCGA的深入研究和临床实践经验,团队认识到在分子分型基础上进一步挖掘靶点的重要性和可行性,并创新性地提出了“分型精准” 治疗模式。“分型精准”治疗是指在现有分型基础上进一步亚分型,找到特定靶点并开展精准治疗。“分型精准”治疗有望解决分型治疗特异度低的临床问题,推进第4次乳腺癌治疗变革。
3.2 “分型精准”治疗突破:建立TNBC“复旦分型”
TNBC恶性程度高、预后差、易于早期复发和转移。针对TNBC,目前主要采取的“一刀切”化疗方案疗效有限,急需更有效的治疗手段。团队在前期研究中,通过构建基于亚型特异性mRNA-lncRNA的预后模型,成功区分了TNBC的高危和低危复发风险组[20],揭示了TNBC的高度异质性,并对TNBC分子分型进行了初步探索[18]。基于以上临床需求和研究基础,团队首先选择在TNBC中探索“分型精准”治疗新模式,于2019年建立了与临床疗效密切相关的TNBC“复旦分型”:LAR,以高ERBB2突变和细胞周期通路激活为特征,可用抗HER2和细胞周期蛋白依赖性激酶CDK4/6抑制剂靶向治疗;IM,免疫细胞富集,适合免疫治疗;BLIS,染色体高度不稳定,可使用铂类或多腺苷二磷酸核糖聚合酶[poly (ADP-ribose) polymerase,PARP]抑制剂等靶向DNA损伤药物治疗;MES,呈现出干细胞相关STAT3通路激活,可尝试使用抗肿瘤干细胞、抗血管生成治疗[21](表1)。为解决分子检测费用高、耗时长的问题,团队一方面开发了TNBC“复旦分型”免疫组织化学试剂盒并实现专利转化[22],在全国20家单位推广应用,至今已完成超过12 000例TNBC患者的分型检测;另一方面与工业信息团队合作,利用深度学习算法,仅基于常规病理切片或磁共振成像图像,即可实现在30 min内快速、无创、低成本地预测TNBC的“复旦分型”[23-24],进一步提高了TNBC“复旦分型”方案在基层医院的可及性。

此外,团队持续拓展组学维度、深入机制研究,从免疫、代谢、共生菌群及铁死亡等多个角度挖掘TNBC“复旦分型”的新型治疗靶点。例如,针对LAR亚型的脂质代谢旺盛特征,提出了靶向铁死亡联合免疫治疗的策略[25-26];针对IM亚型富集的肿瘤内梭菌属来源的代谢产物氧化三甲胺,探索氧化三甲胺前体底物—胆碱激活抗肿瘤免疫、增敏免疫治疗的可能性[27];针对BLIS亚型中发现的鸟苷二磷酸甘露糖诱导同源重组修复缺陷的机制,挖掘PARP抑制剂联合抗程序性死亡蛋白-1(programmed death-1,PD-1)治疗新策略[28]。上述成果持续拓展TNBC“复旦分型”内涵。
基于上述研究成果,团队进一步开展了TNBC“分型精准”临床研究。FUTURE (FUSCC-TNBC-UmbRElla)伞形精准治疗临床试验[29-30]将多线治疗失败的难治性TNBC治疗有效率从不足10%提升至29.8%,其中免疫治疗臂的有效率达到43.5%。FUTURE-C-PLUS、 FUTURE-SUPER等多中心一线临床试验[31-32]发现,“分型精准”治疗将患者的中位无进展生存期从5.8个月延长至11.3个月,其中精准免疫治疗臂的中位无进展生存期达15.1个月,是目前国际报道的最佳疗效。以上成果成功验证了“分型精准”治疗体系的临床价值。
以上在TNBC中探索落地的“分型精准” 系列研究形成了“临床-基础-临床”闭环研究体系,使得TNBC的治疗实现分型精准全覆盖,真正实现了从分子分型到临床转化,TNBC患者的生存得到有效的改善。
3.3 “分型精准”治疗拓展:首创腔面型乳腺癌 “复旦分型”
TNBC“复旦分型”取得的突破激励团队进一步探索针对腔面型乳腺癌的“分型精准”策略。腔面型乳腺癌是最为常见的乳腺癌类型,约占所有乳腺癌的70%。相对其他分型的乳腺癌患者,腔面型乳腺癌的复发转移风险长期存在,术后10年甚至更长时间仍有相当比例的患者出现复发转移。目前的治疗方法,如延长内分泌治疗时间或对整体腔面型乳腺癌患者进行CDK4/6抑制剂治疗,由于缺乏对分子本质的深入理解,疗效提升有限。为此,团队展开攻关,将腔面型乳腺癌分为4个分子亚型并提出相应的精准治疗策略:经典腔面型(SNF1),对内分泌治疗敏感;免疫型(SNF2型)富集免疫细胞,可开展免疫治疗;增殖型(SNF3型)以细胞周期通路活化为特征,可通过阻滞细胞周期治疗;受体酪氨酸激酶驱动型(SNF4型)的受体酪氨酸激酶(receptor tyrosine kinase,RTK)信号转导通路激活,可用TKI治疗[33](表2)。该研究在国际上首次提出了腔面型乳腺癌“分型精准”治疗体系,填补了领域内的长期空白。借助于在TNBC“复旦分型”中积累的经验,团队在腔面型乳腺癌中拓展了数字病理联合深度学习预测分型的人工智能算法[33],并在全国范围内推广应用。

在多中心数据支持和多维度临床研究的基础之上,团队利用真实世界研究和前瞻性临床试验,进一步验证腔面型乳腺癌“分型精准”治疗的有效性。首先,团队开展2014—2021年的多中心晚期腔面型乳腺癌真实世界研究,通过回顾性分析确认了不同分型与临床病理学特征、患者预后和疗效之间的关系。团队发现,相比于腔面型乳腺癌早期队列,多中心晚期队列中SNF1占比显著减少,与SNF1乳腺癌不易复发转移的临床特征一致。另外,多中心晚期队列中SNF4患者占比显著增加,验证了SNF4的内分泌治疗耐药和预后不良特征。在临床疗效方面,SNF3对CDK4/6抑制剂更为敏感,而SNF4对TKI治疗敏感。随后,在前期夯实的研究基础之上,团队积极布局,启动了从新辅助治疗到晚期多线治疗的全链条式前瞻性临床研究,以进一步明确腔面型乳腺癌“复旦分型”的临床价值。
至此,“分型精准”体系已覆盖超过85%的乳腺癌患者,有望为这些患者带来更精准的个体化治疗方案,从而提高疗效。
4 展望
乳腺癌“分型精准”治疗的提出为乳腺癌治疗的进一步发展开辟了新路径,同时也面临着一些挑战和问题。具体而言,只有实现“分型精准”理念的简化落地、疗效验证和应用推广,才能确保“分型精准”治疗模式能够真正惠及更多乳腺癌患者。
4.1 完善“一站式”人工智能平台,加速“分型精准”治疗落地
人工智能技术的飞速发展已经深刻地改变了精准医学的临床实践。团队的前期研究探索了人工智能在“分型精准”治疗中的应用,但受限于严格的处理流程,仅在复旦大学附属肿瘤医院得以实施,限制了更广泛患者群体的受益。为了解决这一问题,团队集中力量,逐步搭建了便捷、高效的乳腺癌“一站式”在线人工智能辅助决策平台。该平台将神经网络模型和算法进行了封装和部署,仅需上传患者的病理学或影像学图像,即可快速、无创地获得检测结果。目前,“一站式”人工智能平台已在长三角地区、福建省、重庆市等地的多家医院得到应用,为更多乳腺癌患者提供了高效、精准的诊疗服务。
4.2 验证“分型精准”治疗策略,推进临床治疗实践变革
对TNBC和腔面型乳腺癌的“分型精准”治疗的探索已经取得了令人鼓舞的进展。通过一系列的Ⅱ期临床试验,“分型精准”治疗的理念已得到了初步验证。这些成果不仅为我们提供了宝贵的经验和数据,也为未来的研究和临床实践指明了方向。为了进一步巩固和扩大这些研究成果,团队正在开展Ⅲ期随机对照临床试验,从而有望真正改变乳腺癌的临床治疗实践。目前,团队已在新辅助治疗、辅助治疗和晚期一线治疗等多个阶段布局临床试验,涵盖了乳腺癌治疗的全链条,期待这些研究能够取得成功,为乳腺癌患者带来更加精准有效的治疗方案。
4.3 推广“分型精准”复旦经验,带动整体乳腺癌疗效提升
诊疗模式的创新和转变是共同参与的过程,它超越了单一医院的能力范围,需要广泛协作和共同努力。为此,团队牵头成立了多中心临床研究协作平台—乳腺癌精准治疗协作组(Breast Cancer of Precision Treatment Group,BCTOP)。BCTOP的宗旨是基于精准医学理念,开展多中心临床研究,推广转化研究平台,开发新型药物和技术,提高中国乳腺癌的诊治水平和国际地位。通过整合各中心的资源和优势,实现数据共享和经验交流,BCTOP期望各中心协同攻关诊疗难题,提升中国在乳腺癌临床及转化研究领域的影响力,为全球乳腺癌治疗的进步作出更大的贡献。
5 结论
“分型精准”治疗可实现“人群广覆盖,治疗高特异”,正在逐步引领乳腺癌诊疗领域的又一次变革。未来,通过持续优化现有分型,深入探索肿瘤的发生、发展以及耐药性形成过程中的关键分子机制,针对性地研发靶向药物,“分型精准”治疗将为乳腺癌患者提供更为有效的治疗选择。
利益冲突声明:所有作者均声明不存在利益冲突。
作者贡献声明:
张思维:资料收集,文章撰写和修改;
马丁:文章撰写和修改;
江一舟:主题指导,资料收集,文章修改;邵志敏:主题指导,资料收集,文章撰写和修改。
[参考文献]
[1] BRAY F, LAVERSANNE M, SUNG H, et al. Global cancer statistics 2022: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2024, 74(3): 229-263.
[2] SAPHNER T, TORMEY D C, GRAY R. Annual hazard rates of recurrence for breast cancer after primary therapy[J]. J Clin Oncol, 1996, 14(10): 2738-2746.
[3] COOPER W A. The history of the radical mastectomy[J]. Ann Med Hist, 1941, 3(1): 36-54.
[4] LE DRAN H F. The operations in surgery of mons. Le Dran[M]. 1768.
[5] MOORE C H. On the influence of inadequate operations on the theory of cancer[J]. Med Chir Trans, 1867, 50: 245-280.
[6] HANDLEY R S. Carcinoma of the breast[J]. Ann Roy Coll Surg, 1975, 57(2): 59-66.
[7] FISHER B, FISHER E R. The interrelationship of hematogenous and lymphatic tumor cell dissemination: an experimental study[J]. Rev Inst Nac Cancerol, 1966, 19: 576-581.
[8] BONADONNA G, BRUSAMOLINO E, VALAGUSSA P, et al. Combination chemotherapy as an adjuvant treatment in operable breast cancer[J]. N Engl J Med, 1976, 294(8): 405-410.
[9]Early Breast Cancer Trialists’ Collaborative Group. Polychemotherapy for early breast cancer: an overview of the randomised trials[J]. Lancet, 1998, 352(9132): 930-942.
[10]PEROU C M, SØRLIE T, EISEN M B, et al. Molecular portraits of human breast tumours[J]. Nature, 2000, 406(6797): 747-752.
[11]GOLDHIRSCH A, WOOD W C, COATES A S, et al. Strategies for subtypes: dealing with the diversity of breast cancer: highlights of the St. Gallen international expert consensus on the primary therapy of early breast cancer 2011[J]. Ann Oncol, 2011, 22(8): 1736-1747.
[12]GRINDA T, ANTOINE A, JACOT W, et al. Evolution of overall survival and receipt of new therapies by subtype among 20 446 metastatic breast cancer patients in the 2008-2017 ESME cohort[J]. ESMO Open, 2021, 6(3): 100114.
[13]柳光宇, 邬思雨. HER2阳性早期乳腺癌全身治疗变革及未来展望[J]. 肿瘤防治研究, 2023, 50(5): 437-441.
LIU G Y, WU S Y. Reform and prospect of systemic therapy on HER2-positive early-stage breast cancer[J]. Cancer Res Prev Treat, 2023, 50(5): 437-441.
[14]肖玉铃, 朱秀之, 江一舟, 等. 三阴性乳腺癌精准治疗研究的新进展与未来展望[J]. 中国癌症杂志, 2022, 32(8): 669-679.
XIAO Y L, ZHU X Z, JIANG Y Z, et al. New research advances and future prospect in precision treatment of triple-negative breast cancer[J]. China Oncol, 2022, 32(8): 669-679.
[15]LEHMANN B D, BAUER J A, CHEN X, et al. Identification of human triple-negative breast cancer subtypes and preclinical models for selection of targeted therapies[J]. J Clin Invest, 2011, 121(7): 2750-2767.
[16]LEHMANN B D, JOVANOVIĆ B, CHEN X, et al. Refinement of triple-negative breast cancer molecular subtypes: implications for neoadjuvant chemotherapy selection[J]. PLoS One, 2016, 11(6): e0157368.
[17]BURSTEIN M D, TSIMELZON A, POAGE G M, et al. Comprehensive genomic analysis identifies novel subtypes and targets of triple-negative breast cancer[J]. Clin Cancer Res, 2015, 21(7): 1688-1698.
[18]LIU Y R, JIANG Y Z, XU X E, et al. Comprehensive transcriptome analysis identifies novel molecular subtypes and subtype-specific RNAs of triple-negative breast cancer[J]. Breast Cancer Res, 2016, 18(1): 33.
[19]JIANG Y Z, MA D, JIN X, et al. Integrated multiomic profiling of breast cancer in the Chinese population reveals patient stratification and therapeutic vulnerabilities[J]. Nat Cancer, 2024, 5(4): 673-690.
[20]JIANG Y Z, LIU Y R, XU X E, et al. Transcriptome analysis of triple-negative breast cancer reveals an integrated mRNA-lncRNA signature with predictive and prognostic value[J]. Cancer Res, 2016, 76(8): 2105-2114.
[21]JIANG Y Z, MA D, SUO C, et al. Genomic and transcriptomic landscape of triple-negative breast cancers: subtypes and treatment strategies[J]. Cancer Cell, 2019, 35(3): 428-440.e5.
[22]ZHAO S, MA D, XIAO Y, et al. Molecular subtyping of triple-negative breast cancers by immunohistochemistry: molecular basis and clinical relevance[J]. Oncologist, 2020, 25(10): e1481-e1491.
[23]JIANG L, YOU C, XIAO Y, et al. Radiogenomic analysis reveals tumor heterogeneity of triple-negative breast cancer[J]. Cell Rep Med, 2022, 3(7): 100694.
[24]ZHAO S, CHEN D P, FU T, et al. Single-cell morphological and topological atlas reveals the ecosystem diversity of human breast cancer[J]. Nat Commun, 2023, 14(1): 6796.
[25]XIAO Y, MA D, YANG Y S, et al. Comprehensive metabolomics expands precision medicine for triple-negative breast cancer[J]. Cell Res, 2022, 32(5): 477-490.
[26]YANG F, XIAO Y, DING J H, et al. Ferroptosis heterogeneity in triple-negative breast cancer reveals an innovative immunotherapy combination strategy[J]. Cell Metab, 2023, 35(1): 84-100.e8.
[27]WANG H, RONG X Y, ZHAO G, et al. The microbial metabolite trimethylamine N-oxide promotes antitumor immunity in triple-negative breast cancer[J]. Cell Metab, 2022, 34(4): 581-594.e8.
[28]DING J H, XIAO Y, YANG F, et al. Guanosine diphosphate-mannose suppresses homologous recombination repair and potentiates antitumor immunity in triple-negative breast cancer[J]. Sci Transl Med, 2024, 16(728): eadg7740.
[29]JIANG Y Z, LIU Y, XIAO Y, et al. Molecular subtyping and genomic profiling expand precision medicine in refractory metastatic triple-negative breast cancer: the FUTURE trial[J]. Cell Res, 2021, 31(2): 178-186.
[30]LIU Y, ZHU X Z, XIAO Y, et al. Subtyping-based platform guides precision medicine for heavily pretreated metastatic triple-negative breast cancer: the FUTURE phase Ⅱ umbrella clinical trial[J]. Cell Res, 2023, 33(5): 389-402.
[31]CHEN L, JIANG Y Z, WU S Y, et al. Famitinib with camrelizumab and nab-paclitaxel for advanced immunomodulatory triple-negative breast cancer (FUTURE-C-plus): an open-label, single-arm, phase Ⅱ trial[J]. Clin Cancer Res, 2022, 28(13): 2807-2817.
[32]FAN L, WANG Z H, MA L X, et al. Optimising first-line subtyping-based therapy in triple-negative breast cancer (FUTURE-SUPER): a multi-cohort, randomised, phase 2 trial[J]. Lancet Oncol, 2024, 25(2): 184-197.
[33]JIN X, ZHOU Y F, MA D, et al. Molecular classification of hormone receptor-positive HER2-negative breast cancer[J]. Nat Genet, 2023, 55(10): 1696-1708.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言


















#乳腺癌# #治疗变革#
8