最全综述:晚期EGFR突变NSCLC患者一线TKIs治疗的耐药机制以及后续治疗策略
2025-03-28 苏州绘真医学 苏州绘真医学 发表于陕西省
本研究探讨了一线TKI治疗耐药的潜在机制以及可能的后续治疗策略。
酪氨酸激酶抑制剂(TKIs)用于治疗晚期EGFR突变的非小细胞肺癌(NSCLC),这标志着晚期肺癌的治疗发生了重大变革。在一线TKI治疗一段时间后会产生耐药性,这使得数十年来EGFR突变NSCLC的治疗指南不断更新。本研究探讨了一线TKI治疗耐药的潜在机制以及可能的后续治疗策略。下一代测序技术(NGS)可能在评估一线TKI治疗的耐药性方面发挥作用。文中讨论了新出现的联合治疗方案以及正在进行的临床试验。本研究还提出了未来潜在的治疗策略以及应对耐药性的管理策略。
引言、背景及EGFR靶向治疗的发展历程
肺癌根据组织学进行分类:其中15%为小细胞肺癌,85%为非小细胞肺癌。约一半的非小细胞肺癌是腺癌,晚期肺腺癌患者以往接受的是传统化疗,总体生存率往往不到一年。最初在肺腺癌患者中发现了存在对EGFR TKIs敏感的EGFR激活突变。在IPASS研究以及其他一些研究中,对晚期EGFR突变NSCLC患者一线使用靶向EGFR突变的TKI吉非替尼,结果显示无进展生存期(PFS)和总生存期(OS)有所提高。Kim等人在24个国家的149个中心开展了一项开放标签的3期研究(INTEREST),在2004年至2006年间招募了1466例曾接受过治疗的晚期NSCLC患者,这些患者被随机分配接受吉非替尼或多西他赛治疗。结果显示吉非替尼与多西他赛相比具有非劣效性,风险比为1.02。Maruyama等人开展了一项3期研究(V-15-32),比较了吉非替尼和多西他赛在既往接受过治疗的日本NSCLC患者中的疗效。虽然根据预先设定的标准,吉非替尼和多西他赛在总生存期方面未显示出非劣效性,但从统计学角度来看,两组的总生存率并无显著差异。
就人口统计学和临床因素而言,亚洲人种、女性、不吸烟以及腺癌被证明是吉非替尼治疗疗效的预测因素。多项研究表明,口服EGFR酪氨酸激酶抑制剂作为一线治疗至少与化疗一样有效。在IPASS试验中,与卡铂-紫杉醇相比,吉非替尼还具有更好的PFS和客观缓解率(ORR)。在总体人群中,吉非替尼的ORR显著更高(43.0% vs. 32.2%;优势比:1.59;95%CI:1.25-2.01;p < 0.001)。在3期开放标签的IPASS试验中,在突变阳性亚组中,接受吉非替尼一线治疗的患者与接受卡铂-紫杉醇传统化疗的患者相比,PFS更长(进展风险比:0.48;95%CI:0.36-0.64;p < 0.001)。在突变阳性亚组中,吉非替尼的ORR为71.2%,而卡铂-紫杉醇为47.3%(p < 0.001)。在日本,Maemondo等人招募了230例符合条件的未经治疗的转移性EGFR突变NSCLC患者,并将他们随机分配到吉非替尼组和化疗组。吉非替尼组的PFS明显长于化疗组(10.8个月 vs. 5.4个月;p < 0.001)。然而,在NEJ002研究中,吉非替尼组和化疗组的平均生存时间在统计学上没有差异,这可能是由于化疗组中吉非替尼的高交叉使用。在另一项开放标签的3期研究(WJTOG3405)中,172例符合条件的患者被随机分配到吉非替尼组和化疗组。吉非替尼组的PFS比化疗组长(9.2个月 vs. 6.3个月;p < 0.0001)。几代EGFR TKIs的相继发现,为晚期EGFR突变NSCLC患者的治疗开辟了新的前景。在第三代TKI出现之前,美国FDA批准厄洛替尼用于治疗至少一次化疗失败的NSCLC患者。
在欧洲开展的开放标签、随机3期EURTAC试验中,2007年-2011年间招募了174例EGFR突变患者,并将其随机分为两组。一组接受口服厄洛替尼(每天150毫克),另一组接受标准化疗。在数据截止时(2011年1月26日),厄洛替尼组的中位PFS为9.7个月(95%CI:8.4-12.3),而标准化疗组为5.2个月(4.5-5.8)。在OPTIMAL研究中,这是一项在中国22个中心开展的开放标签、随机3期试验,招募了83例符合条件的患者并将其随机分为两组。一组接受厄洛替尼治疗,另一组接受标准化疗。厄洛替尼组的平均PFS明显长于化疗组(13.1[95%CI:10.58-16.53]个月 vs. 4.6[4.21-5.42]个月;风险比:0.16;95%CI:0.10-0.26;p < 0.0001)。
Sequist等人开展了随机、开放标签的3期研究LUX-Lung 3。总共招募了345例符合条件的EGFR突变患者,并以2:1的比例随机分配。一组每天口服阿法替尼(40毫克),并与接受标准化疗的另一组进行比较。接受阿法替尼治疗的常见EGFR突变(19号外显子缺失和L858R突变)患者的中位PFS为13.6个月,而化疗组的中位PFS为6.9个月(HR:0.47;95%CI:0.34-0.65;p = 0.001)。Wu等人在亚洲开展了开放标签、随机3期试验LUX-Lung 6。总共364例符合条件的患者被随机分配(2:1)接受每日口服阿法替尼(40毫克)或标准化疗。阿法替尼组的中位PFS为11.0个月,而化疗组的中位PFS为5.6个月(HR:0.28;95%CI:0.20-0.39)。2013年7月,FDA批准阿法替尼用于一线治疗EGFR突变阳性的转移性非小细胞肺癌,阿法替尼是ErbB家族酪氨酸激酶的不可逆抑制剂,可与EGFR、HER2和HER4结合,不可逆地抑制酪氨酸激酶的自磷酸化。Wu等人开展了随机、开放标签、3期研究ARCHER 1050。在2013年5月至2015年3月期间,452例符合条件的患者被随机分配接受达可替尼或吉非替尼治疗。达可替尼组的中位PFS为14.7个月,而吉非替尼组的中位PFS为9.2个月(HR:0.59;95%CI:0.47-0.74;p < 0.0001)。
第三代TKI奥希替尼最初被FDA批准用于治疗转移性EGFR T790M突变阳性的非小细胞肺癌成年患者。Soria及其他FLAURA研究人员开展了一项双盲3期试验,将556例符合条件的未经治疗的常见EGFR突变(19号外显子缺失或L858R)患者以1:1的比例随机分配接受奥希替尼或吉非替尼治疗。奥希替尼组的中位PFS为18.9个月,而吉非替尼组的中位PFS为10.2个月(疾病进展或死亡风险比:0.46;95%CI:0.37至0.57;p < 0.001)。按照试验设计进行了连续2年的研究和随访后,奥希替尼组的中位OS为38.6个月,而吉非替尼组的中位OS为31.8个月(死亡风险比:0.80;95.05%CI:0.64-1.00;p = 0.046)。鉴于FLAURA试验中记录的奥希替尼与标准TKI方案相比具有显著的缓解持续时间和改善的OS,FDA批准奥希替尼作为晚期EGFR突变非小细胞肺癌的一线治疗药物。尽管使用奥希替尼进行治疗,大多数患者的病情仍会进展。先前的研究,包括2期和3期NEJ009研究,显示吉非替尼联合铂类化疗的疗效明显优于吉非替尼单药治疗。为了研究奥希替尼联合化疗的疗效,Planchard及其他FLAURA2研究人员开展了3期国际开放标签FLAURA2试验。在2020年6月至2021年12月期间,招募了557例符合条件的患者,并将他们随机分配到奥希替尼-化疗组和奥希替尼组。奥希替尼-化疗组83%的患者和奥希替尼组76%的患者观察到了客观缓解;奥希替尼-化疗组的中位缓解持续时间为24.0个月,奥希替尼组为15.3个月。由于其显著的疗效优势,美国NCCN已将奥希替尼联合化疗列为晚期EGFR突变非小细胞肺癌的1类治疗方案。
埃万妥单抗是一种EGFR间充质-上皮转化因子(MET)双特异性单克隆抗体,可与EGFR和MET的细胞外结构域结合,最初被FDA批准用于治疗携带20号外显子插入(Ex20ins)突变的局部晚期或转移性非小细胞肺癌成年患者。在工程细胞系、患者来源细胞(PDCs)和患者来源异种移植瘤(PDXs)中,埃万妥单抗(JNJ-61186372)显示出抗肿瘤活性。Yun等人开展了一项研究,利用过表达EGFR Ex20ins的Ba/F3细胞,并比较了埃万妥单抗(JNJ-61186372)与第一代和第三代不可逆EGFR TKIs吉非替尼和奥希替尼的抗肿瘤活性。在Ba/F3细胞中存在五种不同的Ex20ins,使用剂量范围为0.05-1 mg/mL的埃万妥单抗进行治疗。观察到BA/F3细胞活力显著且呈剂量依赖性下降。相比之下,吉非替尼和奥希替尼的治疗显示出有限的抗肿瘤活性。在一项1期开放标签、剂量递增和剂量扩展研究(CHRYSALIS)中,Park等人招募了符合条件的经铂类治疗后的EGFR Ex20ins非小细胞肺癌患者,并给予推荐剂量1050毫克的埃万妥单抗治疗(前4周每周一次,然后每2周一次)。在CHRYSALIS队列D中,总体缓解率为40%,缓解持续时间为11.1个月。中位PFS为8.3个月(95%CI:6.5-10.9)。利用大规模临床基因组数据库LC-SCRUM-Asia,确定了189例携带EGFR 20号外显子框内插入的非小细胞肺癌患者。在将20号外显子进一步分类为近环插入或远环插入后,Okahisa等人发现,与远环插入患者相比,奥希替尼治疗在20号外显子近环插入患者中与更长的PFS相关(中位值:5.6个月 vs. 2.0个月;HR[95%CI]:0.22[0.07-0.64])。在CHRYSALIS试验中,接受铂类化疗后,携带EGFR 20号外显子的非小细胞肺癌患者使用埃万妥单抗治疗与LC-SCRUM-Asia中接受多西他赛、经典TKIs或免疫治疗的患者相比,在PFS和OS方面实现了风险降低。
众所周知,使用埃万妥单抗可能会引起输液相关反应,包括寒战、呼吸困难、面部潮红、恶心、胸部不适和呕吐。为了预防和处理埃万妥单抗输液相关反应,Park等人制定了缓解策略和输液方案,包括预先使用类固醇、抗组胺药和止吐药。第1天通过外周静脉输注分剂量的350毫克埃万妥单抗,随后在第2天输注700毫克或1050毫克。在第8天、15天和22天实施连续的负荷方案。输液相关反应(IRRs)主要发生在早期,即在埃万妥单抗输注的前60分钟内。通过这种缓解策略,医生可以减轻埃万妥单抗输注引起的IRRs的严重程度。在MARIPOSA试验中,与奥希替尼组相比,埃万妥单抗-拉泽替尼在既往未治疗或接受过奥希替尼预处理的EGFR突变晚期非小细胞肺癌患者中导致了更优的PFS和中位缓解持续时间。在NCCN非小细胞肺癌临床实践指南的第11版(2024年)和第3版(2025年)中,奥希替尼联合或不联合化疗以及埃万妥单抗-拉泽替尼被列为携带EGFR 19号外显子缺失或21号外显子L858R突变的成年晚期非小细胞肺癌患者的一线治疗方案(表1)。
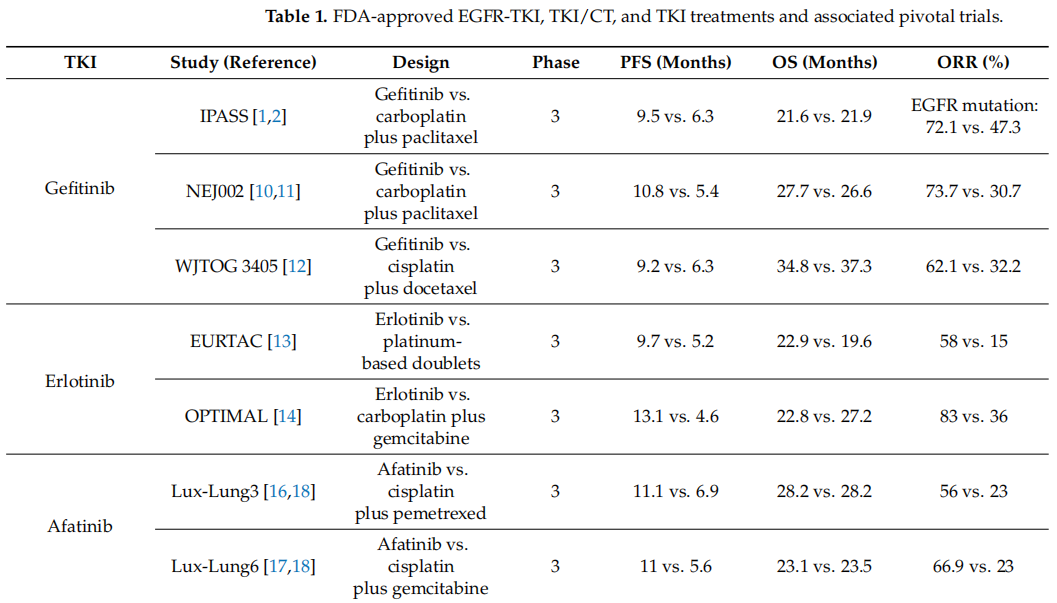
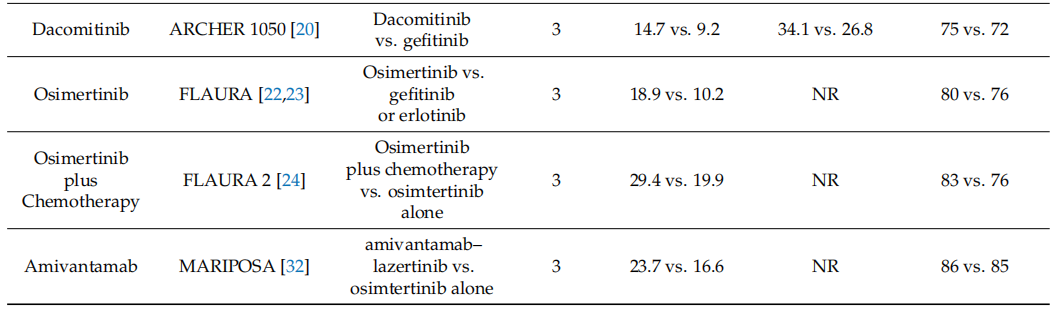
表1
耐药性与机制
随着TKIs的应用,EGFR突变的肺腺癌患者在接受数月或数年的治疗后,病情会出现进展。通过多种耐药机制产生的耐药性可分为获得性突变、旁路信号激活和表型转化。最常见的获得性突变是EGFR T790M突变,该突变增加了对ATP的亲和力,并降低了第一代和第二代TKIs的疗效。在一项开放标签、探索性、随机对照的2B期试验LUX-Lung 7中,Park等人招募了319名符合条件的患者,并将他们随机分为阿法替尼组和吉非替尼组。阿法替尼组和吉非替尼组的PFS和至治疗失败时间如下:PFS为11.0个月 vs. 10.9个月(HR:0.73 [95%CI:0.57-0.95]);至治疗失败时间在阿法替尼组为13.7个月 [95%CI:11.9-15.0],在吉非替尼组为11.5个月;HR为0.73([95% CI:0.58-0.92];P = 0.0073)。为了研究一线EGFR-TKI治疗后获得性耐药的晚期EGFR突变肺腺癌患者中T790M突变的发生频率,Huang等人招募了205名EGFR突变的IIIB-IV期肺腺癌患者。在病情进展后,进行了再次活检。再次活检中T790M突变率为46.3%。在亚组分析中,研究表明携带19号外显子缺失的患者T790M突变率为55.0%,而携带L858R点突变的患者突变率为37.3%(校正比值比:2.14;95%CI:1.20-3.83;P = 0.010)。在台湾的一项回顾性观察研究中,招募了407名患者,并对这些患者进行了再次活检,以进一步鉴定T790M突变。总体再次活检的T790M突变率为52.8%。根据先前的一线TKI治疗情况,T790M突变率存在统计学差异(吉非替尼:59.9%;厄洛替尼:45.5%;阿法替尼:52.7%;P = 0.037)。进一步的多变量逻辑回归分析表明,具有常见基线EGFR突变的患者、接受吉非替尼治疗的患者(与厄洛替尼相比)以及TKI治疗时间较长的患者,T790M突变发生率更高。
希腊的一项单国、多中心、前瞻性队列研究 “LUNGFUL” 观察性研究,旨在评估接受过第一代或第二代TKIs(厄洛替尼、吉非替尼和阿法替尼)且病情进展的晚期EGFR突变NSCLC患者中获得性T790M耐药的发生频率。研究人员在2017年7月至2019年9月期间招募了96名符合条件的患者,其中94名患者接受了液体活检,其余2名患者接受了组织活检。使用cobas® EGFR突变检测方法,在16.0%(15/94)的血浆活检样本和1份来自原发肿瘤的组织活检样本中检测到了T790M突变。就种族而言,白种人患者的T790M突变率低于先前描述的亚洲人群研究中所发现的突变率。在一项分析第一代和第二代TKIs治疗后T790M突变率的网络荟萃分析中,纳入了29项研究。T790M再次活检样本大多来自组织;其中4项研究包括组织和液体样本,3项研究包括组织和血浆样本,3项研究仅收集了血浆样本。接受阿法替尼治疗的T790M突变率为33%,接受吉非替尼治疗的为49%,接受厄洛替尼治疗的为47%(P < 0.001)。根据种族确定了获得性T790M突变率的轻微差异,亚洲患者的突变率为43%,白种人患者的为47%。Huang等人前瞻性地招募了80名符合条件的晚期EGFR突变肺腺癌患者。在TKI治疗前以及治疗开始后每3个月收集血浆样本。通过分析液滴数字PCR(ddPCR)检测血浆ctDNA中的T790M,并且对患者进行随访,直至他们死亡或到2021年底。在80名符合条件的患者中,75名出现疾病进展,其中53/75(71%)接受了再次活检。在28/53(53%)的样本中检测到了T790M突变,而ddPCR检测在23/53(43%)的样本中检测到T790M突变阳性。组织再次活检与血浆ddPCR的一致性率为76%。
一线和二线EGFR-TKIs与贝伐珠单抗联合治疗也可能导致T790M突变的发生。在回顾性多中心TERRA研究中,招募了在一线贝伐珠单抗与第一代或第二代TKI联合治疗后病情进展的符合条件的患者。在病情进展后,107名患者中的71名接受了组织活检,其余36名患者接受了液体活检。总共有59名患者被证实存在T790M突变(55.1%),其中40/71(56.3%)通过组织再次活检确定,17/30(56.7%)通过血浆检测确定,这意味着两种检测方法的检测率相似。
已经提出了晚期EGFR突变NSCLC患者在一线和二线TKI治疗后产生耐药性的几种潜在机制。除了EGFR T790M的获得性突变外,EGFR C797S突变会影响第三代TKIs(如奥希替尼)的结合亲和力。JA等人观察到对吉非替尼敏感的肺癌细胞系因MET癌基因的局灶性扩增而对吉非替尼产生耐药性。在德国的一项研究中,Wagener-Ryczek等人分析了对不同代TKIs的获得性耐药谱。参与者在接受TKI治疗6个月后进行再次活检。在厄洛替尼/吉非替尼组中,56%的患者发生了T790M突变,22%的患者发生了多种突变。在阿法替尼组中,40%的患者发生了T790M突变,11%的患者发生了多种突变。在一项随机、国际、开放标签的3期试验中,Mok等人招募了419名具有T790M耐药突变的晚期NSCLC患者。符合条件的患者以2:1的比例随机接受奥希替尼(80毫克,每日一次)或全身化疗。奥希替尼组的中位PFS明显长于化疗组(10.1个月 vs. 4.4个月;风险比:0.30;95%CI:0.23-0.41;P < 0.001)。在AURA研究中,奥希替尼在携带T790M突变的患者中,甚至在有脑转移的患者中,都显示出比化疗更高的疗效。
由于FLAURA试验中报道的总生存期显著延长,奥希替尼在晚期EGFR突变NSCLC的二线或一线治疗中具有双重作用。由于晚期EGFR突变NSCLC的治疗线数不同,在使用奥希替尼后可能会出现不同的耐药发生率。耐药机制可分为获得性突变、旁路信号激活和表型转化。旁路信号激活涉及替代途径的上调,如MET、HER2和RAS-MAPK,这些途径使肿瘤细胞即使在EGFR受到抑制的情况下仍能维持增殖。表型转化包括上皮-间质转化(EMT)和小细胞肺癌(SCLC)转化。在AURA 3研究中,60名未接受过治疗的患者被随机分为两组,分别接受每日一次80毫克(30名患者)或160毫克的奥希替尼治疗。42名(70%)患者出现疾病进展,在疾病进展时或之后从38名(91%)患者中收集了血浆NGS分析样本。在AURA试验队列的患者中,来自四个机构的143名T790M突变的NSCLC患者在开始奥希替尼治疗前接受了肿瘤或血浆基因分型检测。41名患者出现肿瘤进展,并接受了肿瘤活检以进行肿瘤基因组NGS分析。13名患者EGFR T790M突变仍为阳性(32%),32名患者(28%)检测到C797S突变。28名患者(68%)观察到T790M突变缺失。通过耐药活检确定的持续存在T790M突变的患者停用奥希替尼的中位时间(TTD)为15.2个月,而根据耐药活检T790M突变缺失的患者中位TTD为6.1个月。
为了评估二线奥希替尼耐药情况,Le等人回顾性调查了德克萨斯大学MD安德森癌症中心的肺癌登月计划GEMINI数据库中接受过奥希替尼治疗的晚期NSCLC患者,以及莫菲特癌症中心和研究所(MCC)的莫菲特电子健康记录、临床基因组行动委员会数据库中具有EGFR T790M突变的NSCLC患者。在MD安德森癌症中心(MDACC),对组织样本进行50基因检测,对血液样本使用数字液滴PCR。在MCC对EGFR基因进行焦磷酸测序和Moffitt Illumina TruSight肿瘤26(TST26)测序。两个机构都使用了商业可用的NGS平台,如FoundationOne和Guardant360。总共招募了118名患者。基于先前EGFR TKI治疗的中位至治疗失败时间(TTF)为14个月。对奥希替尼治疗的中位随访时间为13个月。亚组分析表明,先前存在的中枢神经系统(CNS)转移会导致更差的预后。
Papadimitrakopoulou等人对AURA3研究中招募的患者进行了血浆ctDNA分析。检测到了与T790M突变同时存在的共突变,包括TP53(64%)和EGFR扩增(33%)。由于美国FDA在2018年4月基于FLAURA试验中显示的显著PFS获益批准奥希替尼作为一线治疗药物,对奥希替尼的一线耐药性一直在研究中。Yu等人开展了ORCHARD研究,这是一项开放标签、多中心、多药、生物标志物导向的2期平台研究,招募了符合条件的一线奥希替尼单药治疗后病情进展的晚期EGFR突变患者。利用纵向样本,对肿瘤负荷进行了ctDNA分析。在该平台研究中安排了13个联合治疗组,以评估联合治疗的疗效、安全性和耐受性,该研究预计于2025年6月完成。Chmieleck等人基于FLAURA研究报道了一项关于一线奥希替尼耐药的研究。总共279名患者被随机分为奥希替尼组,并对其中109/137名患者进行了获得性耐药分析。研究人员发现38/109(35%)的患者存在可检测到的耐药机制。最常见的获得性耐药机制是MET扩增(16%),其次是EGFR突变(10%)。7名患者(6%)发生了C797S突变,2名患者发生了L718Q突变。
Tamiya等人在日本进行了一项前瞻性观察研究,即ELUCIDATOR研究,以调查一线奥希替尼治疗的获得性耐药情况。在基线、3个月、12个月以及检测到疾病进展后,从符合条件的招募患者中收集系列血浆样本。使用NGS对178名患者的血浆样本进行了分析。携带L858R突变患者的PFS明显低于携带EGFR 19号外显子缺失的患者(中位PFS:17.2 [95%CI:12.0-19.5] 个月 vs. 23.3 [95%CI:14.5-30.2] 个月)。在ctDNA中携带TP53共突变患者的PFS和OS率明显低于ctDNA中无TP53突变的患者(中位PFS:12.5 [95%CI:7.1-19.3] 个月)。在ctDNA中携带EGFR扩增患者的PFS和OS率明显低于ctDNA中无EGFR扩增的患者。在ctDNA中携带MET扩增患者的PFS和OS率明显低于ctDNA中无MET扩增的患者。携带PIK3CA共突变的患者PFS率低于无PIK3CA突变的患者。A. Leonetti等人在意大利进行了一项单中心前瞻性研究,招募了未接受过TKI治疗的晚期EGFR突变患者或一线EGFR-TKIs治疗后病情进展的患者。前瞻性地招募了65名患者,中位随访时间为25.2个月。在基线和疾病进展时对组织样本进行NGS分析。TP53是最常见的共突变(59.7%),其次是CDK4(14.5%)和TERT(12.9%)。携带TP53共突变的患者PFS率明显更低(12.2个月 vs. 未达到;P = 0.017),中位缓解持续时间(DoR)更短(9.8个月 vs. 未达到;P = 0.007)。35名(56.5%)患者出现疾病进展,16名患者进行了组织再次活检。此外,26/29(89.7%)的患者进行了液体活检。观察到了EGFR依赖的耐药机制,包括EGFR C797S(n = 3)、L718Q(n = 1)、T751I(n = 1)、20号外显子插入(n = 1)突变以及EGFR扩增(n = 6)。对于疾病进展时组织和血浆的一致性分析,对16/29名患者的组织和血浆NGS检测panel进行了分析,发现平均一致性率较高(14/16,87.5%)。
在3期FLAURA研究中,最常见的耐药机制是MET扩增(16%),其次是EGFR C797S突变(6%)。基于在FLAURA研究中疾病进展和/或治疗中断时收集的血浆样本,确定了潜在的早期获得性耐药机制。在将奥希替尼作为一线治疗的患者组中,10-25% 的患者发生了EGFR依赖的突变,EGFR依赖突变的最常见原因是EGFR 20号外显子C797S突变,导致半胱氨酸797结合位点的破坏。其他EGFR突变,如L792 H/L792 V、G796S/G796C、G724S和G719A,都与奥希替尼耐药有关。Minari等人发表了一篇综述文章,讨论了对第三代EGFR-TKIs的耐药机制。EGFR依赖的耐药机制包括C797S突变、p.L798I、p.L692V和p.E709K。EGFR非依赖的耐药机制包括旁路途径激活、HER2和MET扩增、PIK3CA激活突变、PTEN缺失、RAS-MAPK途径激活。耐药机制中的表型改变包括小细胞肺癌(SCLC)转化。
Yang等人进行了一项研究,对93名奥希替尼耐药的肺癌患者样本中的416个癌症相关基因进行了NGS检测。分别在24.7%、10.8%和9.7%的病例中检测到了EGFR G796/C797、L792和L718/G719突变。在III期FLAURA研究中,Chmielecki等人通过NGS评估来自配对血浆样本(基线和疾病进展/治疗中断)的循环肿瘤DNA,确定了一线奥希替尼治疗的获得性耐药机制(患者具有基线EGFR突变)。一线奥希替尼治疗最常见的耐药机制是MET扩增(n = 17;16%)和EGFR C797S突变(n = 7;6%);相比之下,如先前研究所示,二线奥希替尼治疗最常见的耐药机制是获得性EGFR突变(如C797S),以及MET和ERBB2(HER2)的扩增。在FLAURA研究中,279名患者被随机分配接受奥希替尼治疗,277名患者被分配接受对照的EGFR-TKI治疗。Chmielecki等人通过对各治疗组的血浆ctDNA分析,研究了获得性耐药机制。在奥希替尼治疗组中,检测到的最常见获得性耐药机制是MET扩增,出现在17名患者中(占比16%),其次是11名患者(占比10%)出现了EGFR突变。在对照的EGFR-TKI治疗组中,检测到的最常见获得性耐药机制是EGFR T790M突变,其次是MET扩增(占比6%)和CDK6扩增(占比4%)。在FLAURA研究 中,从109名患者处获取了配对的血浆样本,并在治疗前和疾病进展后使用NGS进行分析。接受奥希替尼一线治疗后,最常见的耐药情况是MET扩增(占比16%),其次是EGFR C797S突变(占比6%)。在对照组(使用吉非替尼或厄洛替尼进行一线TKI治疗)中,最常见的耐药机制是T790M突变(占比44%),其次是MET扩增(占比6%)。除了EGFR突变之外,对两组患者组织样本的NGS分析还显示出其他突变,包括TP53(占比62%)、EGFR扩增(占比20%)、RB1、RBM10、HER2、MET、SMARCA4以及RICTOR。就晚期NSCLC患者使用奥希替尼进行二线治疗而言,在AURA研究中,最常见的耐药机制是MET扩增和EGFR C797S突变。大约一半的患者检测不到EGFR T790M突变了。
在意大利的一项研究中,Leonetti等人招募了在2018年5月-2022年11月期间正在接受奥希替尼一线或二线治疗的晚期EGFR突变NSCLC患者。62名患者在基线时对其组织样本或相应的血浆样本进行了NGS检测。在疾病进展时,进行了配对的组织活检和血浆样本检测。总体而言,MET扩增是最常见的耐药机制(占比24%),其次是MET扩增伴EGFR C797S突变(占比8%)。在基于组织样本或相应血浆样本的NGS一致性分析以评估疾病进展情况时,平均一致性率为87.5%。在台湾,Liao等人与台湾肿瘤合作小组合作开展了一项真实世界队列研究,并对晚期NSCLC患者进行了T1521 NGS分析。在队列1(一个EGFR突变且曾接受过治疗的组)中,11.6%(28/250)的患者存在MET扩增,4.0%(10/250)的患者存在ERBB2扩增。在接受奥希替尼治疗的患者中,检测到EGFR C797S突变(占比6.2%,5/81)和BRAF V600E突变(占比2.5%,2/81)。
人们已经对EGFR非依赖的耐药途径进行了研究。上皮-间质转化(EMT)可能是对EGFR TKIs产生获得性耐药的驱动因素,AXL酪氨酸激酶、Notch-1的激活、IGF1R的激活、MAPK以及AKTSrc/FAK网络也可能是驱动因素,这些因素汇聚于AKT和MAPK,从而维持致癌信号传导并诱导EMT。
与癌基因的共突变
携带EGFR突变的晚期肺腺癌患者可能同时存在其他突变的原癌基因或表达失调的抑癌基因。在先前的综述研究中,常见的同时发生的基因突变为TP53(占比55%-65%)、MET变异(多体性:23%-29%;扩增:3%)以及PIK3CA突变(3.5%)。Qin等人对EGFR或ALK突变患者中同时存在的TP53突变进行了荟萃分析。最终分析纳入了15项研究,涉及1342名患者,结果显示,同时存在TP53突变与不良的PFS相关(HR = 1.88;95%CI:1.59-2.23;P < 0.001),也与不良的OS相关(HR = 1.92;95%CI:1.55-2.38;P < 0.001)。Ferrara等人在对EGFR-TP53共突变的预后影响进行荟萃分析时发现,与EGFR突变/TP53野生型组相比,TP53共突变组的PFS更短(HR = 1.67;95%CI 1.51-1.83;P = 0.18)。
为了评估同时存在的PIK3CA突变对EGFR-TKIs治疗反应的影响,Juliana Eng等人回顾性地确定了2009年-2013年间纽约纪念斯隆凯特琳癌症中心的相关患者。其中37名患者同时存在PIK3CA突变。对于EGFR突变的肺腺癌患者来说,其OS比仅携带EGFR突变的患者更短(95%CI:28.2个月-未达到;P = 0.006)。在PI3K/Akt网络中,已确定了三类PI3K。I类PI3K在癌症的发生发展中起着关键作用。PI3K/Akt信号通路的激活涉及多种因素,包括RTK家族、Toll样受体(TLRs)和B细胞抗原受体(BCRs)。mTOR作为丝氨酸和苏氨酸的下游效应分子,据报道可调节肿瘤的生长、存活、代谢和免疫。PI3K/Akt信号通路对于包括肺癌在内的多种癌症的耐药性具有重要意义。PI3K/Akt抑制剂可以抑制肿瘤生长,并进一步诱导肿瘤细胞凋亡。PI3K通路通过降低细胞间粘附力和增强细胞迁移能力来促进肿瘤转移。Daher等人对携带PIK3CA突变的NSCLC患者进行了一项大数据集研究。将仅携带PIK3CA突变的患者与同时存在基因变异的患者进行比较时发现,后者年龄更小,且在病理检查中女性肺腺癌患者更多。PI3K/Akt通路失调在癌症耐药中也起着重要作用。PIK3CA突变可触发AKT/mTOR通路中的AKT和mTOR,进一步促进旁路通路的激活、下游通路激活、上皮-间质转化(EMT)以及细胞的存活和增殖。
MET是一种由二硫键连接的异二聚体RTK,由细胞外的α链和β链组成。其细胞内成分包括一个近膜区域,负责信号下调和受体降解。C末端区域可作为一个锚定位点,引发下游信号级联反应,如PI3K、STATs以及MAPK。
MET扩增是由MET基因拷贝数增加引起的,可导致蛋白质连续过度表达和酪氨酸激酶活性增强。它可作为EGFR-TKI治疗后的一种耐药机制。检测MET扩增有三种方法:荧光原位杂交(FISH)、实时定量聚合酶链反应和二代测序(NGS)。检测MET扩增的金标准是对实体组织活检样本进行FISH。NGS可作为FISH的替代方法,用于检测MET变异,如14号外显子跳跃突变或扩增。基于DNA或RNA的NGS可用于诊断MET 14号外显子跳跃突变。由于FISH与治疗结果有很强的相关性,它是一种被广泛接受的标准检测方法。Camidge等人根据FISH结果招募了38名MET与CEP7比值大于或等于1.8的患者,并根据患者的MET扩增水平进行分层分析,同时口服克唑替尼进行治疗。结果发现,MET扩增水平较高的患者客观缓解率更高。在NSCLC患者中,MET 14号外显子跳跃突变的发生率为3%-4%,MET扩增的发生率为1%-6%。在GEOMETRY mono-1试验中,Wolf等人进行了一项多队列的2期研究,招募了携带MET 14号外显子跳跃突变或MET扩增的晚期NSCLC患者。他们发现,97名患者存在MET 14号外显子跳跃突变,210名患者存在MET扩增。之前接受过治疗的患者被纳入队列1至4。经独立评审委员会评估,在69名之前接受过治疗的患者中,总体缓解率为41%,在28名未接受过治疗的患者中,总体缓解率为68%。之前接受过治疗的患者的中位缓解持续时间为9.7个月,未接受过治疗的患者的中位缓解持续时间为12.6个月。Paik等人进行了一项开放标签的2期研究,对确诊为携带MET 14号外显子跳跃突变的符合条件的晚期NSCLC患者,每天一次给予特泊替尼(剂量为500毫克)进行治疗。对MET 14号外显子跳跃突变的检测,是通过使用NGS检测panel Guardant360对从血浆(液体活检)中获得的cfDNA进行集中检测,或者通过使用Oncomine Focus Assay检测从新鲜或存档(福尔马林固定、石蜡包埋)肿瘤活检组织中获得的RNA来进行的。经独立评审确定,联合活检组的缓解率为46%(95%CI:36%-57%),中位缓解持续时间为11.1个月。
MET是位于7号染色体q21-q31区域的一个原癌基因,编码一种高亲和力的跨膜受体酪氨酸激酶(RTK)。MET受体由一个细胞外区域、免疫球蛋白结构域以及一个细胞内区域组成,细胞内区域包括一个近膜结构域、催化酪氨酸激酶结构域和羧基末端锚定位点。当MET受体与它的配体特异性结合后,会激活其细胞内酪氨酸激酶的催化活性,从而导致下游RAS/ERK/MAPK、PI3K/AKT、Wnt/β-连环蛋白和STAT信号通路的激活。这些级联反应与细胞增殖、存活、迁移相关,在胚胎发育、伤口愈合和组织再生中发挥着重要作用。
埃万妥单抗是一种源自IgG1同型的人源单克隆抗体,它能够与免疫细胞上IgG的Fc片段受体(FcγRs)结合,与EGFR和MET的细胞外结构域结合,并以剂量依赖的方式阻断配体。埃万妥单抗还可诱导细胞凋亡和抗体依赖的细胞介导的细胞毒性作用(ADCC),这是一种细胞介导的免疫防御机制,在这种机制中,经典的效应细胞(已知为免疫系统中的自然杀伤细胞(NK细胞))可杀死其膜表面抗原已被特异性抗体结合的靶细胞,且该过程不依赖于免疫补体系统。除了被批准作为EGFR Ex20ins突变NSCLC的标准治疗药物外,在MARIPOSA试验中,与奥希替尼单药治疗相比,埃万妥单抗联合拉泽替尼作为晚期EGFR突变NSCLC的一线治疗方案显示出了疗效和安全性。埃万妥单抗联合拉泽替尼的治疗效果不受EGFR酪氨酸激酶结构域的继发突变(如C797S、L718Q、G742S和S769I)的影响。在基于MARIPOSA试验的一项二次分析中,Felip等人发现,对于携带TP53共突变的患者,埃万妥单抗联合拉泽替尼组的mPFS比奥希替尼组有所改善(18.2个月 vs. 12.9个月;HR:0.65 [95%CI:0.48-0.87]);同时,在随机分组的基线时有肝转移的患者中,埃万妥单抗联合拉泽替尼组的mPFS比奥希替尼组长(18.2个月 vs. 11.0个月;HR:0.58(95%CI:0.37-0.91);P = 0.017),在基线时无肝转移的患者中也是如此(24.0个月 vs. 18.3个月;HR:0.74(95%CI:0.60-0.91);P = 0.004)。
NGS及相关一致性
NGS已成为临床实践中监测耐药突变、指导后续治疗决策以及追踪肿瘤异质性的有效工具。它可以通过组织活检或液体活检(cfDNA)来进行,以检测关键的耐药相关变异,例如EGFR T790M、C797S突变,MET扩增,HER2扩增以及PIK3CA突变。液体活检有助于实时、无创地监测治疗反应,并能早期检测新出现的耐药机制,从而实现及时的治疗方案调整。国际肿瘤学会已推荐将基于NGS的液体活检用于肺癌的分子评估。ctDNA可作为一种用于早期诊断、分子分析、治疗决策和疗效监测的工具。为了测试治疗前液体NGS检测的有效性,Yang等人招募了180名疑似晚期NSCLC患者。所有参与者在签署知情同意书后被随机分为两组,并使用Guardant360 74基因检测法(Guardant Health公司,美国加利福尼亚州雷德伍德城)进行cfDNA-NGS检测。在其中一组中,医生在收到组织活检和液体活检报告后开始治疗;在另一组中,主治医生在收到液体活检报告后就开始治疗。在仅接受液体活检的组中,患者在开始靶向治疗前的等待时间更短。在已确定驱动突变的患者组中,检测结果的一致性率很高。
在西班牙的一项研究中,Arriola等人招募了154名符合条件的患者,并采集了他们配对的肿瘤样本和血清样本。组织样本和血浆样本中EGFR突变状态的一致性率为88.8%,敏感性为45.5%,特异性为96.7%。van der Wel等人招募了符合条件的在二线或三线奥希替尼治疗后出现病情进展的晚期NSCLC患者。使用AVENIO扩展检测panel进行血浆测序,并对肿瘤活检样本进行DNA和RNA测序。在42/51份血浆样本(82%)和50/51份肿瘤样本(98%)中检测到了驱动突变,一致性率为80%。研究结果表明,配对的血浆和肿瘤样本能够识别在二线或三线奥希替尼治疗后病情进展的晚期NSCLC患者的耐药机制,这为探索个性化和精准治疗提供了可能性。在欧洲的一项前瞻性、单中心研究 中,招募了50名在二线奥希替尼治疗后出现疾病进展的转移性NSCLC患者,对他们进行了肿瘤组织活检,并采集了血液样本用于ctDNA分析。从组织中分离出DNA和RNA;使用Illumina AmpliseqTM癌症热点检测panel v2-SOCv1(Illumina公司,美国加利福尼亚州圣地亚哥)进行DNA NGS检测,使用Archer FusionPlex Lung版本1(IDTDNA公司,前身为Invitae和Archer Dx公司,美国科罗拉多州博尔德)进行RNA NGS检测。对于ctDNA分析,当VAF至少为0.10%时报告变异情况。41名患者提供了匹配的样本,并且在组织和血液ctDNA分析中成功进行了分子谱分析。主要驱动突变识别的一致性率为80.4%。
治疗策略及耐药后的进一步管理
NCCN已批准奥希替尼联合化疗,以及埃万妥单抗联合拉泽替尼作为携带EGFR突变的晚期NSCLC患者的一线治疗方案。各种一线治疗方案后出现的耐药可能会以不同的耐药表现形式演变。多项临床试验和临床前研究证实了联合治疗在克服晚期EGFR突变NSCLC耐药方面的有效性。对于由MET驱动的耐药,涉及奥希替尼和MET抑制剂(如赛沃替尼、卡马替尼、特泊替尼)的联合治疗已显示出有前景的结果。TATTON研究是一项多队列、多中心、开放标签的Ib期研究,分为几个部分。在A部分中,初始剂量为奥希替尼80毫克联合赛沃替尼600毫克,随后赛沃替尼剂量调整为每日一次800毫克。在B部分中,该组又细分为三个小组。B1组由之前接受过第三代EGFR-TKI治疗的符合条件的患者组成;B2组是未曾接受过第三代TKI治疗且T790M阴性的符合条件的患者;B3组是未曾接受过第三代TKI治疗且T790M阳性的符合条件的患者。至于D部分的小组,对于未曾接受过第三代TKI治疗且T790M阴性的符合条件的患者,给予每日80毫克奥希替尼和每日一次300毫克赛沃替尼的治疗方案。
较低剂量的赛沃替尼与奥希替尼联合使用时,观察到耐受性有轻微改善。TATTON试验和SAVANNAH试验表明,奥希替尼与MET抑制剂联合使用可提高MET扩增患者的缓解率。
对于旁路信号通路激活的情况,已经探索了EGFR TKI 联合MEK抑制剂(如奥希替尼联合司美替尼)来对抗RAS-MAPK信号通路的激活。同样,也研究了EGFR TKI联合抗血管生成药物(如奥希替尼联合贝伐珠单抗)以抑制肿瘤进展。在2期WJOG9717L研究中,将未接受过治疗的携带EGFR突变的非鳞状NSCLC患者随机分为两组,分别接受每日奥希替尼联合贝伐珠单抗(每3周15毫克/千克)治疗或仅接受奥希替尼单药治疗。在中国的一项荟萃分析中,10项随机对照试验共纳入了824名符合条件的患者。试验组(奥希替尼联合贝伐珠单抗)的ORR更高(相对风险 [RR] = 1.23,95%CI = 1.03-1.47,P = 0.02)。同时,试验组的CEA和VEGF水平显著降低。在西日本肿瘤学组8715L的2期随机临床试验中,Akamatsu等人招募了在先前接受EGFR-TKI治疗后出现疾病进展的晚期肺腺癌患者,并将符合条件的患者以1:1的比例随机分为奥希替尼联合贝伐珠单抗组或奥希替尼单药组。与奥希替尼单药治疗组相比,联合治疗组并未显示出PFS的延长。
在欧洲胸部肿瘤平台(ETOP 10-16)的BOOSTER试验中,从6个欧洲国家招募了155名符合条件的患者,并将他们随机分为奥希替尼联合贝伐珠单抗组或奥希替尼单药组。同样,联合治疗组和奥希替尼单药组的中位PFS没有显著差异。在亚组分析中,当前和曾经的吸烟者在接受联合治疗时PFS显著更长 [HR:0.57(0.33-0.98);Wald检验P = 0.043]。在欧洲,12%-15%的NSCLC患者群体中发现有EGFR突变。瑞士的一项回顾性队列研究在2015年11月至2022年5月期间招募了149名符合条件的EGFR突变NSCLC患者。其中78名患者出现疾病进展。除了局部消融治疗外,40名患者接受了二线治疗,包括18名(45.0%)接受卡铂/培美曲塞治疗,8名(20.0%)接受卡铂/紫杉醇/贝伐珠单抗/阿替利珠单抗(IMPOWER 150方案)治疗,3名(7.5%)接受卡铂/紫杉醇治疗,以及3名(7.5%)接受阿法替尼治疗。其余8名患者(20.0%)中的一些人接受了超适应症使用的MET抑制剂,如赛沃替尼和特泊替尼。在这项瑞士的真实世界队列研究中,OS为51.6个月,而疾病发展为寡进展且接受局部消融治疗的患者的OS为60个月。这一惊人的结果强调了根据个性化治疗方法进行频繁检查和及时进行特定局部区域治疗的重要性。在一项亚洲回顾性研究中,纳入了60名符合条件的患者。初始一线治疗为奥希替尼单药治疗。中位至治疗失败时间为14.4个月。开始培美曲塞-铂类化疗联合奥希替尼二线治疗的中位时间为41天。培美曲塞-铂类化疗联合奥希替尼二线治疗的中位至治疗失败时间为6.6个月。
已经开展了多项免疫治疗联合化疗的试验,包括Checkmate-722、KEYNOTE-789、ORIENT-31、IMpower150、ATTLAS和IMpower151。3期CheckMate 722试验招募了294名符合条件的患者,这些患者在接受第一代或第二代EGFR TKI治疗后出现疾病进展,且不存在EGFR T790M突变,或者在接受奥希替尼治疗时无论是否存在T790M突变均出现疾病进展。符合条件的患者以1:1的比例随机分配,分别接受纳武利尤单抗(每3周360毫克)联合铂类双药化疗(每3周一次)或仅接受铂类双药化疗(每3周一次),共四个周期。在中位随访38.1个月后,与单纯化疗相比,纳武利尤单抗联合化疗的PFS没有显著改善(中位PFS:5.6个月 vs. 5.4个月;HR:0.75 [95%CI:0.56-1.00];P = 0.0528)。在3期KEYNOTE-789研究中,招募了489名IV期非鳞状NSCLC患者,这些患者具有常见的EGFR突变且在EGFR-TKI治疗后出现疾病进展,并以1:1的比例随机分配,分别接受35个周期的帕博利珠单抗(200毫克)或安慰剂(每3周一次),联合四个周期的培美曲塞和卡铂或顺铂(每3周一次),随后进行培美曲塞维持治疗。主要终点是符合条件患者的PFS和OS率。从统计学角度来看,与化疗组相比,帕博利珠单抗联合化疗组中EGFR突变、TKI耐药的转移性非鳞状NSCLC患者的PFS和OS率没有显著提高。在亚组分析中,帕博利珠单抗联合化疗组在24个月时的OS为37.7%,而化疗组的OS为26.0%。这可能意味着通过仔细选择符合条件的EGFR突变的、PD-L1 TPS≥1%的NSCLC患者,可以获得潜在的治疗益处。在亚洲的3期ORIENT-31试验中,招募了476名符合条件的患者,并以1:1:1的方式随机分配(158名患者进入信迪利单抗联合IBI305(贝伐珠单抗生物类似药)联合化疗组,158名患者进入信迪利单抗联合化疗组,160名患者进入单纯化疗组)。治疗组是接受信迪利单抗联合IBI305联合化疗(培美曲塞和顺铂)的患者。与单纯化疗相比,信迪利单抗联合IBI305联合化疗显示出显著的PFS获益(中位PFS:7.2个月 [95% CI:6.6-9.3];HR:0.51 [0.39-0.67];双侧P < 0.0001)。信迪利单抗联合IBI305联合化疗组未观察到OS获益。在一项荟萃分析的森林图中,分析得出的PFS风险比,包括来自KEYNOTE-789 [HR:0.80(0.65-0.97)]、ORIENT-31 [HR:0.72(0.55-0.94)] 和ATTLAS [HR:0.62(0.45-0.86)] 试验的结果,都支持免疫治疗联合化疗的治疗方案。然而,OS的风险比并未表明免疫治疗联合化疗具有显著优势。
未来展望
在亚洲人群中,EGFR突变NSCLC患者几乎占所有肺癌患者的一半。初始治疗方案的选择可能取决于治疗前的NGS结果、初始肿瘤负荷,以及可能存在的共突变对预后的影响。在TRACER X研究中,Abbosh等人利用ctDNA对197名早期肺癌患者在手术后进行了为期5年的随访。在这些患者中,70名患者里有59名(84%)在术后(复发前或复发后)检测到了ctDNA,这表明液体活检监测可能是检测癌症复发的有效工具。在韩国肺癌联盟(KLCC-12-02)的一项研究中,Lee等人对81名接受EGFR TKIs治疗的NSCLC患者的血浆EGFR突变进行了纵向监测。在49名患者中,有14名(28.6%)患者通过早期检测到作为继发突变的T790M,观察到了新出现的耐药情况。在一项研究中,招募了50名晚期NSCLC患者,并从他们的痰液、血浆、尿液和肿瘤组织中收集了cfDNA。使用相同的NGS平台对液体活检中的体细胞基因组变异进行记录和检测。血浆cfDNA的总体一致性率为86%,痰液cfDNA为74%,尿液cfDNA为70%。这一结果意味着痰液有可能作为追踪和监测肿瘤复发的替代样本。ESMO临床实践指南针对致癌基因驱动NSCLC指出,应获取足够的组织用于标准的组织学诊断和分子检测。分子检测应包括EGFR突变、ALK易位、ROS1易位、RET易位、BRAF V600突变、NTRK易位、HER2突变、EGFR ex20ins突变以及MET 14号外显子跳跃突变(图1)。在晚期转移性EGFR突变NSCLC患者的治疗方案选择中,应考虑和预估几个方面的因素,包括肿瘤负荷、共突变的影响、对先前治疗产生的获得性耐药,以及疾病进展时的后续治疗策略。ASCO在2024年2月也发布了其动态指南,作为具有驱动基因变异的IV期NSCLC治疗的参考,尽管美国NCCN在2024年10月更新了其指南,并纳入了美国FDA新批准的治疗方案。对于TKI治疗后耐药情况的处理,目前正在开展多项第四代EGFR TKI的临床试验(表2)。
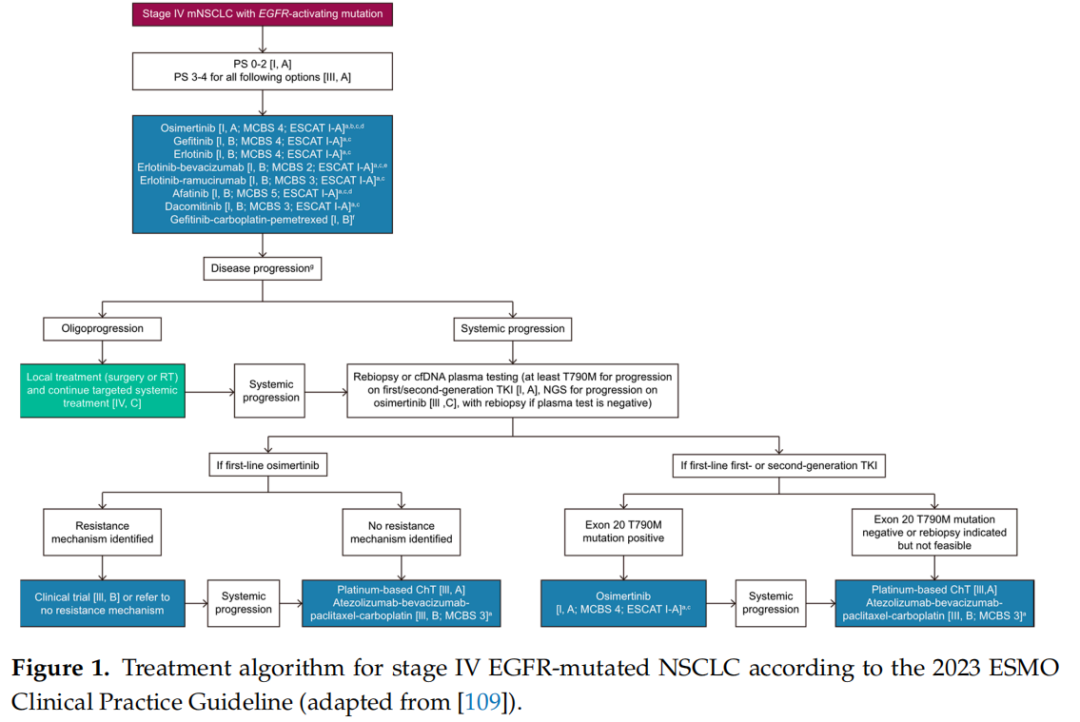
图1
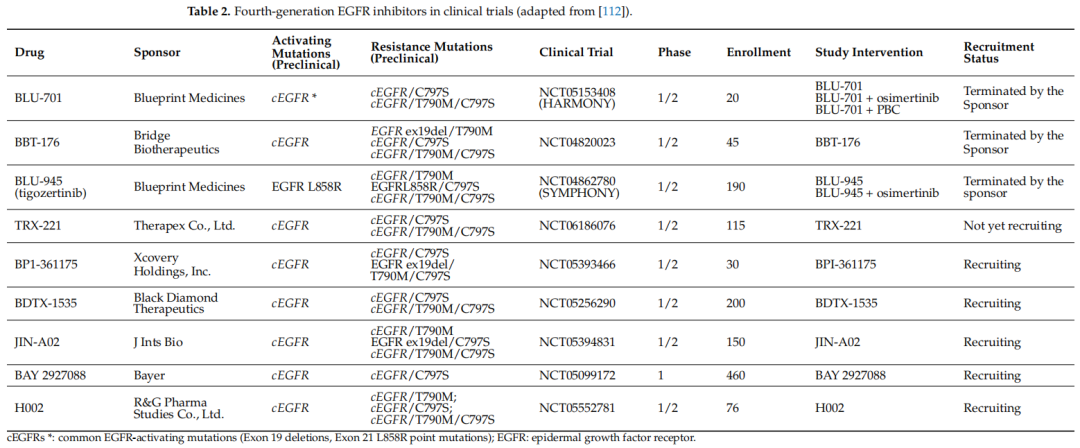
表2
在这些试验中,最有前景的第四代TKI药物是BLU945。BLU945是一种强效、可逆且对野生型EGFR具有选择性的抑制剂,可抑制EGFR+/T790M和EGFR+/T790M/C797S耐药突变体,在小鼠模型中显示出了有前景的结果。在对奥希替尼耐药的小鼠异种移植模型中,BLU945显示出显著的肿瘤生长抑制作用。在SYMPHONY试验中,BLU-945也使患者的肿瘤体积缩小。为了确定抗体-药物偶联物(ADC)的有效性,目前正在进行多项针对EGFR突变NSCLC患者在疾病进展后的2期和3期试验。2019年,Scharpen-seel等人分析了148份NSCLC组织样本,在82.7%的原发性NSCLC肿瘤中观察到了HER3强阳性染色。靶向HER3的抗体-药物偶联物德帕瑞妥单抗(patritumab deruxtecan,HER3-DXd)是一种正在研究的ADC,由一种完全人源的抗HER3免疫球蛋白G1单克隆抗体(patritumab)组成。HER3-DXd通过一种基于四肽的、肿瘤选择性的、稳定且可裂解的连接子与拓扑异构酶I抑制剂有效载荷共价连接。在2期HERTHENA-Lung01试验中,HER3-DXd显示出了疗效证据,可产生持久的缓解。评估HER3-DXd用于接受EGFR TKI和基于顺铂的化疗后疾病进展的EGFR突变NSCLC患者的3期HERTHENA-Lung02试验正在进行中。2024年9月,3期HERTHENA-Lung02试验显示,与基于铂类的化疗相比,PFS有统计学意义的改善,尽管在本次分析时对OS的评估还为时尚早。除了几例间质性肺疾病(ILD)事件的报告外,HER3-DXd组未报告新的安全性信号。在3期TROPION-Lung01研究中,与多西他赛相比,德曲妥珠单抗(Dato-DXd)显著改善了PFS;但在这项研究中未观察到OS获益。
综上所述,对于晚期EGFR突变NSCLC患者,在开始EGFR-TKI或联合治疗时,治疗前的NGS检测以及评估初始肿瘤负荷和内在共突变是合理的选择。在开始EGFR TKI治疗后,定期监测疾病变化可能有助于早期发现疾病进展。如果无法成功进行再次活检,血清甚至痰液的NGS检测可能是有前景的替代方法。针对疾病进展后的治疗方式的研究正在进行中,再次活检的NGS研究可以为临床医生制定个性化和精准化的患者治疗方案提供新的路线图。局部区域治疗方式可用于追求更长的OS。新一代TKI和ADC的试验正在进行中(表3),可能会为EGFR突变NSCLC患者在疾病进展后的治疗开辟新的前景。
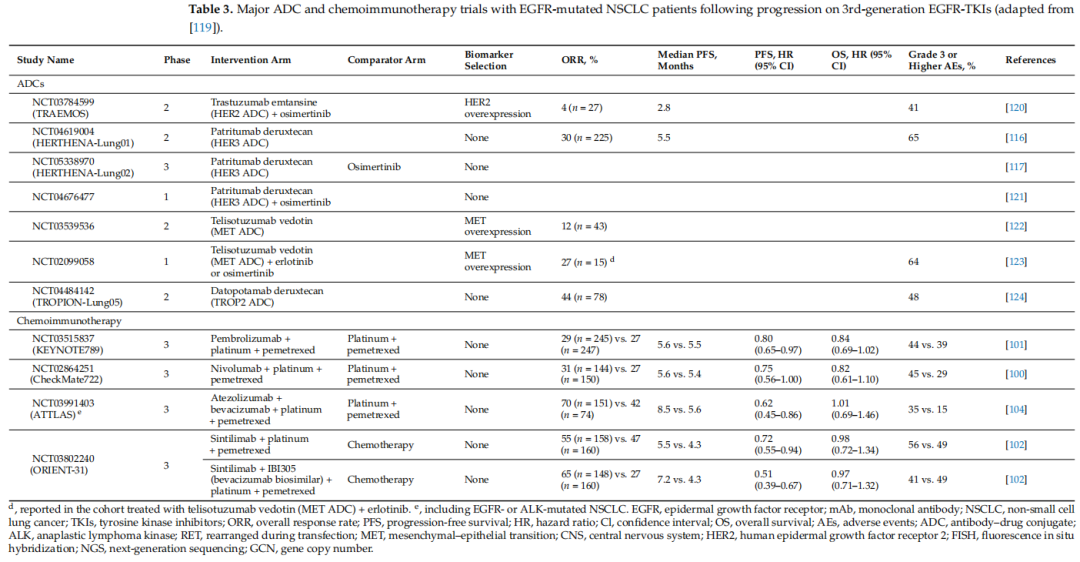
表3
参考文献:
Lee, C.-Y.; Lee, S.-W.; Hsu, Y.-C. Drug Resistance in Late-Stage Epidermal Growth Factor Receptor (EGFR)-Mutant Non-Small Cell Lung Cancer Patients After First-Line Treatment with Tyrosine Kinase Inhibitors. Int. J. Mol. Sci. 2025, 26, 2042. https://doi.org/10.3390/ijms26052042


本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言













#NSCLC# #酪氨酸激酶抑制剂#
6