上交大王寅/川大古君团队《Biomaterials》:过硫化物释放型多肽药物缀合物组装体为治疗心肌缺血再灌注损伤带来新希望
2025-03-22 BioMed科技 BioMed科技 发表于陕西省
该研究报道超氧化物阴离子响应的 S/A-P 可同时递送 H₂S 供体和 ATRA 治疗 MIRI,能降低 ROS 水平,改善心脏功能,揭示其多重机制,为治疗提供新思路。
心肌缺血再灌注损伤(MIRI)因其高死亡率和不良预后严重威胁人类健康。损伤过程中涉及ROS过度产生、过度炎症反应和心肌细胞凋亡等问题。相互纠缠的复杂病理机制和疗效欠佳的治疗药物已经成为阻碍MIRI临床治疗的两大困难,亟需更安全高效的解决方案。而目前研究表明,抑制再灌注开始时的ROS爆发可能是MIRI治疗的关键。
最近,上海交通大学王寅课题组联合四川大学古君课题组在《Biomaterials》发表最新研究成果,报道了一种超氧化物阴离子响应的共组装肽材料(S/A-P),能够在心肌损伤部位同时递送H2S供体和全反式视黄酸(ATRA),破解目前MIRI治疗困境 (图1)。
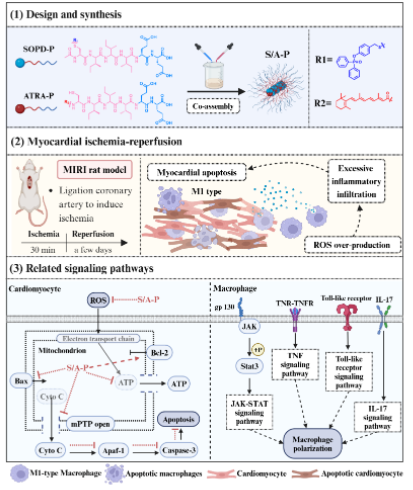
图1. S/A-P的设计制备与治疗应用示意图
1.“双管齐下”的协同疗法
传统药物往往“单打独斗”,而S/A-P通过巧妙设计实现双重作用:
·超氧阴离子响应释放硫化氢:在MIRI早期,自由基超氧阴离子(O₂⁻)会激活S/A-P,释放H₂S,直接清除ROS并修复线粒体功能。
·协同抵抗心肌缺血再灌注损伤:ATRA和H2S协同降低氧化应激,抑制炎症反应、调节巨噬细胞从促炎的M1型向抗炎M2型转化,打破“炎症-氧化应激”恶性循环。
实验显示,S/A-P在细胞模型中使ROS水平降低70%以上,并将心肌细胞凋亡率控制在10%以下,效果远超单一药物。
2.动物实验效果良好
在大鼠MIRI模型中,注射S/A-P后:
·心脏功能显著恢复:射血分数(EF)提升近50%,超声心动图提示已接近正常水平。
·梗死面积缩小:心肌瘢痕减少60%,左心室壁厚度明显改善。
·安全性高:主要器官无损伤,血液指标正常。
3.机制揭秘
通过RNA测序和分子实验,团队进一步揭示S/A-P的多重机制:
·抑制线粒体凋亡通路:恢复线粒体稳态,减少细胞色素C泄漏,下调促凋亡蛋白Bax,上调抗凋亡蛋白Bcl-2,抑制caspase凋亡级联反应。
·调控炎症信号:抑制TNF、IL-17等促炎相关信号通路,激活JAK-STAT抗炎通路,调节巨噬细胞极化。
·促进血管新生:H₂S驱动内皮细胞迁移和新生血管网络形成,加速损伤修复。
4.未来展望
这项研究不仅为MIRI提供了全新治疗策略,其“环境响应+协同递送”的设计思路还可拓展至其他心血管疾病甚至癌症治疗。
参考文献:
Yanwen Zhang#, Yuxuan Ge #, Shiqi Wu, Yiyang Shao, Yujia Lu, Xueshan Zhao, Jun Gu, Yin Wang, Superoxide anion-responsive persulfide and all-trans retinoic acid co-donating peptide assemblies attenuate myocardial ischemia-reperfusion injury, Biomaterials, 2025, DOI: 10.1016/j.biomaterials.2025.123276
原文链接:
https://www.sciencedirect.com/science/article/pii/S0142961225001954

本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言










#全反式视黄酸# #心肌缺血再灌注损伤#
5