FDA照顾或成鸡肋,DS-8201获批HR阳性HER2 低或HER2超低表达乳腺癌,挤压TROP2 ADC生存空间
2025-02-02 Antibody Research Antibody Research 发表于陕西省
Enhertu 获批用于特定乳腺癌治疗,其在试验中疗效突出。相比之下,TROP2 ADC 在乳腺癌治疗中地位尴尬,HER3 - DXD 也在该领域有一定进展与竞争。
2025年1月27日,阿斯利康和第一三共宣布Enhertu(DS-8201,Trastuzumab deruxtecan)已在美国获得批准,用于治疗经美国食品药品监督管理局 (FDA) 批准的检测确定的不可切除或转移性激素受体 (HR) 阳性、HER2 低(IHC 1+ 或 IHC 2+/ISH-)或 HER2 超低(膜染色为 IHC 0)乳腺癌的成年患者,且在转移性环境中接受一种或多种内分泌疗法后病情出现进展。

该项批准是在获得优先审查和突破性疗法认定后由FDA授予的,其基于 DESTINY-Breast06 第三阶段试验的结果,该结果在第 2024 年美国临床肿瘤学会 (ASCO) 会议上公布并发表在《新英格兰医学杂志》上。

在该试验中,Enhertu显示出与化疗相比,疾病进展或死亡风险降低了 36%(风险比 [HR] 0.64;95% 置信区间 [CI]:0.54-0.76;p<0.0001),在未接受化疗的HER2低或HER2超低转移性乳腺癌患者的整体试验人群中。Enhertu 随机患者的中位无进展生存期 (PFS) 为13.2个月,而化疗患者为8.1 个月。整体试验人群中, Enhertu确认的客观缓解率 (ORR) 为62.6%,而化疗为34.4%。
在对HER2超低表达患者的探索性分析中,发现HER2低表达患者与HER2超低表达患者的结果是一致的。
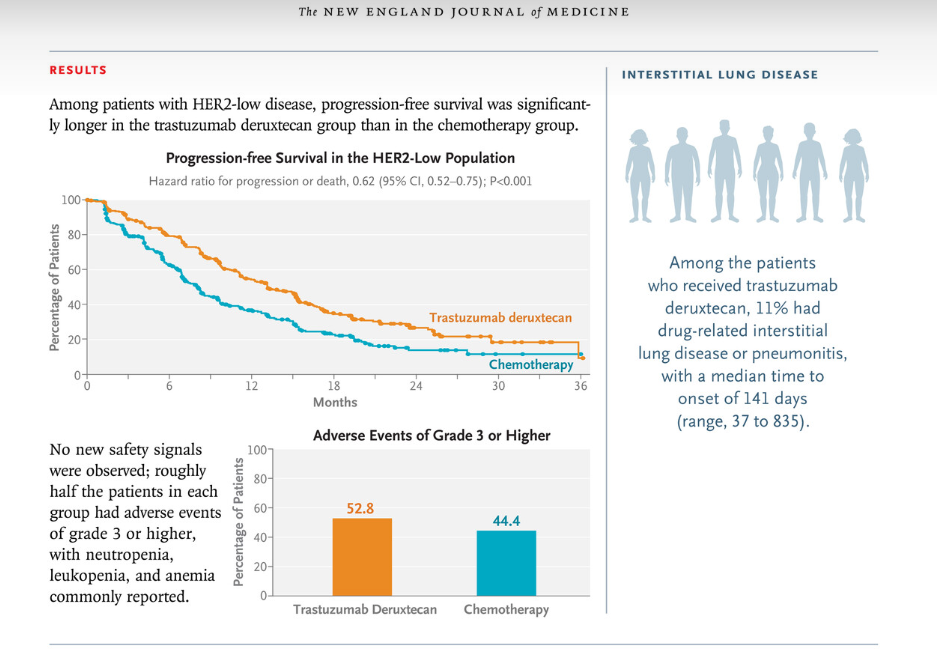
试验中的HER2状态由中央实验室确认,并在初次转移诊断时或之后获得的肿瘤样本上进行。大约85-90%的HR阳性、HER2阴性转移性乳腺癌患者被确定具有可操作的HER2表达水平。此外,在对肿瘤样本进行中央分析后,近三分之二以前在当地实验室评估为 IHC 0 的患者被归类为 HER2 低或 HER2 超低。
Enhertu在 DESTINY-Breast06 中的安全性与Enhertu 在乳腺癌中开展的先前临床试验一致,未发现新的安全问题。
HER2作为一种酪氨酸激酶受体生长促进蛋白,在多种类型的肿瘤(包括乳腺癌)表面表达。HER2 表达水平高(IHC 3+ 或 2+/ISH+)的患者被归类为 HER2 阳性,约占所有乳腺癌的 15-20%。从历史上看,未被归类为 HER2 阳性的肿瘤被归类为 HER2 阴性。
HR阳性、HER2 阴性是最常见的乳腺癌亚型,约占所有乳腺癌的 70%。内分泌疗法在HR阳性转移性乳腺癌的早期治疗中被广泛连续使用。然而,在初始治疗后,内分泌疗法的进一步疗效往往有限。目前内分泌疗法后的标准治疗是化疗,但其反应率和疗效较差。根据阿斯利康的总结来看,HER2-null仅占5-20%,而HER2表达量也在0-20000拷贝表达,还有潜在的拓展潜力,可能后续会进一步针对无表达要求患者入组进行临床研究。另外我们可以学习到的是,拷贝数在2万到10万之间,也有很大的成药潜力,而现有的不少靶点,大都在这个范围之内,除了不可避免的适应症本身可能存在的限制,这类靶点仍有大量可以挖掘的潜力。
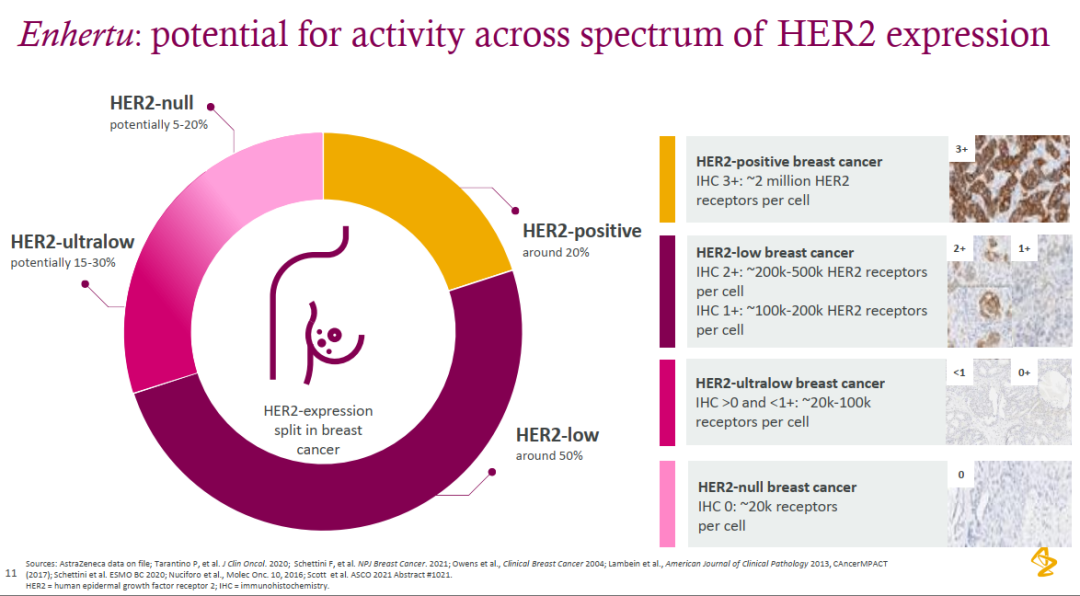
这无疑进一步挤压了TROP2 ADC在乳腺癌的生存空间,目前Trodelvy和TROP2-DXD的治疗线数还更为靠后,也就是说未来可能在用完DS-8201之后,才可能用TROP2 ADC。而众所周知的是,在经历相同机制payload治疗后,患者对该类ADC效果会大大减弱。
同时,HER3-DXD在三阴性乳腺癌上也展现了初步初步积极数据,2024欧洲肿瘤内科学会(ESMO)年会,公布ICARUS-BREAST01(NCT04965766)Ⅱ期研究数据,该研究旨在评估HER3-DXd在经CDK4/6抑制剂和一线化疗后进展的HR+/HER2- ABC患者中的活性、安全性和响应/耐药生物标志物。截至2024年4月16日,共入组99例患者,其中19例仍在接受治疗。中位年龄为57.0岁(IQR;48.0-66.0),既往CDK4/6抑制剂的中位治疗持续时间为13.7个月(IQR;6.5-19.7)。在15.3个月的中位随访时间(95%CI;13.0-17.2)时,cORR为53.5%(95%CI;43.2-63.6),CBR(clinical benefit rate)为63.6% (95%CI;53.4-73.1);中位PFS为9.4个月(95%CI;8.1-13.4);中位DOR为8.7个月(95%CI;8.1-12.5)。不良事件(AEs;任何级别/≥3级)在98.0%/55.6%的患者中发生。AEs导致20.2%/12.1%的患者剂量减少/停药。最常见的与治疗相关的AEs为恶心(75%;G3 5%)、腹泻(53%;G3 1%),6例患者出现间质性肺病(5例G1,1例G2)。关于HER3表达和肿瘤及血液样本的转化分析数据将在会议中报告。

众所周知,HER3是一个表达并不高的靶点,整体表达可能就在HER2超低表达或者HER2-null水平,目前来看,ADC选择靶点最重要的一个因素就是治疗窗口,这个窗口,有两部分驱动,一个是安全性,一个是靶点表达。安全性不足,on target毒性过高,即便表达优异,这样也会导致治疗窗口很窄,最后药效也并不理想,例如TROP2 ADC,再者ADC终归还是靶向化疗,靶点表达丰度,也起着关键作用,目前对于成药的靶点表达阈值,可能还有一定的模糊,但越来越多的数据证明,或许拷贝数即便在几万的水平,安全窗口足够可能也可以成药。而这样的表达水平,在早期体外assay中是很难有良好药效的体现的,需要多尝试体内动物药效模型。
在HER2,HER3等靶点的挤压下,TROP2 ADC在乳腺癌中的地位愈加尴尬。回顾以往的获批的TROP2 ADC一个是药效惊艳度不够,另一个治疗线数靠后,都可能造成其后续市场困境。
2023年2月3日,美国食品药品管理局(FDA)批准sacituzumab govitecan-hziy(Trodelvy)用于治疗无法切除的局部晚期或转移性激素受体 (HR) 阳性、人类表皮生长因子受体 2 (HER2) 阴性 (IHC 0、IHC 1+ 或 IHC 2+/ISH-) 乳腺癌患者,这些患者已接受过内分泌治疗和转移性环境中至少两种额外的全身治疗。主要疗效结果指标是无进展生存期 (PFS),由独立盲法中心审查根据 RECIST v1.1 确定。关键的次要疗效结果指标是总生存期 (OS)。Sacituzumab govitecan-hziy 组的中位 PFS 为 5.5 个月 (95% CI: 4.2, 7.0),单药化疗组的中位 PFS 为 4 个月 (95% CI: 3.1, 4.4)(风险比 [HR] 为 0.661 [95% CI: 0.529, 0.826];p 值 = 0.0003)。接受 sacituzumab govitecan-hziy 治疗的患者中位 OS 为 14.4 个月(95% CI:13.0, 15.7),接受单药化疗的患者中位 OS 为 11.2 个月(95% CI:10.1, 12.7)(HR 为 0.789 [95% CI:0.646, 0.964];p 值=0.0200)。基于TROPiCS-02 (NCT03901339)临床研究。

2021年4月7日,美国食品药品管理局(FDA)批准sacituzumab govitecan (Trodelvy,Immunomedics Inc.) 用于治疗无法切除的局部晚期或转移性三阴性乳腺癌 (mTNBC) 患者,这些患者之前已接受过两次或两次以上的全身疗法,其中至少一次是针对转移性疾病的。2020年4月,Sacituzumab govitecan获得加速批准,用于治疗至少接受过两种转移性疾病治疗的 mTNBC 患者。
在所有随机患者(有或无脑转移)中,接受 sacituzumab govitecan 治疗的患者的中位 PFS 为 4.8 个月(95% CI:4.1, 5.8),而接受化疗的患者的中位 PFS 为 1.7 个月(95% CI:1.5, 2.5)(HR 0.43;95% CI:0.35, 0.54;p<0.0001)。中位 OS 分别为 11.8 个月(95% CI:10.5, 13.8)和 6.9 个月(95% CI:5.9, 7.6)(HR 0.51;95% CI:0.41, 0.62;p<0.0001)。(NCT02574455)

2025年1月17日,第一三共与阿斯利康宣布Trop2-DXD新药Datopotamab dextecan获得FDA批准上市,用于治疗不可切除或转移性激素受体 (HR) 阳性、HER2 阴性(IHC 0、IHC 1+ 或 IHC 2+/ISH-)乳腺癌成年患者,商品名为Datroway。

此次批准基于 3 期 TROPION-Breast01 试验 (NCT05104866) 的临床结果。Dato-DXd 组的中位无进展生存期 (PFS) 为 6.9 个月 (95% CI, 5.7-7.4),化疗组的中位无进展生存期 (PFS) 为 4.9 个月 (95% CI, 4.2-5.5)(HR, 0.63;95% CI, 0.52-0.76;双侧P值 <.0001)。
但OS并没有达到统计学意义。Dato-DXd 组的中位总生存期 (OS) 为 18.6 个月(95% CI,17.3-20.1),化疗组的中位总生存期 (OS) 为 18.3 个月(95% CI,17.3-20.5)(HR,1.01;95% CI,0.83-1.22;双侧P值无统计学意义)。Dato-DXd 组和化疗组的确认总缓解率 (ORR) 分别为 36%(95% CI,31-42)和 23%(95% CI,19-28),中位缓解持续时间 (DOR) 分别为 6.7 个月(95% CI,5.6-9.8)和 5.7 个月(95% CI,4.9-6.8)。
Datroway的安全性与该药物的已知安全性一致,未发现新的安全隐患。在Datroway组中,间质性肺病 (ILD) 发生率为 4.2%,大多数事件为低级别。
无论是否FDA存在照顾Datroway,但不可避免的是,在DS-8201的竞争下,其未来市场空间愈加狭小。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言

















#乳腺癌# #Enhertu#
15
乳腺癌激素受体阳性治疗
9