武汉大学张先正团队Small:工程益生菌纳米系统通过调控胰腺肿瘤细胞外基质和瘤内定植细菌来增强化学免疫治疗疗效
2024-11-30 BioMed科技 BioMed科技 发表于陕西省
胰腺癌致死率高,现有治疗存在问题,武大团队设计益生菌纳米系统调控肿瘤基质、抑制瘤内 γ - 变形菌,为胰腺癌化学免疫治疗提供新策略。
胰腺肿瘤基质的调控
胰腺癌是致死率最高的癌症,患者的五年生存率低于5%。肿瘤周围致密的细胞外基质严重阻碍了化疗药物和免疫细胞的浸润,从而导致胰腺癌的化疗效果不佳。尽管,现有的研究利用小分子药物或者蛋白酶来消除肿瘤的细胞外基质,但是小分子药物/抑制剂往往会诱发肿瘤脱靶效应和全身性的毒副作用。更糟糕的是,蛋白酶介导的细胞外基质清除可能会破坏肿瘤细胞的粘附性,从而导致肿瘤的转移。因此,设计一种有效的策略来调控肿瘤细胞外基质,增强抗肿瘤药物对胰腺肿瘤的靶向和穿透效果,对于胰腺癌患者的治疗改善具有重要意义。
肿瘤内γ-变形菌的调控
胰腺癌中存在的γ-变形菌能够将吉西他滨(胰腺癌临床治疗一线药物)代谢为非活性产物,从而极大程度地降低了胰腺癌的化疗疗效。虽然现有的研究能够利用抗生素清除肿瘤内的定植菌,从而达到抑制吉西他滨降解的目的。但是,非选择性的细菌清除,不可避免地会杀死具有抑癌功能的益生菌,从而导致胰腺肿瘤的加速生长,甚至诱发肿瘤转移。因此,开发一种能够精确抑制肿瘤内γ-变形菌生长的策略,对提高肿瘤部位吉西他滨的活性具有重要意义。
肿瘤基质的靶向调控和瘤内γ-变形菌的抑制
针对上述问题,武汉大学张先正教授、陈巍海教授等人设计了一种具有MMP-2酶响应功能和肿瘤靶向功能的益生菌纳米系统。首先,通过益生菌纳米系统递送vactosertib药物诱导胰腺星状细胞进入静息状态,从而抑制细胞外基质的产生,为化疗药物和免疫细胞的渗透提供了良好的微环境。紧接着,再利用益生菌纳米系统将吉西他滨靶向递送至胰腺肿瘤的深处,显著提高了肿瘤部位的药物浓度。与此同时,靶向到肿瘤部位的丁酸梭菌能有效抑制瘤内γ-变形菌的生长,从而显著降低吉西他滨在胰腺肿瘤中的降解。该策略为胰腺癌的化学免疫治疗提供了新的机遇。相关工作以“Harnessing the Engineered Probiotic-Nanosystem to Remodulate Tumor Extracellular Matrix and Regulate Tumor-Colonizing Bacteria for Improving Pancreatic Cancer Chemo-Immunotherapy”为题发表在《Small 》。

【文章要点】
在本研究中,研究人员精心设计了一种能够靶向肿瘤的益生菌纳米系统,用于调控肿瘤细胞外基质以及抑制肿瘤内γ-变形菌的生长,从而改善吉西他滨诱导的胰腺癌化学免疫治疗。通过MMP-2酶响应多肽将载药脂质体与丁酸梭菌偶联,构建益生菌纳米体系。首先,益生菌纳米系统通过递送TGF-β1受体抑制剂vactosertib来沉默活性的胰腺星状细胞,从而抑制细胞外基质组分的产生,使其变得疏松,为化疗药物和免疫细胞的浸润提供了良好的环境 (图1)。
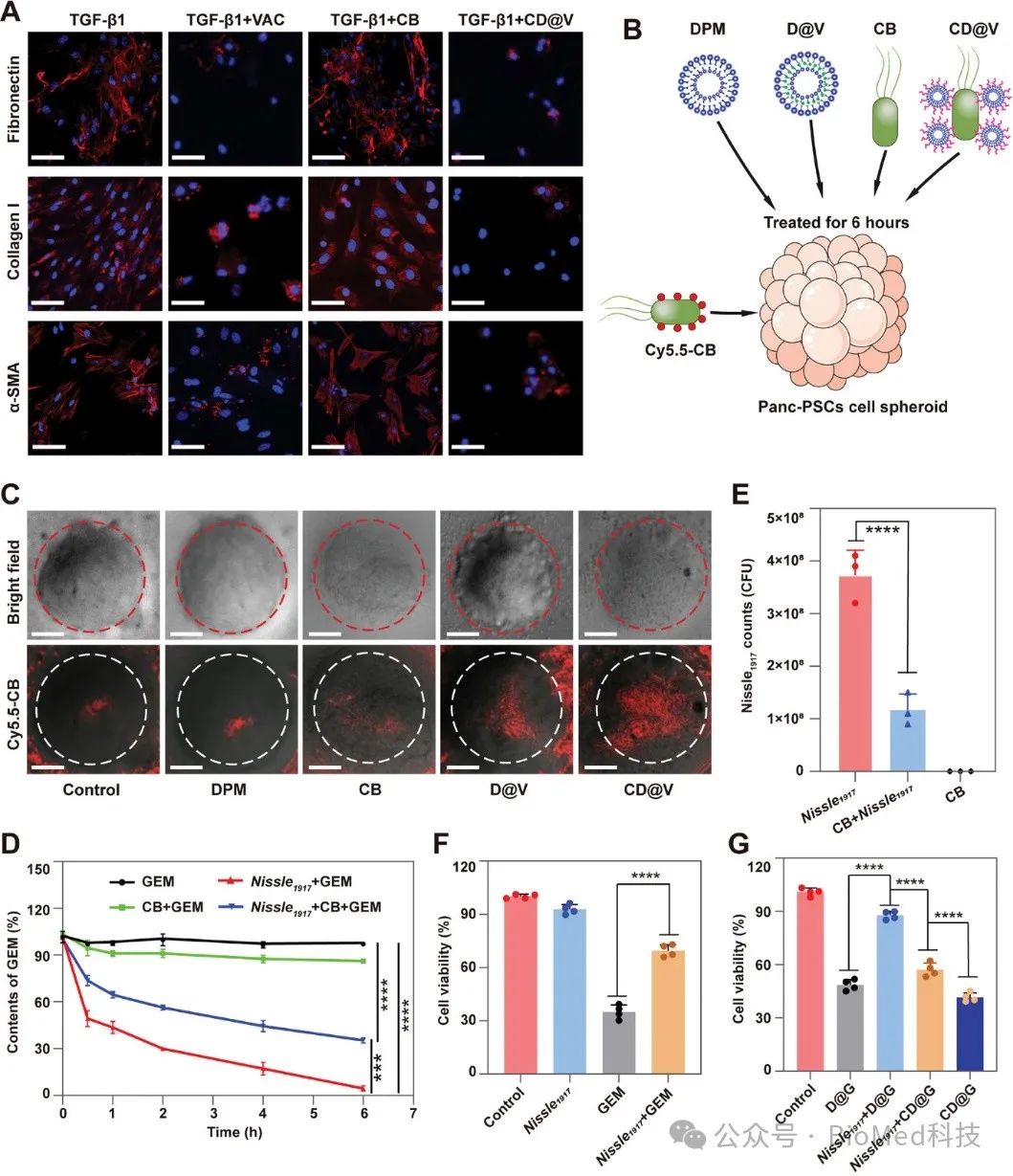
图1. 益生菌纳米系统对胰腺癌细胞外基质调控能力的体外表征
随后,再次通过益生菌纳米系统将吉西他滨靶向递送到肿瘤的核心部位,实现了化疗药物在肿瘤部位的深入渗透(图2)。
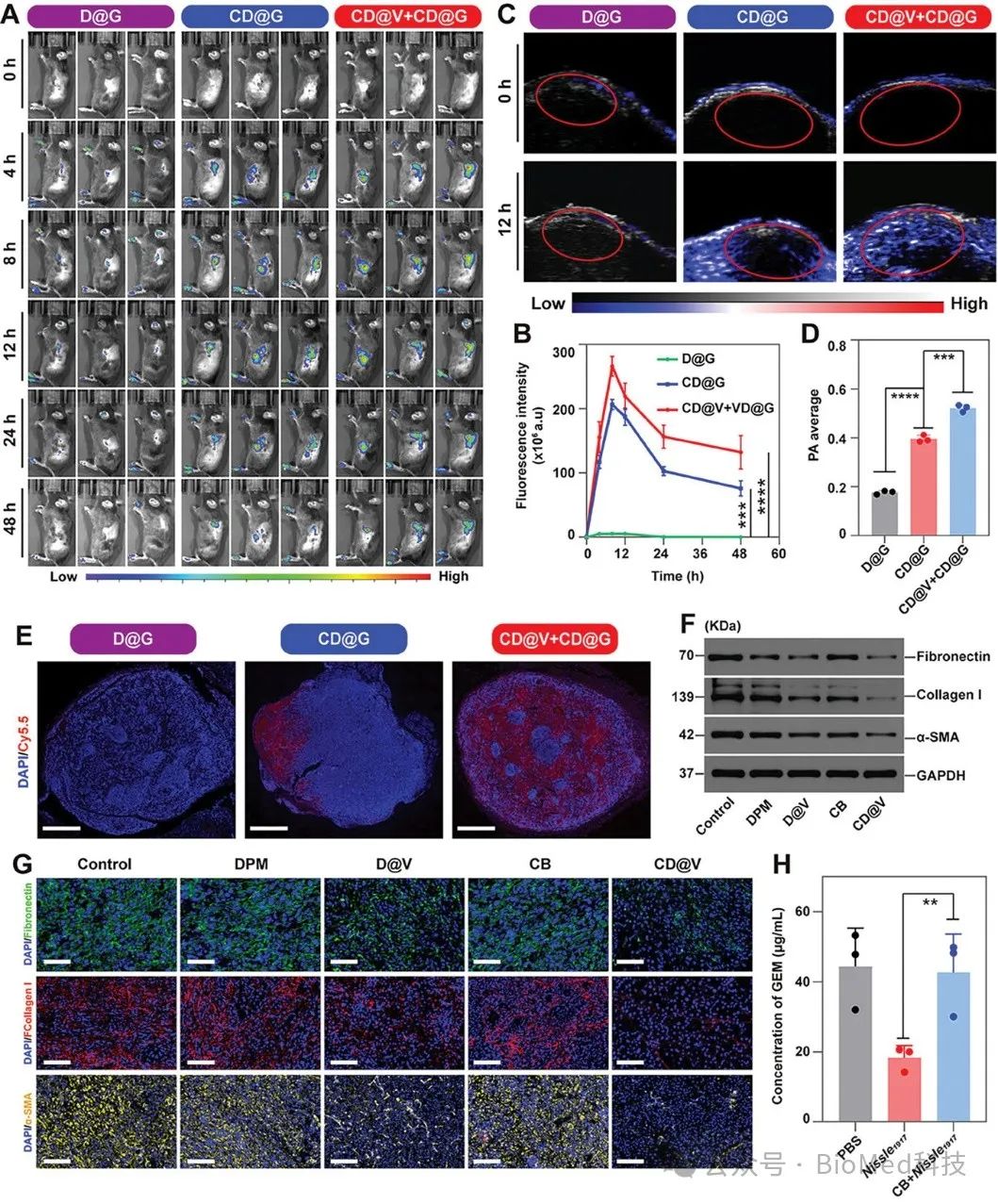
图2. 益生菌纳米系统在胰腺肿瘤部位的靶向能力和细胞外基质调控能力评估
值得注意的是,靶向到肿瘤部位的丁酸梭菌可以通过营养竞争的方式降低瘤内γ-变形菌的含量,从而抑制γ-变形菌介导的吉西他滨降解(图3)。
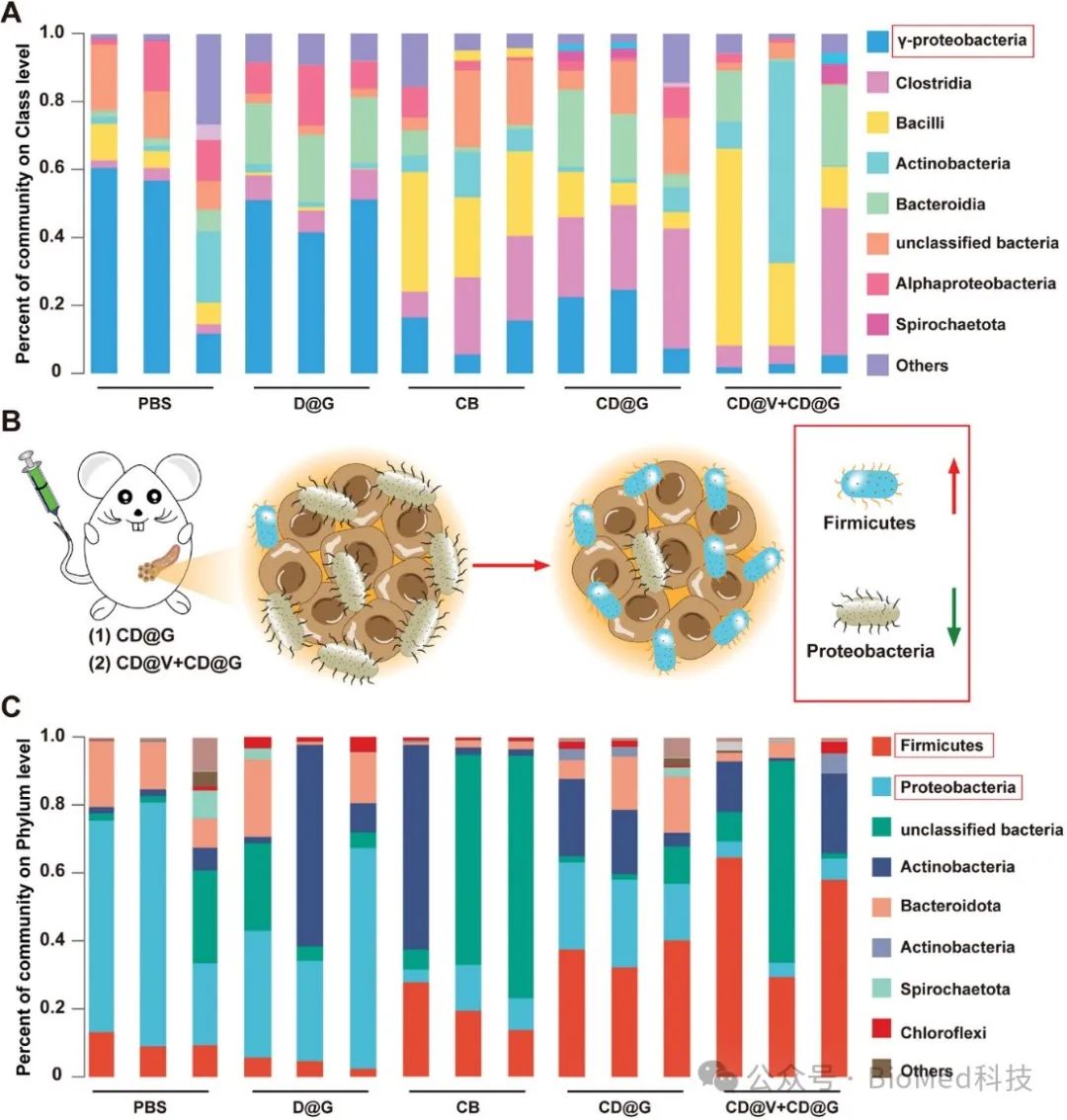
图3. 益生菌纳米系统对胰腺肿瘤中细菌丰度的影响
这一治疗策略极大的提高了肿瘤部位吉西他滨的活性,进而增强了肿瘤部位吉西他滨诱导的免疫原性细胞死亡,并激活了强大的抗肿瘤免疫反应。与此同时,疏松的细胞外基质环境会极大程度地增加抗肿瘤免疫细胞在肿瘤部位的浸润效果(图4),从而将胰腺癌部位免疫抑制的微环境调控为免疫激活状态,为胰腺癌的化学免疫疗法提供了新思路。
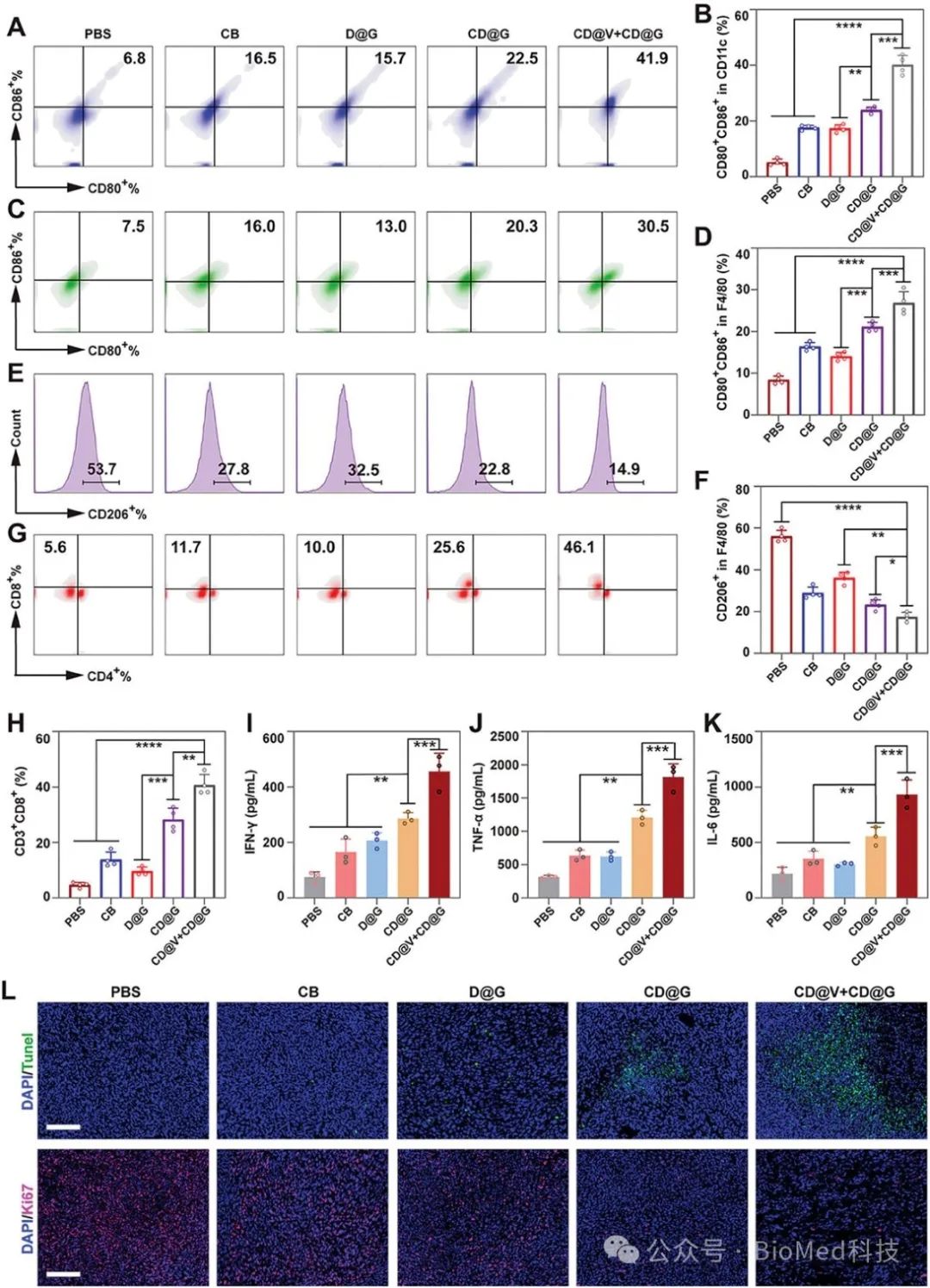
图4. 益生菌纳米系统瘤内诱发抗肿瘤免疫的评估
【结论与展望】
综上所述,研究人员开发了一种具有MMP-2酶响应功能和肿瘤靶向功能的益生菌纳米系统,通过“层层递进”的策略增强吉西他滨诱导的胰腺癌化学免疫治疗疗效。在第一步中,通过益生菌纳米系统将vactosertib药物递送到胰腺肿瘤部位并诱导活化的胰腺星状细胞进入静息状态,从而显著抑制细胞外基质的产生,为化疗药物和免疫细胞的深入渗透提供了良好的基础。在细胞外基质调控的基础上,再次通过益生菌纳米系统将吉西他滨靶向递送至胰腺肿瘤深处。与此同时,靶向到肿瘤部位的益生菌能有效抑制瘤内γ-变形菌的生长,从而显著降低吉西他滨在胰腺肿瘤中的降解。工程益生菌纳米系统能够增强吉西他滨诱导的肿瘤细胞免疫原性死亡,并促进抑癌免疫细胞在肿瘤组织中的渗透,在肿瘤部位激活强大的免疫反应。该策略为胰腺癌的化学免疫治疗提供了新的机遇。
武汉大学化学与分子科学院的张先正教授和陈巍海教授为该论文的共同通讯作者,博士研究生姚炜钦和宋雯芳为本论文的共同第一作者。本研究受到国家重点研发计划、国家自然科学基金、中央高校基本科研业务费专项基金的资助。
原文链接:
https://onlinelibrary.wiley.com/doi/abs/10.1002/smll.202406837
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言
















#胰腺癌# #化学免疫治疗#
32