肠道炎症的发病过程是一个复杂且多因素相互交织的体系,涉及适应性免疫系统平衡的打破、肠道屏障功能受损以及肠道微生物群落结构的紊乱。最新研究表明,肠道微生物在调控与结直肠癌(CRC)和炎症性肠病(IBD)病程发展相关的免疫反应中占据核心地位。牙龈卟啉单胞菌(Pg),作为一种口腔中的病原体,其在肠道炎症中的作用也逐渐受到关注,关于Pg是否通过干扰肠道微生物群落的平衡,进而触发免疫反应并加剧肠道炎症的具体机制,尚需深入的科学研究与探索。
据可靠报道,富含原花青素的咖啡酸(CA)与葡萄籽多酚(GSP)具备显著的免疫调节及抗氧化特性。同时,天然多糖类物质,包括淫羊藿多糖(EP)、海藻酸钠(SA)及β-D-葡聚糖,均显示出良好的抗炎及免疫调节活性。然而,这些化合物针对Pg的抗菌效果尚属未知领域,且它们对于缓解由Pg诱发的肠道炎症加剧现象的潜力,尚需进一步明确。
近日,一篇名为“Epimedium polysaccharides mitigates Porphyromonas gingivalis-exacerbated intestinal inflammation by suppressing the Th17 pathway and modulating the gut microbiota”的文章探讨了EP对Pg加重的肠道炎症的潜在缓解作用。

图1 论文首页
EP缓解了Pg引起的肠道炎症加剧
实验中给予小鼠口服400mg/kg EP持续一周,随后进行DSS处理并辅以Pg的灌胃操作(图2A)。通过对比分析,研究发现与仅接受PBS或DSS灌胃的小鼠相比,那些同时接受DSS与Pg处理的小鼠展现出了更为显著的肠道炎症表现,这一结论基于体重变化、脾脏重量、结肠长度缩短以及疾病活动指数(DAI)的显著变化得以验证(图2B-F)。结果显示EP干预对于由Pg所引发的肠道炎症加剧指标具有显著的缓解作用。此外,通过结肠组织的组织病理学染色分析,研究进一步确认了EP在治疗过程中有效减轻了由Pg所加剧的黏膜溃疡、隐窝结构破坏以及炎性细胞的显著浸润(图2F-G)。
由此可见,EP在改善肠道炎症方面具有实质性作用,揭示了其作为潜在治疗手段,在减轻由Pg所诱发的病理指标恶化方面的巨大潜力。
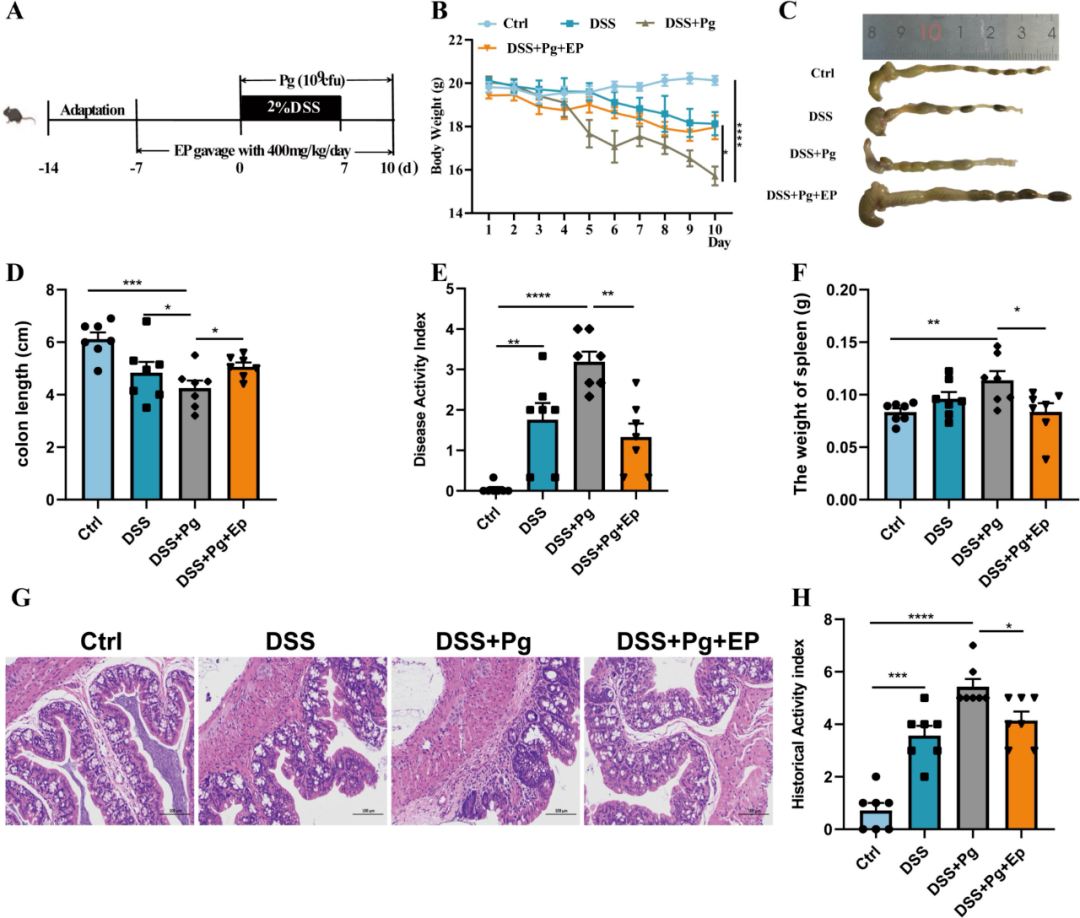
图2 (A)动物实验设计示意图(B)体重(C)结肠的代表性图像(D)结肠长度(E)DAI(F)脾脏重量(G)H&E染色结肠切片(H)结肠组织学评分
EP恢复了Pg损伤的肠道屏障
研究还采取了免疫荧光技术,对肠屏障功能中紧密连接蛋白的表达进行了深入探讨。结果显示,相较于对照组,DSS+Pg组小鼠体内Occludens-1(即ZO-1)的平均密度呈现出显著的下降态势(图3A-B)。但经过EP的干预处理,ZO-1蛋白水平的降低趋势得到了明显缓解。此外,RT-PCR技术也进一步确认了ZO-1蛋白表达的变化趋势(图3E)。在Occludin和MUC2的表达水平方面,DSS+Pg组也呈现出了显著的降低,与对照组形成了鲜明对比。然而,EP的介入有效地逆转了这一趋势,显著恢复了这两种蛋白质的表达水平(图3F-G)。
研究还对E-钙粘蛋白的水平进行了评估,该蛋白在维护肠道屏障完整性和上皮功能方面扮演着至关重要的角色。免疫荧光结果显示,在口服Pg后,E-钙粘蛋白的水平出现了显著的下降。然而,通过EP的干预,E-钙粘蛋白的水平得到了明显的上调(图3C-D),这表明EP在缓解由Pg所加剧的肠屏障损伤方面具有显著疗效。
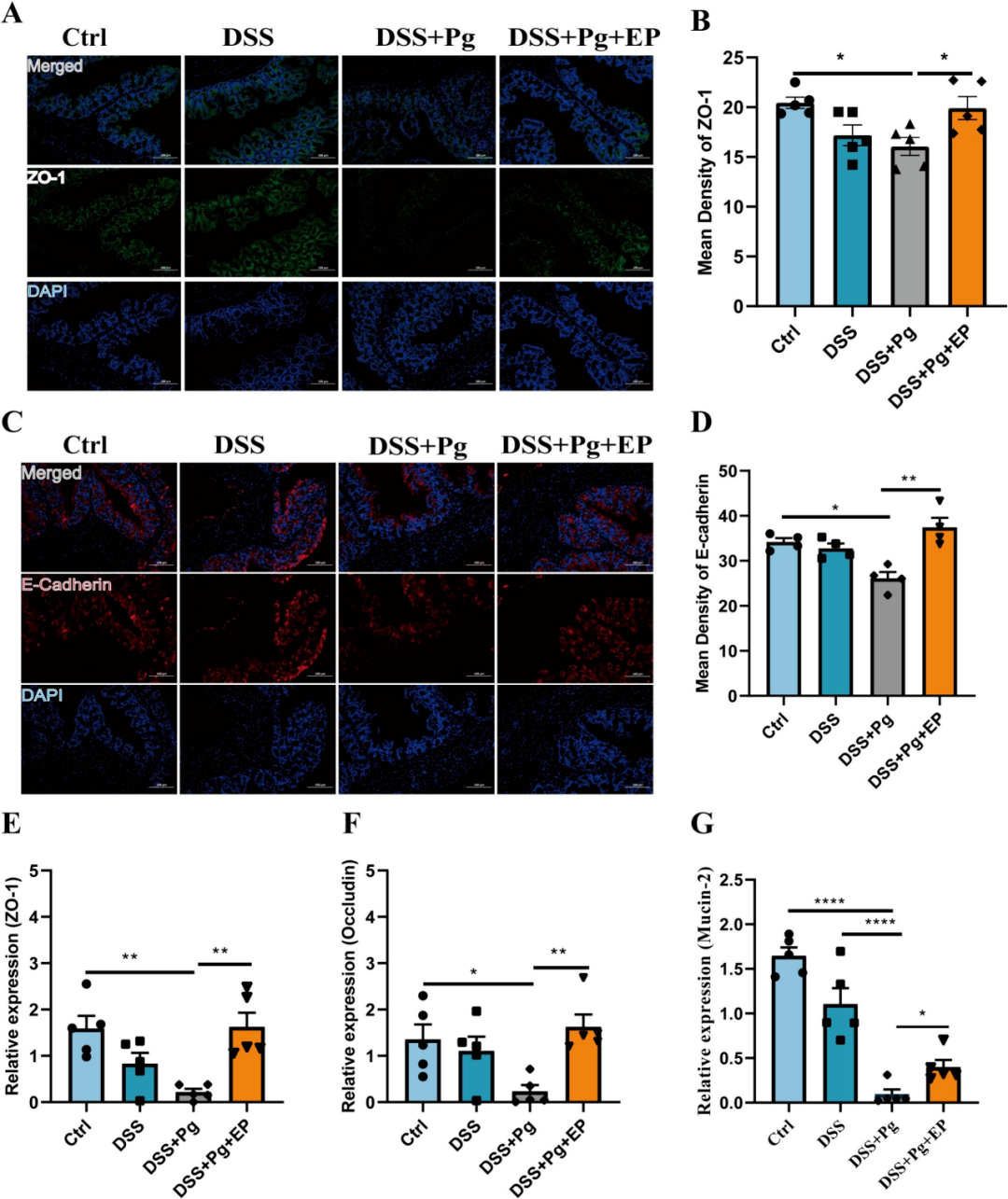
图3 (A-B)代表性免疫荧光染色图像和ZO-1的平均密度(C-D)代表性免疫荧光染色图像和E-钙粘蛋白的平均密度(E-G)结肠组织中ZO-1(E)Occludin(F)和MUC2(G)的基因表达
EP通过抑制Th17通路抑制促炎结肠微环境
为深入探讨四组小鼠间免疫失衡的机理,该研究系统性地评估了肠道微环境中的免疫状态变化。结果显示,与对照组相较,DSS+Pg组小鼠的CD4细胞比例呈现下降趋势,而Th17与Treg细胞比例则有所上升(图4B-F)。RT-PCR结果显示DSS+Pg组小鼠结肠组织中的RORγT(Th17细胞关键转录因子)表达水平显著上调,而EP干预措施则显著降低了RORγT的表达(图4G)。
此外,研究还观察到Pg的引入显著提升了结肠中IL-17水平,而EP干预则有效降低了IL-17的浓度(图4H)。鉴于IL-17在Th17通路中的核心作用,研究进一步检测了与该通路密切相关的细胞因子。结果显示,血清淀粉样蛋白A(SAA)与IL-6在联合作用下,能够剂量依赖性地促进Th17细胞的分化,并增强标志性细胞因子IL-17A的表达。
具体而言,DSS+Pg组小鼠的IL-6与SAA3水平均显著高于对照组,而SAA1与SAA2的水平则保持相对稳定。同时,EP干预对上述细胞因子的过表达现象产生了显著的抑制作用(图4I-L)。这一发现提示,EP可能通过阻断Th17通路的激活,从而缓解由Pg所诱发的结肠微环境促炎状态。
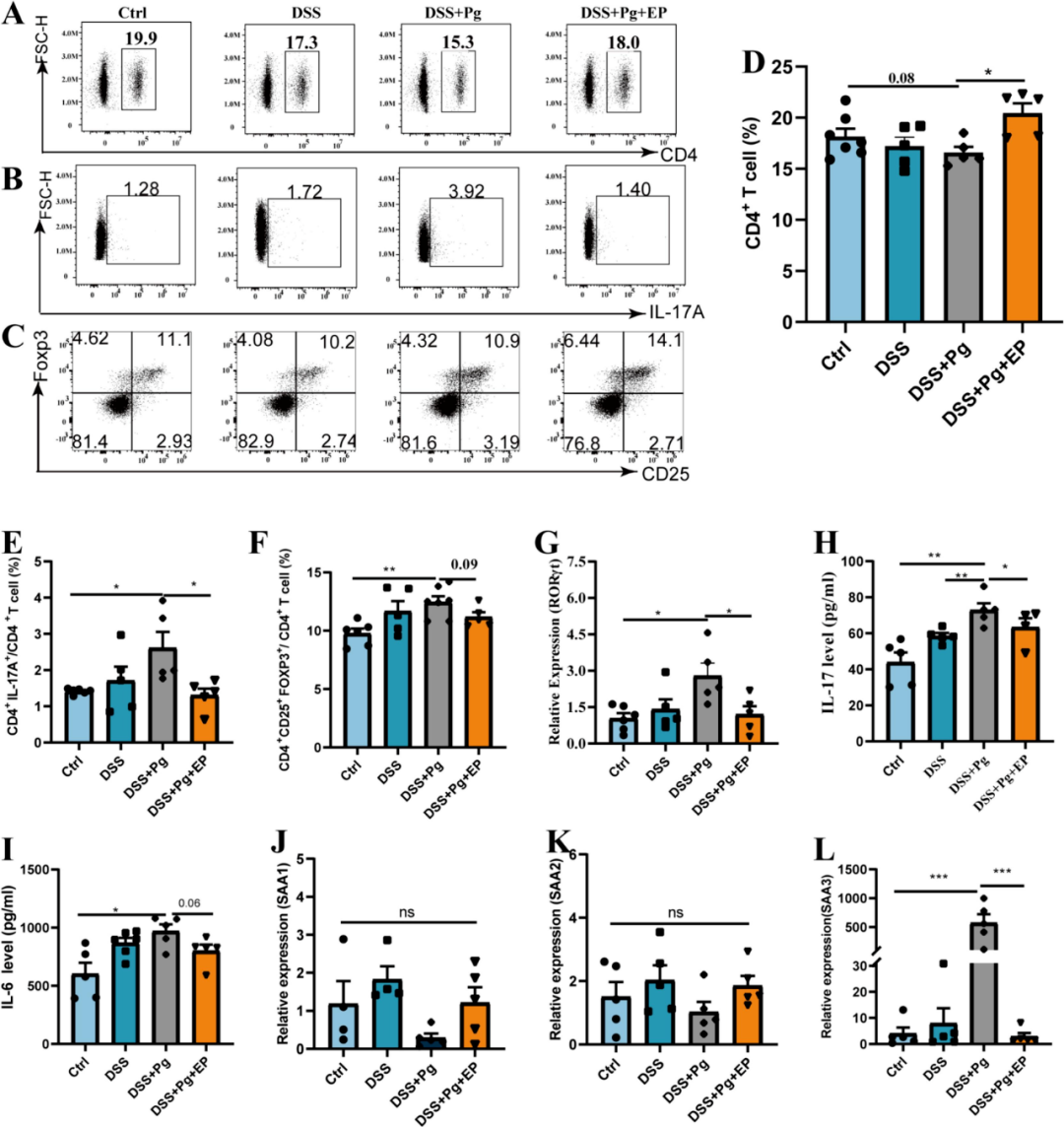
图4 EP通过抑制Th17通路抑制促炎结肠微环境
EP缓解Pg引起的肠道微生物群失调
为深入探讨EP对DSS+Pg处理小鼠肠道微生物群的具体影响,研究采用了16S rRNA扩增子测序技术进行深入分析。结果显示,与对照组相比,DSS组及DSS+Pg组的α多样性显著下降(图5A-D)。PCoA结果显示,DSS+Pg组的肠道微生物群落结构相较于PBS组及DSS组存在明显差异。值得注意的是,EP与TP的干预似乎在一定程度上阻止了DSS+Pg诱发的生态失衡,具体表现为DSS+Pg+EP/TP组的微生物群落组成与对照组及DSS组更为接近(图5E-F)。
门水平分析显示,DSS+Pg处理显著改变了肠道微生物群落的组成,尤其是疣微菌门的相对丰度显著减少,而变形杆菌门则相应增加。但EP与TP的干预有效逆转了这些变化(图5G)。属水平分析显示,Muribaculaceae、乳杆菌、阿克曼菌及Rikenellaceae_RC9_gut_group是主要的粪便微生物群落成员(图5H)。通过Spearman相关性分析,研究确认了前12个优势属与多种炎症标志物之间存在显著的相关性(图5I)。
LEfSe分析显示,EP与TP处理均促进了阿克曼菌、Marvinbryantia、Christensenellace_R_7_group及Ruminococcus等分类群的增加,同时抑制了Tuzzerella与Oscillaibacter的丰度(图5J-K)。此外,EP干预还显著提升了能够产生短链脂肪酸(SCFA)的双歧杆菌与梭菌等分类群的丰度,这些菌群可能在肠道炎症的调控中扮演重要角色(图5L)。
综上所述,EP干预通过有效缓解Pg诱导的肠道微生物群落失衡,进而减轻了肠道炎症的严重程度。
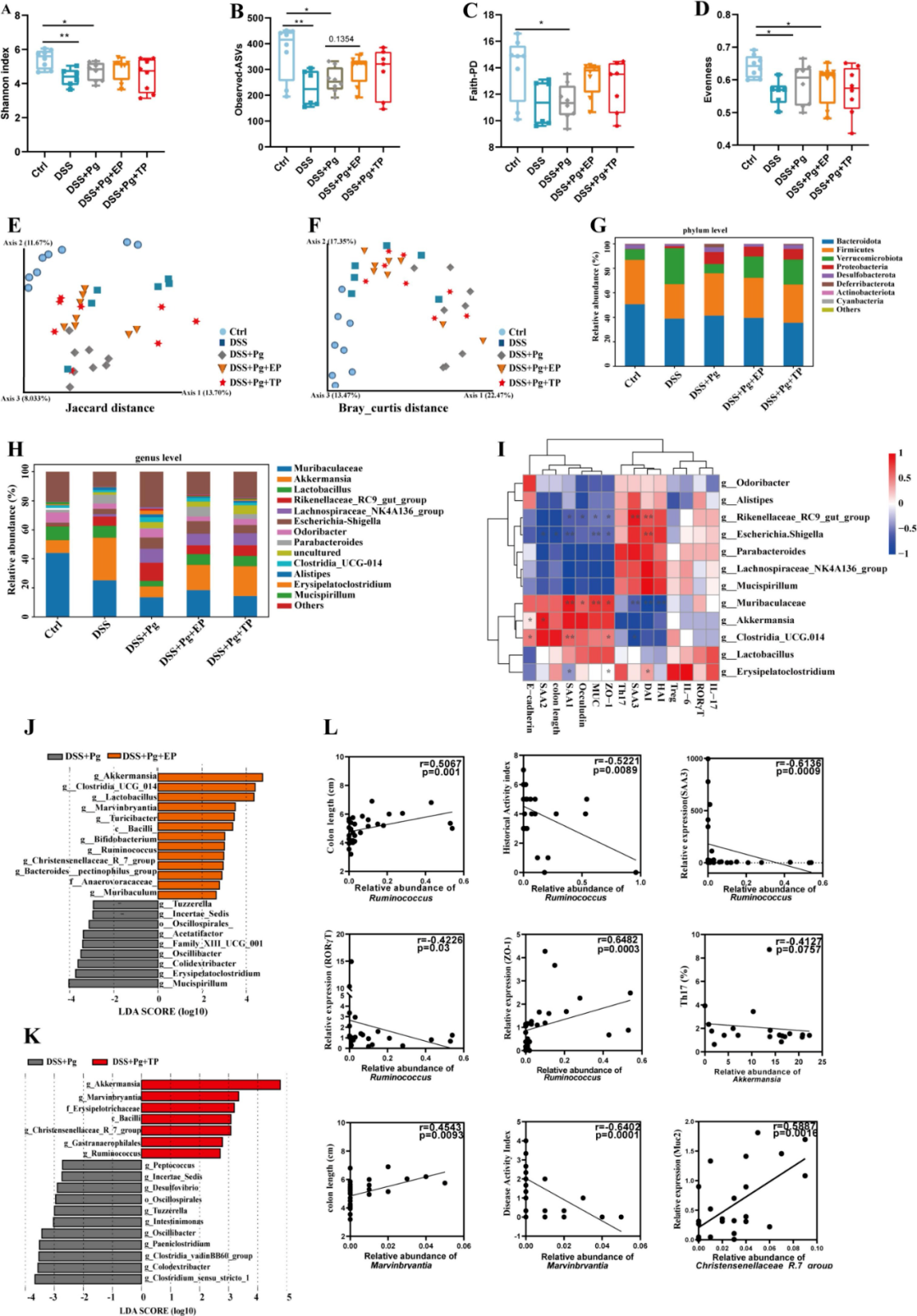
图5 EP缓解Pg引起的肠道微生物群失调
结论
总之,该研究结果强调了EP作为针对Pg相关疾病潜在预防与治疗手段的广阔应用前景。
参考文献:
Li M, Qu R, Li P, Mo X, Liu J, Dong B, Liu L, Xu ZZ. Epimedium polysaccharides mitigates Porphyromonas gingivalis-exacerbated intestinal inflammation by suppressing the Th17 pathway and modulating the gut microbiota. Int J Biol Macromol. 2024 Oct;278(Pt 1):134203. doi: 10.1016/j.ijbiomac.2024.134203
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言

















#肠道炎症# #淫羊藿多糖#
42