Vorasidenib解锁IDH1/2突变胶质瘤靶向治疗,还有哪些问题值得关注?
6小时前 苏州绘真医学 苏州绘真医学 发表于陕西省
vorasidenib 用于手术或活检后 WHO 2 级 mIDH 胶质瘤的试验结果令人鼓舞,毫无疑问,在未来几年里,该药物将成为管理这些患者的重要治疗选择,可能被设定为新的标准治疗。
异柠檬酸脱氢酶(IDH)抑制剂治疗 2 级 IDH 突变型(mIDH)胶质瘤患者的临床疗效是神经肿瘤学的重大治疗进展。它扩大了传统放射治疗和细胞毒性化疗之外的治疗选择,这些传统疗法在延长患者生存期的同时,可能会导致显著的长期神经毒性作用。INDIGO 研究表明,与安慰剂相比,泛 mIDH 抑制剂 vorasidenib 可改善接受手术切除或活检的 2 级 mIDH 胶质瘤患者的无进展生存期,并且耐受性良好。然而,这些令人鼓舞的结果留下了一系列悬而未决的问题:更高级别的 mIDH 胶质瘤患者会获益吗?什么时候开始和停止治疗合适?这种新的治疗选择与其他治疗方式如何结合?在这项研究中,我们回顾了用于解决这些问题的现有有限数据,提供了关于如何与患者讨论这些空白的框架,并强调了神经肿瘤学界需要什么来获得更明确的答案。
Vorasidenib 在初治 2 级胶质瘤患者中显示出肿瘤控制。
其对高级别或复发性胶质瘤患者的疗效有待确定。
其对肿瘤生物学和后续治疗疗效的影响仍然未知。
研究背景
过去的 20 年里,在低级别弥漫性胶质瘤(LrGG,世界卫生组织 [WHO] 2 级和 3 级弥漫性胶质瘤)中发现了各种分子改变。特别是,自 2016 年以来,异柠檬酸脱氢酶(IDH)1 和 2 基因突变以及 1p/19q 染色体缺失被纳入 WHO 分类。IDH 突变型(mIDH)胶质瘤现在在 WHO 分类中单独分类:少突胶质细胞瘤,mIDH 和 1p/19q 共缺失;和星形细胞瘤,mIDH(无 1p/19q 共缺失)。最大限度的安全切除,可行时进行功能定位,是诊断时的一线治疗。然而,迄今为止,对于初始诊断时的后续治疗策略(放疗 [RT] 和/或化疗 vs. 积极监测)几乎没有共识。尽管具有里程碑意义的 RTOG 9802 研究的数据表明,化疗联合 RT 的总生存期(OS)优于仅 RT(13.3 vs. 7.8 年;死亡风险比 [HR] 为 0.59;P = 0.003),并且经常被认为是标准治疗选择,但临床医生和患者仍然对长期神经毒性影响持谨慎态度。对于复发的管理(RT和/或化疗vs二次手术),共识更少。这些复杂的治疗决策不仅要考虑肿瘤学生存获益,还要考虑潜在的短期和长期副作用,这些副作用可能对神经功能、生活质量(QoL)和认知产生负面影响。以患者特定的方式比较不同选择的获益/风险比是一项具有挑战性的任务,也是这些患者多学科管理的核心组成部分。
近年来已经开发了几种 mIDH 抑制剂,以小合成分子的形式,抑制发生变异的 IDH 酶的异常活性(表 1)。存在 IDH 突变时,变异形式的 IDH 酶产生高水平的 D-2-羟基戊二酸(D-2-HG),这是一种肿瘤代谢物,可积累并竞争性抑制各种 α-酮戊二酸依赖性酶。这导致 DNA 羟甲基化、基因表达、细胞分化和肿瘤微环境的变化。抑制变异形式的IDH酶在术前接受mIDH抑制剂治疗的患者中可减少肿瘤组织中D-2-HG的产生,在实验模型中可抑制肿瘤细胞增殖。

表1
Vorasidenib 是一种 IDH1/IDH2 突变酶抑制剂,一项 3 期试验比较了Vorasidenib与安慰剂用于 331 例确诊 2 级 mIDH 胶质瘤的患者(INDIGO,NCT04164901),结果令人鼓舞。在预先设定的第二次中期分析中,报告无进展生存期(PFS;27.7 vs. 11.1 个月,HR = 0.39,95% 置信区间 [95% CI] 0.27-0.56,P < 0.001)显著延长,基于疗效,该试验提前揭盲,该药于 2024 年 8 月初获得美国FDA批准。由于该研究包括针对随机分配到安慰剂组的患者的交叉设计,vorasidenib 对 OS 的影响将无法解释。类似地,vorasidenib 可能对复发时其他治疗方式(如 RT 和细胞毒性化疗)的疗效的影响,也无法从该研究中得到答案。接受 vorasidenib 的患者的生长速率(6 个月内体积增加的百分比)降低(-2.5%),而接受安慰剂的患者增加(+13.9%),差异为 16.8%(95% CI:12.9,20.8;P < 0.001)。此外,开始使用 vorasidenib 后,患者内生长速率下降。Vorasidenib 耐受性良好,vorasidenib 组中 22.8% 的患者出现 ≥3 级毒性(主要丙氨酸氨基转移酶、天冬氨酸氨基转移酶和 γ-谷氨酰转移酶水平升高),3.6% 的患者因不良事件永久停药。
文献数据支持 mIDH 抑制剂对非强化低级别疾病更有效,并且它们对肿瘤体积的影响可能需要一定时间才显现出来。在这种情况下,INDIGO 研究评估了 vorasidenib 在术后不需要立即治疗的患者中延迟 RT 和/或化疗的潜力及其毒性。为了尽量减少治疗后(手术和 RT)影像学变化对主要结局 PFS 的影响,仅纳入在入组前确诊2级胶质瘤超过1年但不到5年、有可测量病灶且未接受过任何药物治疗的患者。因此,vorasidenib 对确诊 3 级胶质瘤的患者的有效性和/或其对既往接受过肿瘤治疗的患者的疗效目前尚不清楚。
在本综述中,我们提出了一系列问题作为框架,来回顾有关 mIDH 抑制剂(包括 vorasidenib)疗效的现有数据,并强调了仍然缺乏数据的地方。最重要的是,我们承认,虽然 INDIGO 结果在整个脑肿瘤界引起了极大的热情,但这些 PFS 结果仍然是初步的,vorasidenib 对 OS 的影响未知。我们将讨论(1)哪些患者可能获益于 mIDH 抑制剂,包括肿瘤生物学或影像学表现不严格符合“INDIGO 样”的患者;(2)何时可以考虑 mIDH 抑制剂,例如诊断时vs复发时没有可测量疾病的患者,或与其他治疗方式联合使用;(3)如何考虑其使用时长以及评估治疗反应。
哪些患者——生物学和影像学——可能获益?
IDH突变星形细胞瘤和/或少突胶质细胞瘤患者?
INDIGO 研究缺乏有关 OS 的数据,vorasidenib 似乎对两种分子亚型的 mIDH 胶质瘤的 PFS 都有影响:在 172 例少突胶质细胞瘤,mIDH 和 1p/19q 共缺失患者中,HR = 0.32(95% CI:0.18-0.57),在 159 例星形细胞瘤患者中,HR = 0.47(95% CI:0.29-0.75)(表 2)。safusidenib是一种可穿透血脑屏障的 mIDH1 抑制剂,safusidenib I 期试验显示,在 47 例胶质瘤患者中,PFS 曲线似乎有利于少突胶质细胞瘤患者,尽管样本量小且随访持续时间短,使作者无法进行任何正式比较。vorasidenib、艾伏尼布或 olutasidenib I 期或 II 期试验的已发表数据报告了少突胶质细胞瘤和星形细胞瘤的肿瘤反应。目前,数据提示星形细胞瘤和少突胶质细胞瘤患者似乎都能获益于 mIDH 抑制剂。

表2
3级IDH突变胶质瘤患者?
这个问题引出了有关 mIDH 胶质瘤分级定义的几个重要(且未解决)问题,特别是考虑到 LrGGs 肿瘤级别可能的空间和时间异质性。
首先,正如 Preusser 等人最近所强调的那样,区分 2 级和 3 级 mIDH 胶质瘤受到缺乏定义间变性的标准化组织学标准的挑战,导致评分者间差异很大。事实上,分级判定基于神经病理学家主观判断的定性特征:有丝分裂活性增加、细胞增多或核异型性增加。与弥漫性胶质瘤的分子特征相比,该分级系统随时间的推移变化不大,存在与微血管增殖、细胞增多的定义和识别等相关的未解问题。特别是,有丝分裂活性增加的定义尚不清楚,没有确定或经过验证的区分低级别和高级别胶质瘤的阈值。此外,在确定有丝分裂计数方面存在一定的技术差异,最常计算的是 10 个高倍视野,少数情况下计算 1000 个肿瘤细胞,有或没有选择细胞最多的区域或 Ki-67 指数最高的区域。临床实践中通常对少突胶质细胞瘤,mIDH 和 1p/19q 共缺失采用 6 个有丝分裂的阈值,对星形细胞瘤,mIDH 采用 2-3 有丝分裂的阈值。然而,几项回顾性研究显示,不同的有丝分裂计数阈值(1 - 6)没有预后影响(对 OS 和/或 PFS)。最近一项研究分析了 EORTC 22033-26033 和 CATNON 试验患者,发现有丝分裂计数(≤2 或 >2)可预测 PFS,但不能预测 OS(P 趋势 = 0.07)。应该注意的是,神经外科手术切除的质量,一个重要的预后因素,在这些研究中未被纳入多变量生存分析。最近,Tran 等人的研究纳入了 75 例未接受术后立即治疗的星形细胞瘤,mIDH 患者,评估了术后残余肿瘤体积与有丝分裂数量。有丝分裂数量(阈值 ≥6 vs. <6 个有丝分裂/3 mm2 )似乎与较短的 OS 相关,在体积 <1 cm3(76 个月 vs. 未达到,P = 0.0005)和 ≥1 cm3(52 vs. 121 个月,P = 0.08)的肿瘤中均是如此。
mIDH 胶质瘤组织学分级的空间异质性有较多研究,尽管相关研究少于空间分子异质性。它反映了肿瘤进展过程中的连续变化情况,从 2 级到更高的 3 级或 4 级,经历一个细胞密度和血管密度高但内皮增殖极少的中间状态。在非强化肿瘤患者中,观察到3级或4级微病灶或大病灶被主要为2级组织学包围的情况。这种情况的出现频率(在法国蒙彼利埃三级中心的经验中,~15% 的患者;未发表的数据)取决于切除范围(EOR):由于这些病灶通常位于肿瘤中心,因此可能不包含在活检或部分切除术样本中。这可能导致在包括很大比例的部分切除或活检样本(例如,RTOG 98028 和 INDIGO13)或未对 EOR 进行体积量化(例如,INDIGO13)的试验中,胶质瘤分级被低估。据报道,这些患者在次全或全切除术后预后优于 3 级或 4 级 mIDH 胶质瘤患者,其中一些患者或可采用术后观察等待策略进行管理。这些患者的管理应不同于具有同质恶性特征的患者。因此,定义间变的组织学标准问题似乎不太重要,因为按照目前的建议,将肿瘤缩小到最具侵袭性的部分是值得怀疑的。
根治性手术后组织学分级的时间异质性似乎也是可能的。45 例 2 级 mIDH 胶质瘤患者存在 3 级或 4 级病灶,他们在手术后接受监测,未进行额外治疗,其中一些患者在几年后疾病减缓进展,接受了二次切除(见图 1 和 2)。复发切除肿瘤的病理分析提示同质性 2 级胶质瘤,无间变,表明根治性手术可能显著改变疾病的自然病程,此类患者可能会像“纯”2 级患者一样获益于 vorasidenib。
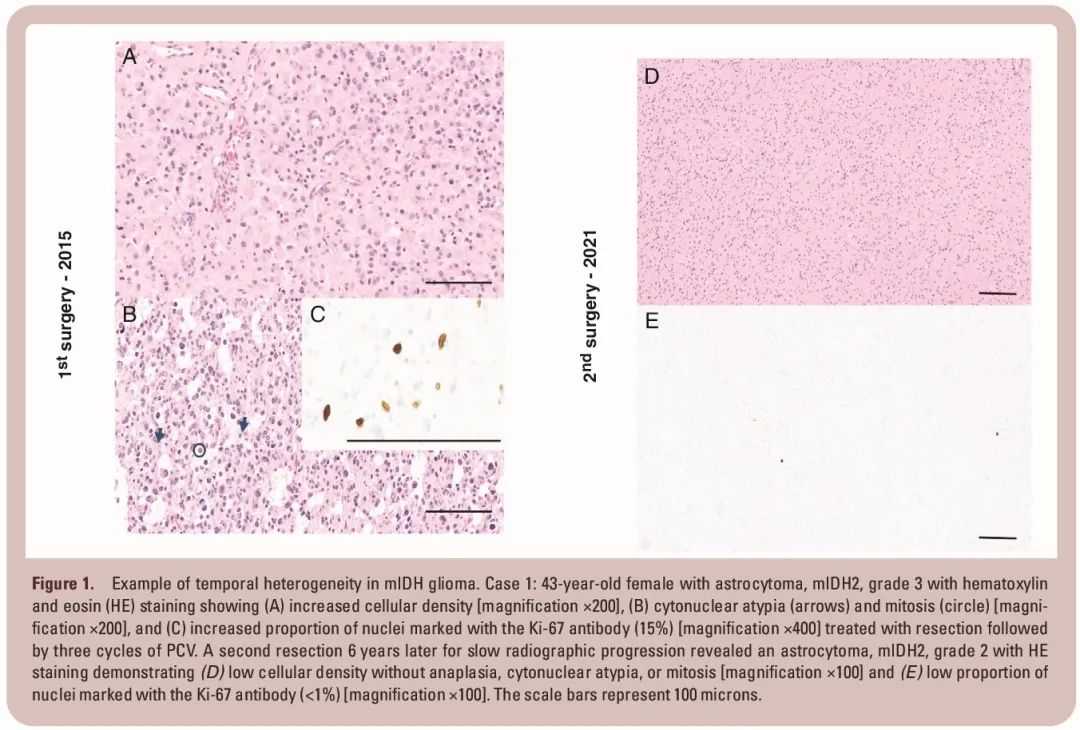
图1
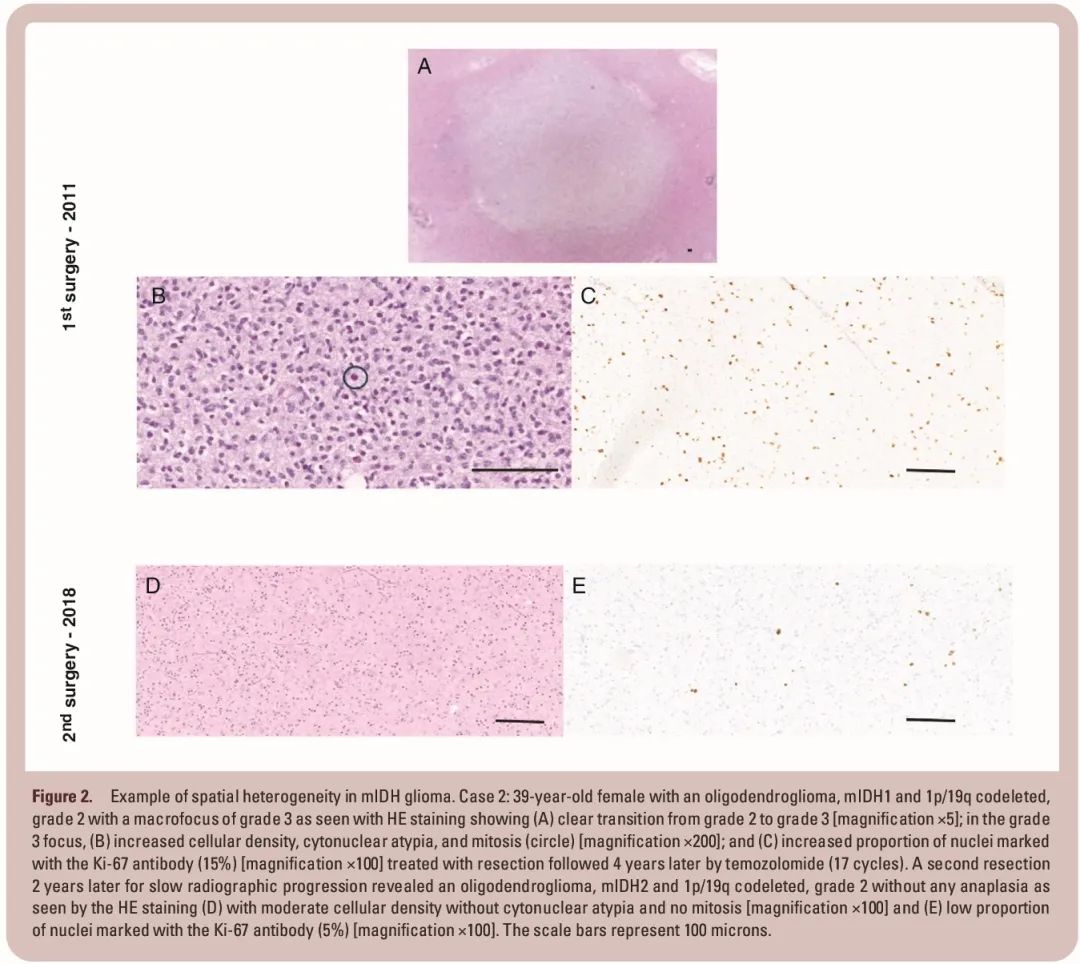
图2
总之,使用肿瘤组织病理学分级作为使用 mIDH 抑制剂的唯一标准可能未充分利用其潜力,排除了一部分潜在获益患者。
强化疾病患者?
与前面的问题一致,增强后强化的存在是肿瘤侵袭性的影像学标志物,通常与间变相关;在一些生长缓慢的肿瘤中可能观察到微弱、非结节状、稳定的增强后强化(见图3 和 4)。来自 mIDH 抑制剂的 1 期或 2 期试验的数据一致报告,非强化疾病患者的缓解率更高,PFS 更长(表 2)。这些数据支持这样一种观点,即当生长仍然缓慢时,mIDH 抑制剂可能在疾病早期有效。然而,这些早期试验的样本量较小,一些强化疾病患者获益,提示一部分尚未确定的强化肿瘤患者可能是 mIDH 抑制剂的候选者。值得注意的是,在一项 olutasidenib 1/2 期试验中,25 例可评估反应的患者中有 23 例(88%)存在强化,包括 2 例中位 8.8 个月后获得部分缓解的患者。在 INDIGO 研究中,只有“轻微、非结节状、不可测量”强化的患者符合条件。因此,vorasidenib 对结节状和可测量强化患者(无论是否通过手术切除)的疗效,仍有待明确评估。

图3

图4
具有其他影像学特征的患者:生长速率和肿瘤体积?
除了增强后强化外,肿瘤侵袭性还可以使用肿瘤生长速率来评估,在少突胶质细胞瘤和星形细胞瘤中,肿瘤生长速率是 LrGG 的预后因素。可以假设 vorasidenib 对生长缓慢的肿瘤最有效,尽管这些数据尚不清楚。在 INDIGO 研究中,56 例接受 vorasidenib 治疗的患者收集了治疗前 MRI 扫描,初步数据可能在不久的将来获得。然而,INDIGO 研究的一个关键入组标准是针对不需要立即治疗、疾病稳定至少 1 年的患者。虽然这是支持当前高危疾病放化疗标准的审慎要求,但它限制了解决 vorasidenib 对不同生长速率肿瘤影响的能力,因为生长速率较快的患者可能被排除在外。
INDIGO 研究包括活检和切除病例。在基线肿瘤最长直径 <2 cm 的患者中,未发现 vorasidenib 对 PFS 的显著影响。然而,这可能是由于该患者亚组缺乏功效(vorasidenib 组 n = 29,安慰剂组 n = 26)。vorasidenib 组治疗期间的肿瘤生长速率显著低于安慰剂组(P = 0.009)。基线肿瘤体积对 vorasidenib 疗效的影响尚未报道。
难治性癫痫患者?
癫痫发作和抗癫痫药物的副作用会显著影响 mIDH 胶质瘤患者的 QoL。目前,术后难治性癫痫发作通常是早期放疗或化疗的指征,已知放化疗可能降低癫痫发作频率。关于 mIDH 抑制剂对癫痫影响的数据非常少。少数病例报告显示,使用 艾伏尼布 的患者癫痫发作频率降低。由于癫痫发作未得到控制的患者被排除在 INDIGO 研究之外,因此未探索 vorasidenib 对此类患者的影响。在大约 1 年的治疗中,vorasidenib 组治疗期间维持癫痫发作控制。鉴于 vorasidenib 组中只有 20 例患者自我报告在入组试验前 30 天内至少有 1 次癫痫发作,无法明确评估药物对这些患者癫痫发作的活性。
在手术后一线治疗之外,患者何时会从IDH抑制剂中获益?
开始使用 mIDH 抑制剂的最佳时机是一个关键问题。当然,最有力的数据来自 INDIGO 研究,显示在有可测量疾病的手术或活检后 2 级患者中,vorasidenib 优于观察等待。在该研究中,如果患者距离最近一次手术不少于 1 年且不超过 5 年,则符合条件。vorasidenib 组距最后一次手术的中位时间为 2.5 年(范围 0.2-5.2),安慰剂组为 2.2 年(范围 0.9-5.0)。然而,还有其他几个临床相关时间点仍然存在关键问题(见图 5)。

图5
全切除后?
目前,专注于评估 mIDH 抑制剂用于可测量疾病患者,这是可以理解的。在 LrGG 临床试验中,需要影像学终点,例如客观缓解率(ORR)和 PFS,作为 OS 的替代标志物,由来已久。为了获得成熟的 OS 数据,可能需要几十年的时间和资源来跟踪这些患者,这可能与更快的科学发现速度产生矛盾。然而,随着 mIDH 抑制剂进入临床实践,关于何时治疗没有可测量疾病的患者,存在明显的知识空缺。
在 INDIGO 研究中,vorasidenib 改善了 PFS,无论距离上次手术多久(<2、2-3 或 ≥4 年)。此外,在两组中大多数患者的最佳 ORR 为疾病稳定,在 vorasidenib 组中为 83%,在安慰剂组中为 88%,尽管随访时间有限。这种缓慢的生长速率加上最可能的结局是疾病稳定(少数患者达到轻微或部分缓解)使得临床医生难以确定何时开始治疗。
EOR 被确立为 mIDH 2 级胶质瘤患者的预后较好因素。在诊断时 EOR ≥75% 的患者中观察到 PFS、OS 和恶性转化时间较优。目前,切除术后的患者通过连续影像学检查积极监测数年,之后才推荐额外治疗。由于目前对 mIDH 抑制剂的评估严重依赖影像学终点,临床医生如何为从肿瘤完全切除中获益的患者提供建议,相关信息很少。这些患者在没有 MRI 靶病灶跟踪的情况下,是否应该接受开放期限的治疗?这些发现突出了一个问题,及对于位于切除可能导致长期神经损伤的大脑区域的肿瘤,积极手术切除的作用如何。在 mIDH 抑制剂时代,提供者与患者关于实现全切除或超全切除可接受风险的讨论可能需要完善。鉴于 INDIGO 研究结果支持从诊断起长达 5 年的治疗反应,如果可以实现全切除,对于愿意接受积极监测的患者,也许可以考虑观察等待方法。另一方面,还有一个有吸引力的假设,即 IDH 抑制剂越早开始,抑制致癌活性的机会就越大。随着时间的推移,mIDH 胶质瘤的分子演变会变得更加复杂,细胞增殖可能不再由 D-2-HG 驱动。如果 INDIGO 研究的长期结果表明 vorasidenib 的持久疗效,那么在初始没有残留可测量疾病的情况下开始治疗的问题将值得进行专门的研究(终点是影像学复发)。
INDIGO 研究的结果有望促进将 MRI 体积测量纳入临床,而不是神经肿瘤学疗效评估标准中的传统 2D 分析。最近有研究探索了切除后 mIDH 胶质瘤的自然病程,强调了在手术切除后进行连续影像学检查的患者中,将肿瘤体积生长速率与分子特征相结合的优势,这对于决定何时开始使用 mIDH 抑制剂是一个越来越重要的因素。此外,在接受 mIDH 抑制剂的患者中,体积评估的广泛可及性对于识别治疗反应和进展至关重要。
与诊断时标准治疗相比?
虽然本文的目的不是回顾所有关于 mIDH 胶质瘤管理的文献,但需要强调对 mIDH 抑制剂vs当前标准治疗的了解 。治疗 LrGG(2 级和 3 级)的临床医生都非常熟悉随机 3 期试验使用 PFS 作为指标所带来的挑战。例如,EORTC 22845 研究表明,早期放疗相比延迟放疗改善了 PFS(5.3 vs. 3.4 年;HR = 0.59),但最终 OS 没有差异(7.4 vs. 7.2 年;HR = 0.97)。两项大型试验探索了PCV + RT vs 仅 RT用于间变性胶质瘤 ,也显示 PFS 改善的早期证据,但中位随访5.1年时,OS 没有差异。直到中位 >18-19 年的长期随访才明确:在 1p/19q 共缺失患者亚群中,与仅 RT 相比,添加 PCV 显著改善了 PFS(EORTC 26951:HR = 0.49;P = 0.007 和 RTOG 9402:HR = 0.46;P < 0.001)和 OS(EORTC 26951:HR = 0.60;P = 0.063 和 RTOG 9402:HR = 0.61;P = 0.02)。
因此,在我们等待 INDIGO 研究这些令人鼓舞的 PFS 结果数据成熟时,在临床实践中,在不知道其对 OS 的影响的情况下,何时开始使用 mIDH 抑制剂仍然是一个挑战。此外,必须认识到,INDIGO 研究的结果不能也不应该直接与这些具有里程碑意义的 RT 和细胞毒性化疗研究的结果进行比较。
然而,神经肿瘤学界对 INDIGO 研究令人鼓舞的 PFS 结果持审慎的乐观态度,人们对这些 mIDH 抑制剂的良好耐受性充满热情。尽管 EORTC 26951 和 RTOG 9402 试验患者的生存结局显著,但多模式 RT 和细胞毒性化疗的长期毒性对生存者及其家人可能是毁灭性的。普遍认为替莫唑胺的毒性低于 PCV,即使是接受替莫唑胺治疗的患者,一部分患者也可能诱导超突变表型,这进一步使情况复杂化。
在这些患者停用 mIDH 抑制剂并继续接受其他治疗时对其进行跟踪至关重要,有助于了解这种抑制剂对这些肿瘤的自然分子进化和对后续治疗的临床反应的生物学影响。
在RT和/或化疗后疾病稳定的患者中?
INDIGO 研究纳入了仅接受切除术/活检,未接受额外治疗的患者。鉴于 LrGG 表现出不受手术影响的持续生长,所有患者在入组试验时都有疾病进展。纳入 mIDH 抑制剂早期试验的患者在入组时也肿瘤进展,尽管肿瘤进展模式(肿瘤生长速率)没有详细说明。因此,没有足够的数据来评估 vorasidenib 在既往治疗(RT 和/或化疗)导致生长停滞的肿瘤中的疗效。在这种情况下,vorasidenib 是否会通过进一步延迟肿瘤再次生长而带来临床获益尚不清楚。似乎需要开展临床试验评估 mIDH 抑制剂与放疗和/或化疗联合使用或作为放疗和/或化疗后维持治疗的疗效,来回答这个问题。
在复发患者中?
随着 vorasidenib 变得可及,临床医生和患者可能面临的最直接挑战之一是它在 RT 和/或全身治疗后复发时的作用。INDIGO 研究排除了既往接受过药物治疗的患者,但许多艾伏尼布和 vorasidenib 早期研究都包括复发性疾病患者(表 2)。
除了在研究入组时存在强化外,目前为止没有证据表明既往接受过治疗的患者对 mIDH 抑制剂没有反应。有趣的是,在接受艾伏尼布治疗的患者中,细胞周期通路基因(CDKN2A/B、CCND2,3、CDK4 和 RB1)变异与较短的 PFS相关(P<0.001),无论强化状态如何。WHO 2021 分类包括了 CDKN2A/B 纯合缺失作为诊断 4 级疾病的依据,因为其预后较差,提示分子相较于影像学特征可能是更强大的预后标志物。这可能支持在复发时获取组织进行测序,并在没有较高分子级别的情况下考虑使用 mIDH 抑制剂。这是另一种临床相关场景,在改变治疗之前(例如,下一次治疗的时间)了解肿瘤体积生长速率有助于决策,生长较慢的肿瘤(无论既往治疗情况如何)或许更有可能从 mIDH 抑制剂中获益。对于复发时非强化疾病患者,艾伏尼布和vorasidenib早期研究均显示持久的疾病稳定(表2),这在疾病复发的情况下可能非常具有临床意义。
鉴于复发性 mIDH 胶质瘤缺乏标准治疗,需要权衡 mIDH 抑制剂的使用与再切除、全身治疗、RT 或其中某些组合的作用。决策需要考虑到体能和认知状态、既往治疗毒性、肿瘤位置、疾病范围、对进一步可切除性的影响或放疗毒性,以及可能的其他几个因素(包括患者的选择)。鉴于在复发情况下缺乏前瞻性、随机临床试验数据,mIDH 抑制剂的可及性也将在很大程度上取决于每个国家/地区当地监管机构的批准。撰写本文时,施维雅正在开展一项扩大使用计划(NCT05592743),以帮助解决这个问题,增加基于获批适应症可能被拒绝使用的患者的可及性。
在既往使用过艾伏尼布的患者中?
神经肿瘤学家在未来几个月可能不得不面对的另一个实际问题是,艾伏尼布治疗后疾病稳定或进展的患者是否应予以vorasidenib。一项 1 期围手术期研究表明,接受 vorasidenib 50mg 的患者和接受艾伏尼布每日 500mg 的患者的 PFS Kaplan--Meier 曲线没有差异,vorasidenib 的中位术后治疗持续时间为 14.3 个月(范围 0.9-22.6 个月),艾伏尼布为 15.1 个月(范围 1.8-22.1 个月)。然而,患者数量有限,无法得出明确的结论。vorasidenib 50mg(42.9%,95% CI:17.7-71.1;包括 2 例部分缓解和 4 例轻微缓解)和艾伏尼布 500mg(35.7%,95% CI:12.8-64.9;包括 3 例部分缓解和 2 例轻微缓解)之间治疗医生评估的 ORR 也没有差异,但这一结果也必须谨慎解读。鉴于这些结果,对于艾伏尼布治疗后临床及影像学稳定的患者,目前似乎没有证据提示改用vorasidenib。此外,对于那些使用一种 mIDH 抑制剂后进展的患者,没有关于改用另一种抑制剂疗效的数据,因为在迄今为止所有 IDH 抑制剂研究中,既往暴露都是排除标准。
在有生育潜力的患者中?
鉴于 INDIGO 研究的中位年龄为 40 岁(范围 16-71),反映了确诊 mIDH 胶质瘤的患者较为年龄,mIDH 抑制剂治疗引出了一个问题,患者是否将接受数年甚至数十年的治疗。作为年轻成人,他们正处于职业生涯初期和/或正在完成学业,很可能也正在计划组建家庭,而无限期的治疗对其 QoL 的潜在巨大影响是未解决的问题。
尽管没有关于在怀孕期间使用 mIDH 抑制剂的可及人类数据来告知药物相关重大出生缺陷和流产的风险,但口服 vorasidenib 的动物研究显示与胚胎-胎儿毒性有关——包括流产风险增加,肾脏、心脏和睾丸畸形,骨化延迟和胎儿体重减轻。因此,建议具有生育潜力的女性患者和女性伴侣具有生育潜力的男性患者在治疗期间和最后一次给药后 3 个月内采取有效的避孕措施(见下文)。
也没有关于母乳中存在 mIDH 抑制剂或其代谢物对母乳喂养儿童的影响或对产奶量影响的数据。目前的建议是,女性患者在 vorasidenib 治疗期间和最后一次给药后至少 2 个月内不要母乳喂养。
mIDH 抑制剂可能会降低激素避孕药的疗效,包括口服避孕药、注射剂、植入剂、皮肤贴剂和阴道环。建议女性患者和伴侣有生殖潜力的男性患者使用屏障避孕方法,如避孕套、隔膜、宫颈帽或避孕海绵,来防止怀孕。动物研究表明,vorasidenib 可能会损害女性和男性的生育能力,因此何时开始治疗,保留生育能力将是一个重要考量因素。
如果需要,应探讨辅助生殖技术或其他计划生育方案。这将是治疗团队和倡导团体需要注意的重要考虑因素,并在此过程中为患者及其家人提供所需的资源和支持。
如何纳入标准治疗并确定疗效?
Leung、Berghoff 及其同事的文章“我如何开具和跟进 IDH 抑制剂?”全面阐述了“如何”使用 vorasidenib。然而,我们确实解决了几个关键因素,这些因素在讨论谁将获益以及何时获益时很重要。
联合使用?
鉴于 mIDH 抑制剂良好的毒性特征,对于是否将其添加到标准治疗(例如 RT 和/或细胞毒性全身治疗)中,还是在这些治疗后序贯使用作为“巩固”治疗,这是一个问题。目前,没有评估这些组合安全性或复发时 mIDH 抑制剂对更传统治疗疗效影响的研究来支持这些方法。在这种情况下,存在新的研究问题和试验开发的机会。在缺乏支持数据的情况下,在获得临床试验的安全性数据之前,应避免在临床常规中将 mIDH 抑制剂与 RT 或其他抗肿瘤药物疗法联合应用。
两项正在进行的试验正在探索将 vorasidenib 与免疫疗法相结合:与帕博利珠单抗联合用于复发或进展的强化 mIDH1 星形细胞瘤(NCT05484622),以及与肿瘤特异性肽疫苗联合用于复发性 mIDH1 LrGG(NCT05609994)。
评估疗效及纳入生物标志物?
如上所述,纳入体积分析来评估肿瘤生长将是评估治疗疗效以及决定是否进行后续额外治疗的一个重要方面。部署和标准化体积分析以使其广泛可用,包括使用自动化方法并由临床专家对肿瘤分割进行可视化控制,以确保可行性和可重复性,这需要时间。在此期间,这些患者可能从在影像学分析方面拥有更多专业知识的学术医疗中心获益。也有观点认为,对 mIDH 抑制剂产生影像学(和临床)反应可能需要时间,不过在转向新疗法之前要等待多久也是一个需要解决的关键问题。
作为疗效生物标志物的其他先进成像方式正在开发中。氨基酸 PET 成像在世界范围内可及性越来越高,也许可以无创识别 IDH 状态和预测/追踪反应。其已被证明可以有效评估肿瘤范围,识别恶性程度较高的部位和预测预后,以及监测肿瘤进展与治疗相关变化。尽管其尚未应用于接受 mIDH 抑制剂的患者,但针对最常见 IDH 突变的新 PET 示踪剂正处于早期开发阶段,可能为追踪反应提供一种有前途的方法。
最近的数据还表明,D-2-HG 可以通过专用光谱在体内检测到。D-2-HG 光谱已成功证明可以预测 IDH 状态,并且在 >75% 的 mIDH 肿瘤中报告了可量化的水平。D-2-HG 光谱也正在被研究用于评估对各种疗法的反应,包括 mIDH 抑制剂。在使用 mIDH1 抑制剂的 1 期临床试验中,5 例患者在 1 周后 D-2-HG 水平下降,6 例患者在使用 mIDH 抑制剂几天后报告检测不到的 D-2-HG 水平。目前,2-D-HG 水平变化与解剖成像和患者预后的相关性尚不清楚,对 2-D-HG 水平的依赖不应成为开始或追踪 mIDH 抑制剂治疗的关键驱动因素。需要更多的研究来探索(分子)成像生物标志物和 mIDH 抑制剂的使用。这些生物标志物也将是前瞻性试验的重要次要/探索性目标。
vorasidenib 在短期内似乎不会影响神经认知功能或 QoL(治疗最多 13 个月时收集的数据),但其在长期环境中的可能影响尚未评估。未来试验纳入这些结局很重要。脊髓液中循环 2-D-HG 水平也显示出作为另一种监测方法的早期前景。
停止?
与用于治疗原发性脑肿瘤患者的大多数疗法(RT 和细胞毒性治疗)形成鲜明对比的是,mIDH 抑制剂的治疗似乎是开放期限的。在 mIDH 抑制剂的早期阶段和 INDIGO 研究中,治疗持续至进展或出现不可接受的毒性。使用其他靶向药物的经验引起了对停止治疗后复发的担忧,目前还没有试验试图解决这个问题。一般来说,长时间使用药物可能诱发特定的不良反应。因此,这种开放期限治疗引起了对假定的长期不良反应的一些担忧。在未来规划试验和转化为临床常规时,需要考虑长期毒性和经济负担。
总 结
vorasidenib 用于手术或活检后 WHO 2 级 mIDH 胶质瘤的试验结果令人鼓舞,毫无疑问,在未来几年里,该药物将成为管理这些患者的重要治疗选择,可能被设定为新的标准治疗,将未来治疗与之比较。
参考文献:
Darlix A, Preusser M, Hervey-Jumper SL, Shih HA, Mandonnet E, Taylor JW. Who will benefit from vorasidenib? Review of data from the literature and open questions. Neurooncol Pract. 2024 Nov 14;12(Suppl 1):i6-i18. doi: 10.1093/nop/npae104. PMID: 39776530; PMCID: PMC11703370.

本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言


















#胶质瘤# #Vorasidenib#
4