2024 EANO指南更新1:成人胶质瘤、胶质神经元和神经元肿瘤靶向治疗选择的合理分子检测
2024-10-27 苏州绘真医学 苏州绘真医学 发表于上海
EANO 指南提出成人胶质瘤等肿瘤靶向治疗的分子检测建议,介绍 panel 测序识别靶点的益处,对多个靶点检测及治疗给出综合建议,指南模块化结构可定期更新。

胶质瘤、胶质神经元和神经元肿瘤成人患者的标准治疗包括手术、放疗和化疗的组合。对于许多系统性癌症,靶向治疗是标准治疗的重要部分,但在中枢神经系统(CNS)肿瘤中,大多数系统性癌症治疗靶点的预测意义不太明确。2023 年,EANO 指南委员会提出了基于证据的靶向治疗的合理分子靶点检测建议。在所有回顾的靶点中,只有 BRAF V600E 突变检测被证明具有临床益处;尽管监管部门批准了 NTRK 基因融合和高肿瘤突变负荷(TMB)泛癌种疗法用于成人脑肿瘤患者,但对患者临床益处的证据仍然有限。该指南具有模块化结构,允许定期更新各个部分并添加新部分。此版本(更新 1)概述了 PTEN、H3F3A、MTAP、RET 和 IDH 检测的依据,并更新了TMB-H 和错配修复缺陷部分。还概述了用于突变和融合检测的常规NGS的治疗益处。此版本的补充包含对所有靶点的深入审查,而主要手稿则包含修订后和新靶点的最终建议。将定期进行更新。
研究背景
2023 年 5 月,发布了“成人胶质瘤、胶质神经元和神经元肿瘤靶向治疗选择的合理分子检测 EANO 指南”。该指南旨在为成人原发性脑肿瘤患者的靶向治疗提供合理的分子检测方法,包括哪些肿瘤类型进行检测以及哪些靶点提供合理的治疗。对于靶点选择和评估,使用了 ESMO 分子靶点临床可操作性量表(ESCAT)和 ESMO 临床获益量表(MCBS),它们提供了靶点的证据水平和评分系统来评估靶点抑制的临床益处。该指南还介绍了致病变异解读的背景以及评估致病变异的各种方法。根据 2021 年发布的第 5 版 WHO 中枢神经系统肿瘤分类(WHO CNS5),EANO 指南提供了有关如何进行分子检测以诊断脑肿瘤的证据。“成人胶质神经元和神经元肿瘤靶向治疗选择的合理分子检测 EANO 指南”具有模块化结构,允许通过添加和更新章节来定期更新,无需更新整个文本。部分原因是在发布后发现的遗漏,但也因为需要提供有关新靶点的信息,我们现在提供第一次更新。本次更新涵盖 PTEN/PI3K,IDH作为治疗靶点,RET 融合,MTAP 缺失以及肿瘤突变负荷(TMB)章节的更新。此外,我们还回顾了评估NGS panel在日常实践中应用的研究,目的是确定脑肿瘤患者队列的治疗靶点。在这份主要手稿中,仅介绍了各个靶点的结论部分。这是重要的 EANO 文件,包含有关分子靶点检测的所有当前建议。有关 ESCAT 评分和 ESMO-MCBS 的依据,我们建议读者参考 2023 年首次发布的该指南的重要内容,详细介绍了分子检测的背景,各变异的病理意义以及这些变异的临床意义。图 1 展示了各种胶质和(胶质)神经元肿瘤中靶点的相对频率,以及靶点的 ESCAT 分数。EANO 指南委员会的目的是继续定期更新本指南。表 1 概述了报告的靶点,以及这些靶点是在哪个版本的指南中报告或更新的。
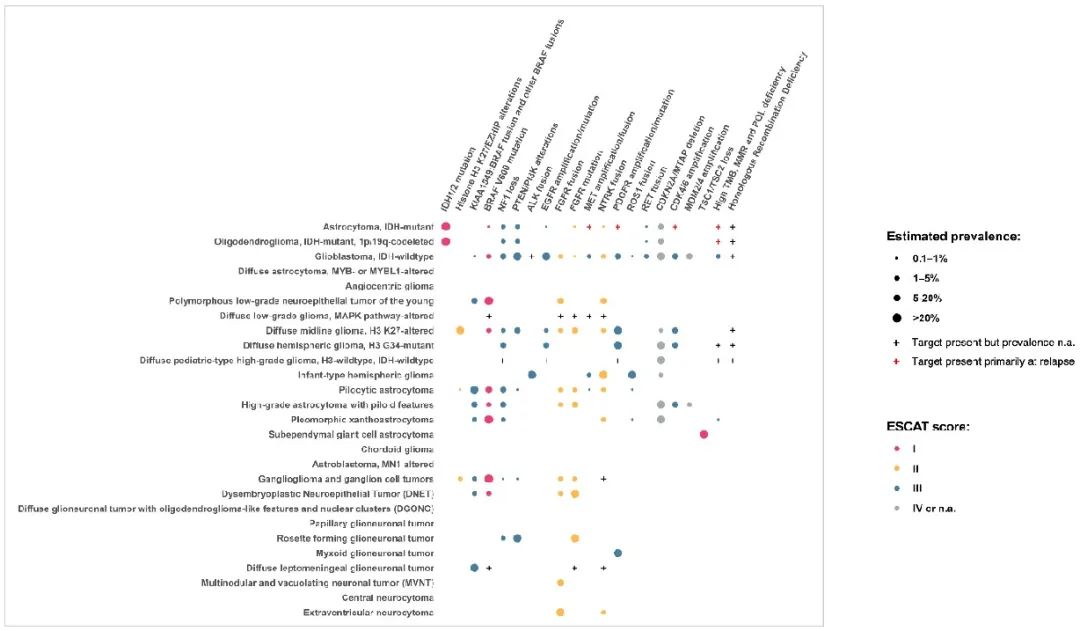

图1
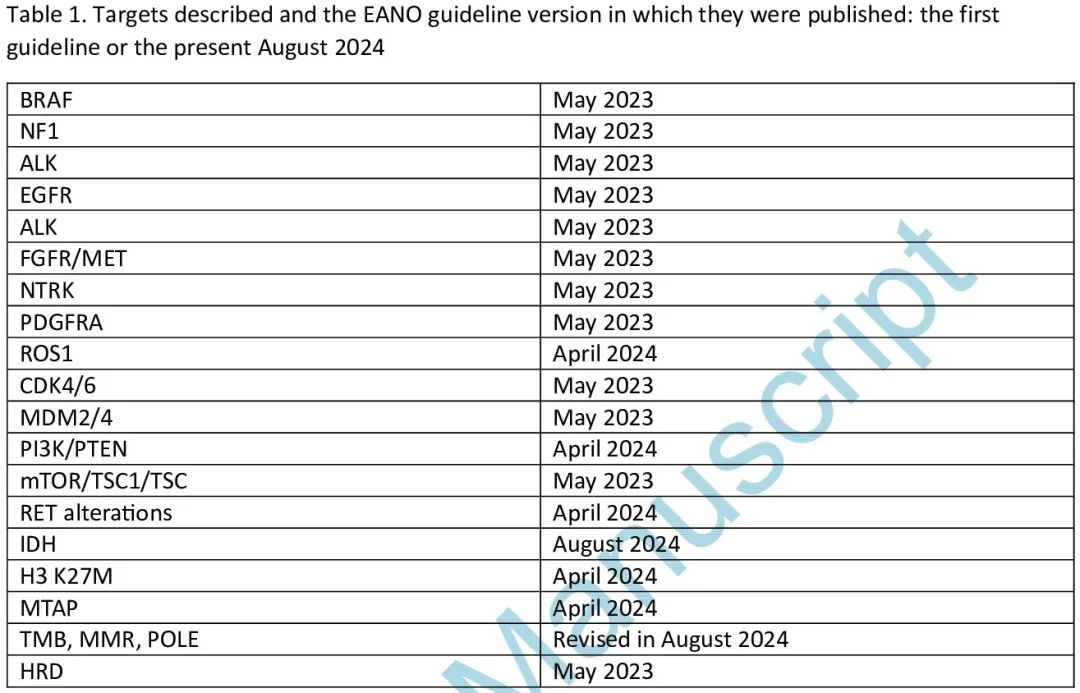
表1
panel测序识别靶点的治疗益处和临床结局
下一代测序(NGS)panel 在胶质瘤和(胶质)神经元肿瘤分类中的应用正在增加,因为一次检测可以同时分析突变、融合和拷贝数变异。除了根据 WHO 2021 脑肿瘤分类用于常规诊断外,这些 panel 还可用于识别治疗靶点。识别治疗靶点的患者比例通常从 50% 到 80% 不等,提示这些诊断程序对患者有重大益处。用于分析分子变异致病性的数据库不同,不同的数据库可能导致不同的解释。并非所有研究都使用反映靶点可操作性水平的量表,例如基于 FDA 批准的 I 级和 II 级方法以及 ESMO ESCAT 量表。如果没有提供对靶点识别结果的分析,则识别靶点的患者比例仍然是理论上的。这可以在两个层面上完成,实际提供的靶向治疗水平(“由于 NGS 结果导致治疗改变”)或在成功治疗的靶点水平(“持久缓解”)。后者反映了真正的患者获益,但大多数研究未报告这一点。为了更好地了解 NGS panel 在常规 CNS 肿瘤诊断之外为患者带来的益处,应根据 NGS 结果在特定人群中进行随机临床试验(伞式试验)。另一种有助于表明基于生物标志物的治疗潜在有益的方法可以是取得临床获益的患者比例,表现为客观缓解率,匹配治疗(PFS2)的无进展生存期(PFS)比既往治疗(PFS1)长 1.3 倍或长期生存(PFS2/PFS1 比值)的患者比例。这需要对患者队列进行细致的随访,遗憾的是,仅有少数研究提供。在提供此类分析的研究中,报告了 0.25% 至 4% 的临床获益率。关于 442 例 IDH 野生型(wt)胶质母细胞瘤患者的最大研究在 3.4% 的患者中识别了归类为 ESCAT IB-IC(“准备常规使用”)的靶点,在 6.7% 的患者中识别了归类为 ESCAT IIB(探索性)的靶点。343 例靶向治疗候选者(占总人群的 8.6%)中 36 例患者(10.5%)接受了靶向治疗。观察到 3 例缓解(8.3%)(2 例接受达拉非尼/曲美替尼,1 例接受恩曲替尼),在 8 例患者中观察到 PFS2/PFS1 比值超过 1.3(包括 2/4 例接受厄达替尼治疗的患者;1/1 例接受卡马替尼治疗的患者)。因此,343 人中有 6 人获益,约占检测人群的 2.6%。然而,获益率也受其他因素的影响,包括肿瘤类型(IDH-wt 胶质母细胞瘤获得缓解的可能性低于其他弥漫性胶质瘤或胶质神经元肿瘤类型,因为前者通常具有多种通路激活)、有效的脑穿透药物或临床试验的可及性(识别了潜在靶点但没有可及的有效疗法)和提供治疗的疾病分期(仅有晚期,难治性情况下的结果,这些情况下获得缓解的可能性较低)。在 IDH-wt 胶质母细胞瘤中,最常见的变异(EGFR 扩增、PTEN 缺失、PIK3CA 突变、CDK4/6 扩增)目前尚未成功靶向。
几项研究系统地评估了胶质瘤患者的融合。一项研究发现,在 390 例胶质瘤患者中,11%(25/235)的胶质母细胞瘤、12%(5/42)的 3 级星形细胞瘤、8%(2/25)的 2 级星形细胞瘤和 33%(2/6)的毛细胞星形细胞瘤(WHO 2007)携带潜在可靶向融合。与 IDH 突变肿瘤(4%;n = 4/109)相比,IDH-wt 肿瘤(12%,n = 31/261)的融合发生率显著较高(p = 0.011)。最常见的潜在可靶向融合是 FGFR(n = 12)、MET(n = 11)和 NTRK(n = 8)。在 IDH 突变肿瘤中观察到 2 例 MET 融合、2 例 NTRK 融合和 1 例其他融合。在少突胶质细胞瘤中,除了特异性染色体 1p/19q 变异外,未观察到额外的融合(n=15 具有已知的 1p/19q 状态)。另一项研究纳入了 356 例弥漫性胶质瘤患者,在 166 例组织学 4 级胶质瘤(151 例 IDH-wt,15 例 IDH-mt)中,有 53 例携带融合:MET(n = 18)、EGFR(n = 14)、FGFR(n = 12)、NTRK(n = 5)、RET(n = 2)、AKT3(n = 1)和 PDGFRA(n = 1)。在 IDH-wt(48/151,31%)和 IDH 突变 4 级肿瘤(5/15 肿瘤,33%)中均观察到基因融合。在该队列中发现了许多新的基因融合。它们的生物学(致癌性,出乎意料的高融合率的假阳性)和临床相关性(可靶向性)需要在未来的研究中证实。虽然高通量靶向 RNA 测序提供了更广泛的诊断途径,但它也会增加检测到融合基因的假阳性率。第三项研究使用 mRNA 融合 panel 对 647 例弥漫性胶质瘤患者进行了 56 个基因检测,发现 52 例肿瘤(8%)存在潜在可靶向融合(FGFR3: 16,MET: 14,EGFR: 7,NTRK1: 2,NTRK2: 6,BRAF: 6,ROS1: 4 和 PIK3CA: 1)。这些潜在可靶向融合见于 9%(40/458)的胶质母细胞瘤和 4% 的 IDH 突变型星形细胞瘤(4/78),未见于 51 例少突胶质细胞瘤患者。这些患者中有 11 例(21%)(FGFR: 4;MET: 1;EGFR: 2;BRAF: 1;NTRK:3)接受了靶向融合的抑制剂治疗。除 3 例患者在 7 至 12 个月内无进展外,所有其他患者均在 6 个月内复发,未观察到缓解。
用于靶向治疗的panel
NGS panel 检测对胶质瘤的诊断率较高,因此大多数常规使用的 NGS panel 有助于精确分类。然而,识别治疗靶点并成功治疗的患者比例要低得多。从治疗的角度来看,大多数panel可以识别的最相关的变异是 BRAF V600E 突变。RNA-NGS 比 DNA-NGS 更能检测到融合,DNA-NGS可能需要使用特定的 RNA-NGS panel 进行第二次检测,或者倾向于使用 DNA/RNA 组合方法。与 IDH 突变型星形细胞瘤相比,基因融合在IDH-wt胶质母细胞瘤中更常见(~10%)。在 IDHmt 和 1p/19q 共缺失少突胶质细胞瘤中,它们似乎极为罕见。许多融合的临床和生物学意义需要进一步研究。识别的大多数融合靶点低于 ESCAT II 级(FGFR、EGFR、MET),成人患者 NTRK 数据仍然非常有限。根据 II 型 RAF 抑制剂 tovorafenib 和 MEK 抑制剂司美替尼的最新结果,BRAF::KIAA 融合检测可能在已知携带此类融合的肿瘤中变得具有治疗相关性(例如,具有毛样特征的高级别星形细胞瘤,弥漫性软脑膜胶质神经元肿瘤或毛细胞星形细胞瘤;ESCAT 1B)。
对于成人型弥漫性胶质瘤患者,如果标准治疗方案已用尽,临床状况仍然足够好,并且有关于最有可能检测到的融合的临床试验,应考虑使用特定 NGS panel 进行融合检测。(2024 年 4 月)
关于H3 K27变异检测和治疗的综合建议
弥漫性中线胶质瘤应进行 H3 p.K28(K27)变异检测,作为 WHO CNS5 分类中提出的标准诊断的一部分。目前,H3 K27 突变还不能作为特定分子药物的直接靶点,尽管 ONC201 用于复发性疾病的早期试验表明了活性(ESCAT IIB;ESMO MCBS 2 级),以及针对复发性和新诊断肿瘤的 II 期和 III 期试验正在进行中。对于 H3 p.K28(K27)变异的肿瘤患者,应考虑在初始诊断(最好)或复发时转诊至有试验选择的中心。(2024 年 4 月)
关于PTEN/PI3K变异检测和治疗的综合推荐
尽管胶质瘤(尤其是胶质母细胞瘤)中磷酸酶和张力蛋白同系物(PTEN)/磷脂酰肌醇 3-激酶(PI3K)通路激活的频率较高,但由于缺乏有效的疗法(ESCAT IIIA),不建议对这些变异进行常规检测。PTEN/PI3K 变异的检测应仅限于临床状况良好且有临床试验选择的患者。(2024 年 4 月)
关于RET突变检测和治疗的综合建议
在胶质瘤、胶质神经元或神经元肿瘤成人患者中,转染过程中重排(RET)变异分为 ESCAT IIIA(突变和融合)和 ESCAT IIIB(扩增)靶点;因此,应仅在已用尽标准治疗方案、临床状况足够好且有临床试验选择的患者中考虑检测这些靶点。如果在较广泛、通用的 NGS 检测中识别了 RET 变异,应考虑在临床试验或前瞻性登记研究中进行治疗。(2024 年 4 月)
关于TMB-H、DNA聚合酶和MMR缺陷检测和治疗的综合建议
在新诊断的肿瘤患者中,应考虑对年轻成人(< 50 岁),具有不寻常组织学或分子特征的肿瘤(例如,ATRX 缺失、IDH 野生型高级别胶质瘤,具有严重多形性和/或巨细胞特征的肿瘤,不属于经典分子亚型的肿瘤,或与提示 MMR 缺陷的 DNA 甲基化模式相关的肿瘤(PMMRDIA,“儿童型弥漫性高级别胶质瘤,RTK1型,A亚型”和 “成人型弥漫性高级别胶质瘤,IDH野生型,E亚型”),以及有提示胚系DNA聚合酶或MMR缺陷的个人史或家族史的患者进行MMR突变检测。由于接受免疫检查点阻断治疗的新发高肿瘤突变负荷(TMB-H)或 MMR 缺陷成人胶质瘤患者的前瞻性和回顾性队列目前尚未产生显著缓解率(ESCATIIIA),因此最好在前瞻性登记研究或临床试验中进行治疗,尽管一些国家/地区批准了针对 TMB-H肿瘤的泛癌种检查点阻断疗法。对于治疗后 TMB-H 胶质瘤,免疫检查点阻断疗法的获益报告是个案报道(ESCATIIIB),治疗最好仅限于用尽标准治疗后的试验入组。在烷化剂治疗后肿瘤复发的患者中,复发性肿瘤的 TMB/MMR 缺陷检测仅在有临床试验的 IDH 突变胶质瘤患者、MGMT 启动子甲基化 IDH 野生型胶质母细胞瘤患者或最初对烷化剂有反应的患者中相关,但目前关于疗效的报告不能证明仅仅为了获取组织用于 TMB/MMR 缺陷检测而进行活检是合理的。还应考虑对既往替莫唑胺化疗后复发的 IDH 突变胶质瘤进行检测,如果考虑使用烷化剂进行化疗。(2024 年 4 月)
关于IDH变异检测和治疗的综合建议
所有弥漫性胶质瘤都应进行异柠檬酸脱氢酶(IDH)突变检测,来满足标准诊断要求。在接受手术治疗但未接受放疗或化疗的 2 级 IDH 突变型胶质瘤患者中,IDH 突变已被确定为 ESCAT I-A 分子治疗靶点,其使用已获得 FDA 批准。进一步的监管机构批准将影响临床环境中的药物可及性。(2024 年 8 月)
关于MTAP缺失检测和治疗的综合建议
目前没有强有力的证据表明甲硫代腺苷磷酸化酶(MTAP)缺失在胶质瘤中具有诊断、预后或预测作用。应在有临床试验(ESCAT IV)的背景下考虑筛查胶质瘤患者的 MTAP 缺失。如果决定进行检测,关于使用的最佳检测没有共识,应根据试验要求和组织可及性来确定检测。IHC、芯片和 NGS 均已在此环境中报道,并且似乎可行。如果参与试验需要基因检测但不是直接可及,则可以考虑将 IHC 作为一种预筛选策略,以便在基因检测证实 MTAP 缺失之前识别潜在的候选者。(2024 年 4 月)
参考文献:
van den Bent MJ, Franceschi E, Touat M, French PJ, Idbaih A, Lombardi G, Rudaà R, Schweizer L, Capper D, Sanson M, Wesseling P, Weller M, Eoli M, Anghileri E, Bielle F, Euskirchen P, Geurts M, Wen PY, Preusser M. Updated EANO guideline on rational molecular testing of gliomas, glioneuronal, and neuronal tumors in adults for targeted therapy selection - Update 1. Neuro Oncol. 2024 Oct 10:noae213. doi: 10.1093/neuonc/noae213. Epub ahead of print. PMID: 39387386.

本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言
















#胶质瘤# #靶向治疗#
57